miRNA398调控烟草Cu/Zn-SOD基因的表达
周小龙,魏春阳,黄 佳,史艳梅,王 皓,罗朝鹏,李 锋,王 燃*,杨 军,陈继峰,林福呈
1.郑州大学生命科学学院,郑州高新技术产业开发区科学大道100号 450001
2.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
3.中国烟叶公司,北京宣武区广安门外大街9号 100055
植物在正常生长条件下和逆境中均能产生活性氧(reactive oxygen species,ROS),并产生一套复杂有效的系统来维持体内活性氧的平衡[1-2]。在正常生长条件下,植物细胞产生的活性氧能及时被自身的抗氧化系统清除,而当植物处于干旱、淹水、病害和紫外辐射等逆境中时,将导致细胞内大量活性氧的积累,若不及时清除会对细胞造成严重伤害。超氧自由基(O2-·)是活性氧中的一种,是叶绿体光合系统Ⅰ电子传递过程的产物,O2-·应及时在其合成的部位被清除以免产生危害更大的羟基自由基,完成这一任务的是Cu/Zn超氧化物歧化酶(Cu/Zn-Superoxide Diamutase,Cu/Zn-SOD),该酶和O2-·产生的位置均位于细胞叶绿体的类囊体上。Bowler等[3]的研究发现,氧化胁迫可以诱导Cu/Zn-SOD基因的表达来清除过多的O2-·。超氧化物歧化酶(Superoxide dismutase,SOD)是生物体有效清除活性氧的重要抗氧化酶类[4]。Cu/Zn-SOD与植物的抗旱、抗盐碱、耐低温高温等多种抗逆性状密切相关[5]。miRNA是一类内源的、长约20~24个碱基的RNA分子,通过mRNA降解和翻译抑制等方式,特异地对靶基因进行转录后调控。miRNA调控Cu/Zn-SOD基因表达水平的研究源于模式植物拟南芥,有研究表明,Cu/Zn-SOD基因的表达水平取决于miRNA398水平[6]。当植物处于正常生长情况下Cu/Zn-SOD基因进行正常转录,但由于在miRNA398介导下的降解过程其转录产物并不累积,植物受到逆境胁迫(干旱)时miRNA398的表达受到抑制,导致Cu/Zn-SOD基因转录产物的积累,植物进而表现出抗氧化能力。转基因研究结果表明,miRNA398在调控Cu/Zn-SOD基因表达和逆境胁迫中发挥着重要作用[6]。烟草是一种重要的经济作物,其抗逆性尤其是抗旱能力受到普遍关注。烟草miRNA398是否具有调控其Cu/Zn-SOD基因表达的生物学功能,能否通过调控Cu/Zn-SOD基因的表达来实现对逆境胁迫的响应目前尚未见报道。因此,研究和比较了两个烟草品种在正常与逆境胁迫条件下miRNA398和Cu/Zn-SOD基因表达量的变化,并分析了miRNA398结合Cu/Zn-SOD基因的靶位点,旨在揭示烟草miRNA398的生物学功能。
1 材料和方法
1.1 材料
1.1.1 烟苗培养
选用白肋烟B37和烤烟CB-1品种,采用l/3浓度的Hoagland完全营养液水培,具体操作参照田阳阳等的方法[7]。对照组按正常条件管理,干旱处理采用含20%PEG6000(质量体积比)的培养液水培处理2 d后取样。取样时烟株根系先用自来水冲洗,最后用去离子水冲洗干净。吸水纸吸干表面水分后分开根、茎和叶取样。液氮速冻后超低温冰箱中保存,用于RNA提取。
1.1.2 试剂和试剂盒
DNA聚合酶、DNA酶、PMD-19-sample-T载体、One Step PrimeScript®miRNA cDNA合成试剂盒、小RNA提取试剂盒、荧光定量PCR试剂SYBR Premix Ex Taq II和RNA反转录试剂盒均为日本Takara公司产品。
1.1.3 引物
根据烟草(Nicotiana tabacum)Cu/Zn-SOD的CDS保守序列设计引物,用于克隆基因全长编码区引物:上游引物P1 5’-ATGTCAACGGGACCAC-3’,下游引物P2 5’-TTAACCCTGGAGGCC-3’;用于mRNA荧光定量PCR扩增引物:上游引物P3 5’-ATGTCAACGGGACCAC-3’,下游引物P4 5’-TTAACCCTGGAGGCC-3’;miRNA 前体引物,上游引物P5为5’-TGTGTTCTCAGGTCGCCCCTG-3’,下游引物P6为小RNA提取试剂盒自带的Uni-miR定量PCR引物;荧光定量PCR内参基因Actin引物:上游引物5’-CTGGCATTGCAGATCGTATA-3’,下游引物5’-GCGCC ACCACCTTGA TCTT-3’。 除自带引物外,其他引物由宝生物工程有限公司商业合成,纯度为PAGE级。
1.2 试验方法
1.2.1 叶绿素含量的测定
参照曾建敏等[8]的方法测定叶绿素含量,并采用SPSS分析软件进行数据分析。
1.2.2 烟草小RNA和总RNA的提取
采用小RNA提取试剂盒提取烟草叶片小RNA,使用Trizol法提取总RNA。1.2.3 单链cDNA的合成
以所提取的RNA为模板反转录得到cDNA。按照RNA反转录试剂盒说明书,以Oligo(dT)18为引物合成总RNA的cDNA第一链。
1.2.4 定量PCR检测基因的表达
小RNA为模板反转录得到cDNA,分别以miRNA398和Actin引物进行定量PCR反应。反应体系为25μL:SYBR Green PCR Master Mix 12.5μL,miRNA398前体引物 P5(10μmol/L)和Uni-miR定量PCR引物(P6,10μmol/L)各1μL,cDNA模板2μL,灭菌水 8.5μL。反应程序:95 °C预变性3 min;95 °C变性15 s,58 °C退火20 s,72 °C延伸20 s,39个循环;72 °C 延伸10 min。每个PCR反应重复3次。内参基因Actin的PCR采用同样的程序。
总RNA为模板反转录得到cDNA,分别以Cu/Zn-SOD和Actin引物进行定量PCR反应。反应体系为20μL:SYBRPremix Ex Taq II 10μL,引物 P3和P4(10μmol/L)各1μL,cDNA模板2μL,灭菌水6μL。反应程序:95°C预变性3 min;95°C变性15 s,52°C退火20 s,72°C延伸20 s,39个循环;72°C延伸10 min。内参基因Actin的PCR采用同样的程序。每个待测样品cDNA设置3次重复,对得到的 3 个 Cp 值取平均值,用 2-ΔΔCp法计算[9]。
2 结果与分析
2.1 两个品种烟草叶片叶绿素的含量比较
经测定,白肋烟B37的总叶绿素含量比CB-1低(表1)。表1结果表明,CB-1干旱处理后叶绿素含量下降34%,而B37下降45%。同一品种干旱处理后的叶绿素含量比正常条件下降低,说明干旱导致烟草植株质体膜系统受损,引起叶绿体超微结构损伤,叶绿素降解,从而表现为叶绿素含量减少。因此,色素含量分析表明B37比CB-1更容易受到干旱胁迫的损伤。

表1 不同处理烟草样品中的叶绿素含量 (mg/g)
2.2 miRNA398的表达分析
对干旱和对照共4个样品得到的小RNA进行了miRNA398的表达量分析,荧光定量PCR的结果(图1)表明,烤烟CB-1经过干旱胁迫后,miRNA398的表达水平上调,而白肋烟B37经过干旱胁迫后,miRNA398的表达水平下降;且干旱胁迫后CB-1体内的miRNA398表达量显著高于B37,说明miRNA398参与了干旱胁迫的响应,且两个品种对干旱胁迫表现出正应答和负应答两种不同的响应方式。拟南芥受干旱胁迫后,通过miRNA398调控靶基因Cu/Zn-SOD清除植物细胞中活性氧,从而提高植物对逆境反应的耐受性[6]。因此,需要进一步验证两个品种烟草体内Cu/Zn-SOD基因表达的变化。B37体内miRNA398在干旱胁迫条件下表达量下降,可能会引起Cu/Zn-SOD基因表达量的进一步提高而应对逆境胁迫。CB-1体内miRNA398在干旱胁迫条件下表达量上升,因此Cu/Zn-SOD基因表达量可能下降,推测CB-1体内可能是其他的抗氧化机制在应对干旱胁迫,说明miRNA398在两个品种体内对相同胁迫产生了不同的响应。抗旱能力较弱的B37可能是通过低表达miRNA398而获得Cu/Zn-SOD基因的高表达来弥补其抗逆能力的不足。

图1 miRNA398在不同烟草品种中的相对表达量
2.3 Cu/Zn-SOD基因在不同样品中的相对表达情况
对4种处理的样品得到的总RNA进行了Cu/Zn-SOD的表达量分析,荧光定量PCR的结果(图2)表明,正常条件下B37体内的Cu/Zn-SOD表达量显著低于CB-1;在干旱胁迫条件下,B37体内miRNA398表达水平下调,造成靶基因Cu/Zn-SOD的表达量显著提高。Cu/Zn-SOD基因是胁迫信号的应答因子,在正常条件下,Cu/Zn-SOD作为一种抗氧化酶可以将有害的超氧自由基转化为过氧化氢,尽管过氧化氢仍是对机体有害的活性氧,但植株体内的过氧化氢酶和过氧化物酶可以将其完全分解为水,使植物细胞内活性氧的产生与清除处于动态平衡[4]。干旱条件下叶绿素合成受阻,自由基含量上升,Cu/Zn-SOD表达量上升消除了自由基对植物细胞带来的损伤,叶绿素降解减缓,说明B37可能通过低表达miRNA398来提高Cu/Zn-SOD基因的表达量以弥补活性氧清除能力的不足;同时干旱胁迫条件下,miRNA398的表达量进一步下降,引起Cu/Zn-SOD基因表达量的进一步提高,从而增强了烟株的抗氧化能力来应对逆境胁迫。正常情况下,虽然Cu/Zn-SOD基因被转录,但由于miRNA398所介导的特异降解,Cu/Zn-SOD的mRNA并不积累。在干旱胁迫条件下,miRNA398的表达量降低,解除了对Cu/Zn-SOD基因的抑制,即Cu/Zn-SOD基因的mRNA表达量升高。有研究[6]显示,表达具有miR398抗性的Cu/Zn-SOD基因拟南芥突变体,Cu/Zn-SOD基因 mRNA表达量增高,其蛋白却没有增加,这表明miR398可能是通过抑制靶标的翻译进而对靶基因进行负调控。而CB-1在经过干旱处理后,miRNA398的表达水平上调,Cu/Zn-SOD基因的表达量降低,可能是其产生了更加复杂的抗氧化机制。
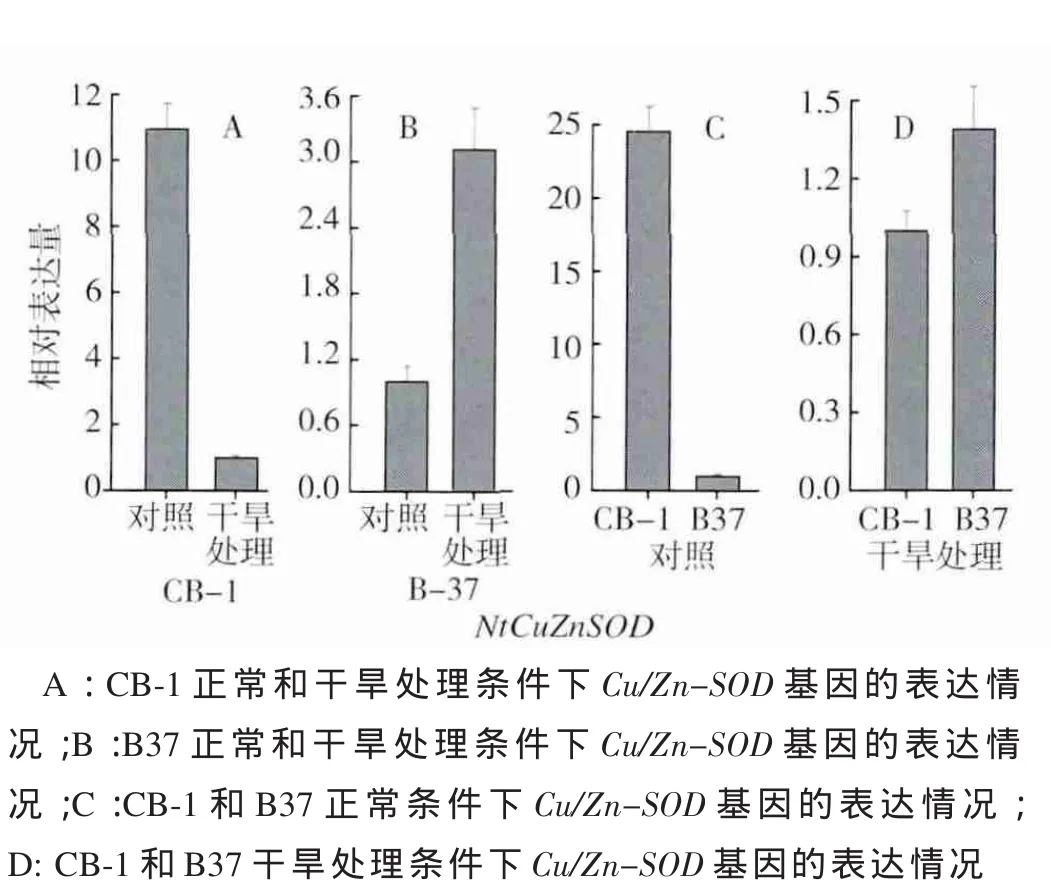
图2 Cu/Zn-SOD基因在不同烟草样品中的相对表达量
2.4 miRNA398和Cu/Zn-SOD基因的结合位点
在植物和动物发育过程中,miRNA和靶mRNA结合的程度和部位不同,会造成不同的作用方式。动物的miRNA多数与其靶mRNA的3′端非翻译区的识别位点以不完全互补的方式结合,以阻碍翻译机器对该mRNA的翻译来调控基因表达。绝大多数的植物miRNA与其靶mRNA的互补位点相似[10]。图3显示,烟草miR398与Cu/Zn-SOD基因的5′非翻译区(5′UTR)有16个碱基互补配对,说明miR398与Cu/Zn-SOD基因的作用位点(结合互补区域)位于该基因的5′UTR。

图3 miRNA398和Cu/Zn-SOD基因结合位点分析
3 结论和讨论
烟草miRNA398与Cu/Zn-SOD基因mRNA作用的位点在该基因的5′UTR区域,表明烟草miRNA398可能参与抑制Cu/Zn-SOD基因的表达。两个烟草品种miRNA398调控Cu/Zn-SOD基因表达对于干旱胁迫的响应不同,干旱胁迫条件下CB-1的miRNA398表达水平上升,B37的miRNA398表达水平下降,而对应CB-1的Cu/Zn-SOD基因表达水平下降,B37的Cu/Zn-SOD基因表达水平上升。对于烟草不同品种相同基因出现不同的表达模式,已有研究发现[11]14个烟草品种中Cu/Zn-SOD基因对于低温弱光胁迫的反应不同,表明其生物学功能在不同品种中可能发生了变化。但miRNA398调控Cu/Zn-SOD基因对逆境胁迫的响应机制尚需要更多的证据。
miRNA398通过介导Cu/Zn-SOD基因mRNA的降解,在多个不同胁迫中可能充当共同的应答元件[12],与植物响应逆境胁迫密切相关;胁迫响应基因的表达多数受转录因子调控,同时在染色质水平、RNA水平和蛋白质水平也受到精细的调控[13]。如miRNA398是植物在铜素缺乏条件下介导铜素蛋白稳定的重要调控因子[14]。miRNA398家族包括miRNA398a,miRNA398b和miRNA398c,Yamasaki等[15]对拟南芥 miRNA398 进行顺式作用元件分析,在miRNA398b和miRNA398c的启动子区域分别发现了8个GTAC序列,而GTAC序列是生物体缺铜应答的必需元件。miRNA398的表达主要依赖于转录因子SPL7直接结合到miRNA398启动子区的GTAC序列。本研究推测miRNA398在两个烟草品种间存在不同的抗逆响应机制,因此,miRNA398的遗传学特征和转录调控机制尚有待进一步研究。
[1] Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction [J].Annu Rev Plant Biol,2004,55:373-399.
[2] Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants [J].Trends Plant Sci,2004,9(10):490-498.
[3] Bowler C,Slooten L,Vandenbranden S,et al.Manganese superoxide diamutase can reduce cellular damage mediated by oxygen radicals in transgenic plants [J].EMBO J,1991,10(7):1723-1732.
[4] Lee S H,Ahsan N,Lee K W,et al.Simultaneous overexpression of both CuZn-superoxide dismutase and ascorbate peroxidase intransgenic tall fescue plants confers increased tolerance to a wide range of abiotic stresses[J].Journal of Plant Physiology,2007,164:1626-1638.
[5] 马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传,2003,25(2):225-231.
[6] 沈亚欧,林海建,张志明,等.植物逆境miRNA研究进展[J]. 遗传,2009,31(3):227-235.
[7] 田阳阳,陈江华,张艳玲,等.不同Cd积累基因型烟草中Cd的亚细胞分布及化学形态[J].烟草科技,2012(2):66-70
[8] 曾建敏,姚恒,李天福,等.烤烟叶片叶绿素含量的测定及其与SPAD值的关系[J].分子植物育种,2009,295(1):227-235.
[9] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)]Method[J].Methods,2001,25:402-408.
[10] Lin H,Gregory J H.MicroRNA:Small RNAs with a big role in gene regulation[J].Nature Reviews,2004,5:522-531.
[11] 史艳梅,王燃,武明珠,等.CuZnSOD基因克隆及在低温弱光胁迫条件下的表达模式分析 [J].烟草科技,2013(11):73-77.
[12] Cheng Z,Ding H, Li L. MiR398 and plant stress responses[J].Physiologia Plantarum.2011,143(1):1-9.
[13] Bhargava S,Sawant K.Drought stress adaptation:metabolic adjustment and regulation of gene expression [J].Plant Breeding,2013,132(1):21-32.
[14] 杨存义,黄兰兰,赵默然,等.miRNA在植物适应土壤胁迫中的作用[J]. 中国农业科技导报,2010,12(1):16-22.
[15] Yamasaki H,Hayashi M,Fukazawa M,et al.SQUAMOSA promoter binding protein-like7 is a central regulator for copper homeostasis in Arabidopsis[J].Plant Cell,2009,21(1):347-361.

