紫草素通过上调Nrf2途径及干预胞内氧化还原平衡稳态诱导A549细胞凋亡
谢 晨,陈韩英,2,钟 晶,王晓琴,2,张 波,2
(1.石河子大学药学院;2.省部共建新疆特种资源植物药重点实验室,新疆石河子 832002)
肺癌居于恶性肿瘤死亡率之首,尽管系统性治疗肺癌有相当大的进步,但固有耐药性和治疗过程中产生的耐药性,极大阻碍了治疗进展,严重影响治疗效果[1]。人非小细胞肺癌A549细胞中内源性抗氧化应激通路Keap1/Nrf2/ARE的果蝇肌动蛋白结合蛋白 Kelch(Kelch-like ECH2 associated protein 1,Keap1)分子完全失活,其受控核因子NF-E2相关因子(nuclear factor erythroid 2-related factor2,Nrf2)高表达,使得A549具有较强的抗氧化能力[2],这也是A549细胞耐药的部分原因。负性调节蛋白Keap1精确调控Nrf2的活性,Nrf2通过与抗氧化反应原件(antioxidant responsive element,ARE)相互作用,调节编码抗氧化蛋白和Ⅱ相解毒酶的表达[3]。Keap1/Nrf2/ARE通路在正常组织中具有抑制肿瘤形成的作用,但是在肿瘤组织中却能促肿瘤组织生长,提高肿瘤细胞耐药性[4]。本研究前期研究表明,紫草素可消耗HL-60细胞谷胱甘肽(glutathione,GSH)进而改变其生长状态[5]。
中医学认为癌症的发生、发展和结局受到内因、外因、非内外因诸多因素的影响,六淫不正之气,循经入脏,渐成气滞血瘀,或蕴湿化热成痰,或化热积毒[6]。中药紫草(Lithospermum erythrorhizon Sieb.et Zucc.)由于具有清热凉血的功效,所以在抗肿瘤方面有成功的实践。紫草素(shikonin,SK)是紫草根中一种萘醌类化合物,大量实验表明,其可抑制包括白血病细胞[7]、结肠癌细胞[8]、骨肉瘤细胞[9]、乳腺癌细胞[10]、人膀胱癌细胞[11]、肝癌细胞[12]和神经胶质瘤细胞[13]等多种肿瘤细胞的增殖。
因此,本研究拟以Nrf2高表达的人非小细胞肺癌A549细胞为模型,研究Nrf2途径在紫草素诱导A549细胞凋亡过程中的作用及其对细胞内氧化还原平衡稳态的影响。
1 材料与方法
1.1 材料 人非小细胞肺癌A549细胞购自中科院上海细胞所。紫草素、GSH合成前体物质N-乙酰半胱氨酸(NAC)、0.25%胰酶-EDTA溶液、噻唑兰(MTT)、DMSO、Hoechst 33258、Giemsa染 液、H2DCFDA购自Sigma公司。CMFDA试剂盒购自Ivitrogen公司。胎牛血清、DMEM-F12培养基购于Gibco公司。全蛋白提取试剂盒、TRIzol总RNA抽提试剂盒(UNIQ-10)、M-MuLV第1链cDNA合成试剂盒购自上海生工。SYBR Premix Ex Taq购自宝生物工程有限公司。人Nrf2 ELISA试剂盒购于上海西唐生物科技有限公司。GSH/GSSG比率检测试剂盒购于ATT Bioquest公司。细胞凋亡线粒体膜电位检测试剂盒购自南京建成生物工程研究所。紫草素溶解在DMSO中配制成100 g·L-1母液,-20℃保存。
1.2 主要仪器 蔡司倒置荧光显微镜(Observer A1,ZEISS,Germany),实时荧光定量 PCR仪(Rotor gene,Qiagen,USA),荧光酶标仪(Varioskan Flash,Thermo,USA)用于本实验。
1.3 细胞培养条件 A549细胞于37℃、5%CO2、饱和湿度的CO2培养箱中培养。使用含有体积分数为10%的胎牛血清的DMEM-F12培养液。指数生长期细胞用于药物处理。
1.4 MTT法检测细胞抑制率 细胞用0、0.4、0.8、1.6、3.2、6.4、12.8、25.6、51.2 mg·L-1共 9个浓度分别处理24 h和48 h后,参照MTT方法[14]在酶标仪上480 nm波长处测定各孔OD值。计算细胞的增殖抑制率,抑制率/% =(OD对照组-OD实验组)/OD对照组×100%,并计算其 IC50值。
1.5 细胞凋亡的检测 通过DNA特异荧光染料(Hoechst33258)染色观察核凋亡形态。Giemsa染色观察细胞形态。分别收集空白组和实验组细胞各1×106个,用500μl JC-1工作液均匀悬浮于37℃在5%CO2培养箱中孵育20 min,离心收集细胞(2 000 r·min-1,5 min),用 500μl染色结合液洗两次,用500μl染色结合液重新悬浮细胞,用荧光酶标仪分别检测 JC-1单体(Ex/Em=490 nm/530 nm)和 JC-1聚合物(Ex/Em=525 nm/590 nm)。
1.6 凋亡相关基因转录水平的影响 本实验使用实时荧光定量PCR检测凋亡分子Bcl-2、Bcl-xl、Bax和Bad mRNA表达变化。使用TRIzol试剂盒提取总RNA。不同处理的细胞样品RNA通过M-MuLV第一链cDNA合成试剂盒进行cDNA第一链合成。以合成的cDNA第一链为模板进行实时荧光定量PCR(按SYBR Premix Ex Taq试剂盒说明进行)。反应条件:93℃变性30 s、72℃延伸40 s、40个循环。Bax,上游引物:5′-TTT CTC ACG GCA CTT CAA C-3′,下游引物:5′-GGA GGA AGT CCA ATG TCC AG-3′(退火温度:57.8℃,cDNA长度:135 bp);Bad,上游引物:5′-GTT CCA GAT CCC AGA GTT TG-3′,下游引物:5′-CCT CCA TGA TGG CTG CTG-3′(退火温度:58.7℃,cDNA长度:186 bp);Bcl-2,上游引物:5′-GAG GAT TGTGGC GTT CTT T-3′,下游引物:5′-CCC AGC CTC CGT TATCCT-3′(退火温度:57.5℃,cDNA长度:152 bp);Bcl-xl,上游引物:5′-ACA TCC CAG CTC CAC ATC AC-3′,下游引物:5′-CGA TCC GAC TCA CCA ATA CC-3′(退火温度:59.8℃,cDNA
长度:175 bp);GAPDH,上游引物:5′-TCA ACG ACC ACT TTG TCA AGC TCA-3′,下游引物:5′-GCT GGT GGT CCA GGG GTC TTA CT-3′(退火温度:63℃,cDNA长度:119 bp)。实时连续测定基因扩增过程中产生的荧光,以达到指数扩增时特定荧光值的循环周数(Ct值)表示目的基因mRNA的表达量。每个样品设3个复孔,Ct取其均值,以GAPDH作为内参照。△Ct=Ct目的基因-CtGAPDH,△△Ct=△Ct处理组-△Ct对照组。不同样本间目的基因表达的相对差异量 =2-△△Ct。
1.7 A549细胞氧化还原态变化的影响 细胞内氧化还原水平的变化以细胞总活性氧和还原性谷胱甘肽的变化表示。使用荧光探针(H2DCFDA)(Ex/Em=488 nm/525 nm)来检测细胞内总活性氧,CMFDA探针检测还原性谷胱甘肽(Ex/Em=492 nm/517 nm)。收集不同浓度紫草素处理的A549细胞,使用终浓度 20μmol·L-1H2DCFDA或5μmol·L-1CMFDA于37℃孵育30 min,用PBS洗掉未进入细胞内的荧光探针,酶标仪检测荧光光度。按GSH/GSSG比率检测试剂盒的操作方法,测得不同浓度标准品的不同吸光度并作出标准曲线,样品对照标准曲线计算出总谷胱甘肽或GSSG的含量,从而计算出GSH/GSSG的比率。
1.8 Nrf2途径的影响 使用实时荧光定量PCR检测Nrf2途径相关分子Nrf2、GPX、Gclc和Gclm mRNA表达变化。Nrf2,上游引物:5′-ACA CGG TCC ACA GCT CAT C-3′,下游引物:5′-TGT CAA TCA AAT CCA TGT CCT G-3′(退火温度:58℃,cDNA长度:263 bp);GPX,上游引物:5′-GGG GCC TGG TGC TCG GCT-3′,下游引物:5′-CAA TGG TGTGGA AGC GGC GGC-3′(退火温度:67.8℃,cDNA长度:354 bp);Gclc,上游引物:5′-ATG ATG CCA ACG AGT CTG AC-3′,下游引物:5′-CGC CTT TGC AGA TGT CTT TC-3′(退火温度:58℃,cDNA长度:312 bp);Gclm,上游引物:5′-AGG AGC TTC GGG ACT GTA TT-3′,下游引物:5′-TGG GCT TCA ATG TCA GGG AT-3′(退火温度:58℃,cDNA长度:103 bp)。使用全蛋白提取试剂盒,获得空白组和紫草素处理组的细胞总蛋白。按照人Nrf2 ELISA试剂盒说明书设计空白调零孔、标准曲线孔、对照空白孔及试验孔进行酶联免疫吸附试验,酶标仪设定在450 nm波长下检测分析,所得数据通过标准曲线得到相应浓度。
1.9 统计学处理 数据以表示,采用t检验法,应用SPSS 19.0统计分析软件进行统计分析。
2 结果
2.1 紫草素对A549细胞增殖的抑制效应 不同浓度的紫草素对A549细胞均有一定的增殖抑制作用,并与处理时间和剂量呈正相关(Fig1)。紫草素浓度小于0.8mg·L-1对A549细胞的抑制率较低,当浓度增加至1.6~6.4mg·L-1时细胞抑制率呈快速上升趋势。紫草素作用24h的半数抑制率浓度为3.2mg·L-1。据此后续实验选择药物浓度为3.2mg·L-1、处理时间为24h进行研究。
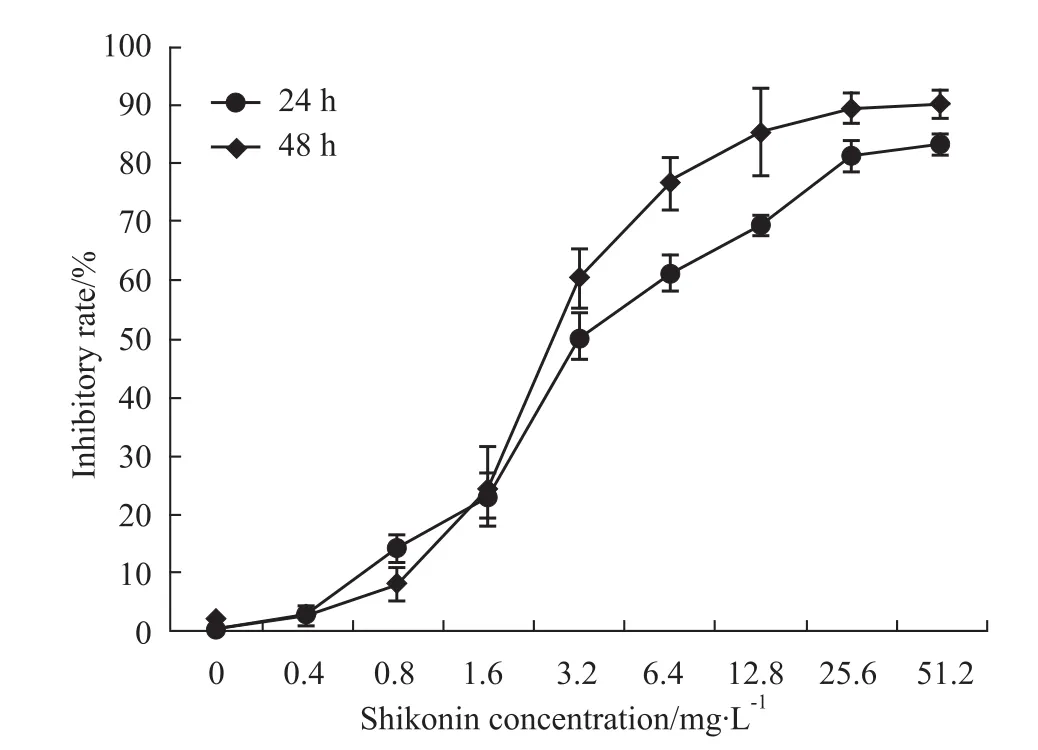
Fig1 InhibitoryrateofSKonA549cellsaftertreatment for24and48hoursA549cellsweretreatedwith0~51.2mg·L-1SKfortimeintervalsof24and48h.ThecytotoxicityofSKonA549cellwasassessedby MTTassay.AnIC50ofSKonA549cellsat24hwas3.2mg·L-1.The resultsshownrepresentativeofthreeindependentexperiments.
2.2 紫草素引起A549细胞凋亡 通过Giemsa染色和Hoechst荧光试剂染色后,正常对照组(Fig2A,2C)细胞结构完整,细胞核呈圆形,细胞界限清晰。3.2mg·L-1紫草素处理24h后,处理组细胞膜呈现囊泡化特殊结构,细胞核不均一(Fig2B,2D)。使用JC-1检测线粒体的损伤,药物处理组JC-1单体明显增加,JC-1聚合物轻微降低(Fig2E)。如Fig 2F所示,与空白组(0mg·L-1)相比,3.2mg·L-1紫草素作用A549细胞24h,促凋亡基因Bax和Bad的表达量明显增加,抗凋亡基因Bcl-2和Bcl-xl的表达量降低。
2.3 紫草素对 A549细胞氧化还原平衡态以及Nrf2途径的影响 为了研究紫草素引起A549细胞凋亡的原因,本实验测定了紫草素引起A549细胞活性氧和还原型谷胱甘肽随时间变化而变化的动态关系。0至4h,A549细胞内活性氧含量降低,8h升至最高后缓慢降低(Fig3A,3B),细胞内GSH含量随时间推移逐渐降低(Fig3A,3C)。GSH/GSSG比值与GSH含量变化趋势一致,随时间增加逐渐降低(Fig3D)。根据活性氧和谷胱甘肽的测定结果,选取8h和24h两个时间点检测Nrf2相关基因的转录水平。如Fig 4所示,与空白组(0 mg·L-1)相比,3.2 mg·L-1紫草素作用A549细胞8 h和24 h,Nrf2、GPX、Gclc和Gclm基因mRNA转录水平都有不同程度的升高。与24 h相比,8 h四个基因的转录水平较高。

Fig2 SKinducesapoptosisinA549cellsA,C:A549cellswithoutSKtreatment.B,D:A549cellstreated with3.2mg·L-1SKfor24h.AandBwerephotoedbylightmicroscopyintermofGiemsastaintoshowthemorphologicalchangesofA549 cells(magnified400×).CandDwerephotoedbyfluorescencemicroscopetoshowthemorphologicalchangesofA549cellnucleus(magnified 100×).E:A549cellsweretreatedwith0mg·L-1and3.2mg·L-1 SKfor24h.MitochondrialmembranepotentialwasdeterminedbyJC-1 staining.F:ThemRNAexpressionlevelsofbad,bax,bcl-2andbcl-xl genesinA549cellsafter24hoftreatmentwith3.2mg·L-1ofSK.*P<0.05,**P<0.01vs0mg·L-1.Theresultsshownrepresentativeof threeindependentexperiments.
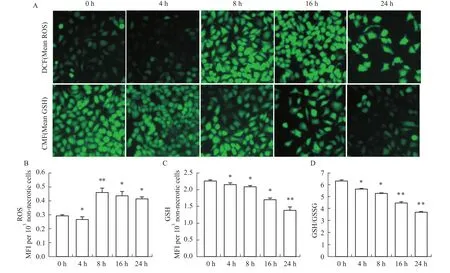
Fig 3 Changes of intercellular redox homeostasis in A549 cellsA:The fluorescence probes DCF and CMFwere used to evaluate the level of the intracellular redox products ROSand GSH in A549 cellsbymicroscopy.The changes of intracellular ROS(B)and GSH(C)levels in A549 cells treated with 3.2 mg·L-1 SK for0,4,8,16 and 24 h.The ROSand GSH levelswere calculated as themean fluorescence intensity(MFI)per1 000 non-necrotic cells.D:The changesof the intracellular GSH/GSSG ratios in A549 cells treated with 3.2 mg·L-1 SK for 0,4,8,16 and 24 h.*P<0.05,**P<0.01 vs0 h.The results shown representative of three independent experiments.
2.4 NAC逆转紫草素对A549抑制增殖的作用为了证明ROS的变化是否影响A549细胞增殖,使用ROS清除剂NAC(200μmol·L-1)预处理 A549细胞2 h后,加入紫草素3.2 mg·L-1处理8 h和24 h。通过MTT检测存活率显示,NAC预处理可以逆转紫草素对A549增殖的抑制(Fig 5)。紫草素作用A549前用NAC预处理明显降低细胞内ROS的产生(Fig 5),Nrf2 mRNA表达量降低(Fig 6),Nrf2蛋白表达量变化不明显(Fig 6)。
3 讨论
紫草素抗肿瘤活性的研究较多,但仅有少量研究证实紫草素能抑制A549细胞增殖,其抑制机制尚不完全明确。在紫草素抗肺癌的体外模型研究中,已有研究表明8.0μmol·L-1紫草素处理A549细胞24 h,明显抑制细胞增殖,2.0μmol·L-1处理24 h,明显抑制A549黏附细胞外基质,侵袭和迁移的能力。此项研究还报道紫草素能够抑制A549细胞中ERK1/2的磷酸化作用,降低了整合素β1 mRNA和蛋白表达量[15]。本实验发现,紫草素对A549细胞24 h的半数抑制率浓度(IC50)为3.2 mg·L-1。上述这些证据说明紫草素有抑制A549细胞的增殖的活性。

Fig 4 Expression of Nrf2,GPX,Gclm and Gclc in different groups detected by real-time PCRThemRNA expression levelsofNrf2,GPX,Gclm and Gclc genes in A549 cells after8 and 24 h of treatmentwith 3.2mg·L-1 of SK.*P<0.05,**P<0.01 vs0 mg·L-1.#P<0.05,##P<0.01 vs24 h(3.2 mg·L-1).The results shown representative of three independentexperiments.

Fig 5 Role of intercellular ROS in SK-induced A549 cell apoptosisA549 cellswere pretreated with 200μmol·L-1 NAC,and exposed to 3.2 mg·L-1 SK for an additional 8 h or 24 h.Cell viability was measured via MTT assay.The effects of the ROSscavenger,NAC,on intracellular ROS levels in A549 cells after 0,4,8,16 and 24 h of SK treatment.SKmeans Shikonin treatment.*P<0.05,**P<0.01 compared to NAC+SK treated group.The results shown representative of three independent experiments.
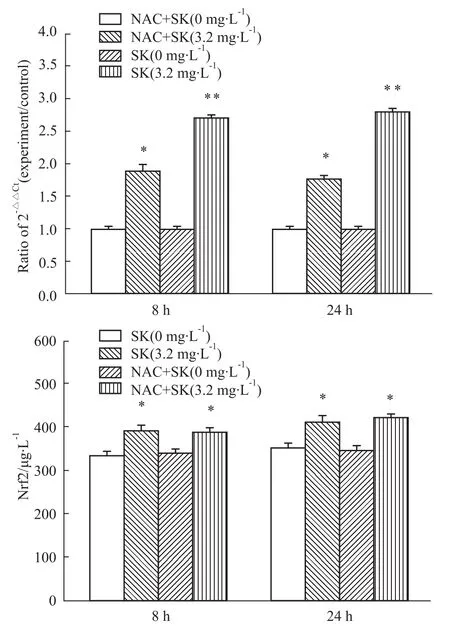
Fig 6 Effects of NAC on m RNA and protein expression levels of Nrf2 in A549 cellsA549 cells were pretreated with 200μmol·L-1 NAC and exposed to 3.2 mg·L-1 SK for an additional8 h or24 h.ThemRNA expression levels of Nrf2 weremeasured via real-time PCR.The protein expression levels of Nrf2 weremeasured by ELISA.SK means Shikonin treatment.*P<0.05,**P<0.01 compared to SK(0 mg·L-1)treated group.The results shown representative of three independent experiments.
在紫草素诱导凋亡机制的研究中,已有研究表明,紫草素能通过激活Caspases通路,诱导细胞凋亡,如 HL-60细胞[7]、A375-S2细 胞[16]、HeLa细胞[14]、COLO 250细胞和结肠癌细胞[8]。本研究中,通过Giemsa和Hoechst染色观察细胞形态,线粒体膜电位检测 JC-1单体增加,说明紫草素能引起A549细胞凋亡。此外,形态学观察过程中,同时发现了坏死细胞。这与最近的一项研究结果类似,除了凋亡,紫草素同样可以引起肿瘤细胞的坏死,不同浓度紫草素处理胃癌细胞6 h,随药物浓度增加,胃癌细胞的坏死率增加伴有少量凋亡,当紫草素处理胃癌细胞24 h时,细胞的凋亡率随浓度增加而增加[17]。也提示了紫草素可能的毒理学效应,在协同减毒增效方面仍有空间。
JC-1是一种广泛用于检测线粒体膜电位△ψ的理想荧光探针。细胞正常状态下线粒体膜电位较高,JC-1聚集在线粒体基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,JC-1为单体不能聚集在线粒体的基质中,此时细胞可能处于细胞凋亡早期或其他情况引起的细胞膜电位降低。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,它发生在细胞核凋亡特征出现之前。但是,这种方法不能区分细胞凋亡或其他原因导致的线粒体△ψ的变化[18]。紫草素处理24 h后,JC-1单体明显增多。形态观察可见坏死细胞,提示JC-1单体增多不完全归于细胞凋亡。
通常化疗药物,例如顺铂、博来霉素、紫杉醇、阿霉素和依托泊苷,通过升高ROS诱导肿瘤细胞凋亡[19-20]。紫草素也可以诱导细胞产生ROS,抑制肿瘤细胞增殖[9,12]。但细胞自身抗氧化能力保护细胞免受氧化应激和凋亡的影响。一些研究表明,Ⅱ相解毒酶(谷胱甘肽硫基转移酶,GSTs)、抗氧化物(谷胱甘肽,GSH)、药物解毒蛋白(多药耐药家族,MRP)在非小细胞肺癌细胞(NSCLC)中表达相对较高[21-22]。本研究通过 H2DCFDA荧光法检测ROS随时间变化情况,CMFDA荧光法和GSH/GSSG比率评价细胞内GSH随时间变化情况。GSH和GSH/GSSG比率呈现出逐渐降低的趋势。有趣的是,紫草素作用A549细胞0至4 h,ROS有轻微下降,8 h ROS含量最高,后至24 h ROS缓慢下降,但没有低过4 h。联系上述文献报道,可推断:紫草素作用A549细胞4 h时引起细胞产生ROS,使细胞处于一个氧化应激状态,在应答初期抗氧化通路Keap1/Nrf2/ARE活性增加,加上A549细胞本身抗氧化基因高表达,因此作用4 h ROS明显降低。4到8 h时间段ROS急速上升而GSH下降,这表明紫草素诱导A549细胞产生的ROS超过了细胞抗氧化应激的临界阈值,抗氧化通路 Keap1/Nrf2/ARE产生的抗氧化物不能抵消紫草素诱导产生的ROS。以上结果表明,紫草素既能上调抗氧化基因,又能诱导产生ROS。这与天然产物通过调控氧化还原态影响肿瘤细胞增殖的作用机制相似,提示这些天然产物既能清除细胞内正常代谢的过氧化氢,又能产生额外的过氧化氢,抑制肿瘤细胞的增殖[23]。
由于肿瘤细胞生长增殖依赖细胞内较高水平的活性氧,因此抗肿瘤药物的研究多集中于细胞内活性氧信号对凋亡调控的作用上。有研究表明,用ROS的清除剂NAC预处理骨肉瘤细胞[9]、HCC细胞[12]和胃癌细胞[17],可以降低紫草素对细胞增殖的抑制作用。本研究中,NAC预处理后,紫草素作用的A549细胞存活率明显上升,细胞内ROS降低,Nrf2途径不需要产生大量抗氧化物清除ROS,因此,Nrf2 mRNA表达降低,但细胞内Nrf2蛋白含量变化不明显的原因有待在以后的研究中探讨。
综上所述,具强烈助氧化特性的紫草素上调A549细胞Nrf2途径进而耗竭细胞抗氧化力使得细胞内的氧化还原平衡向氧化方向切换,进而诱发细胞凋亡。本研究将细胞内氧化还原水平与细胞凋亡联系起来,并探讨了紫草素诱导A549细胞凋亡的可能机制,为肿瘤的治疗及新药研发提供理论依据。
参考文献:
[1] Nadkar A,Pungaliya C,Drake K,et al.Therapeutic resistance in lung cancer[J].Expert Opin Drug Met Toxicol,2006,2(24):753-77.
[2] Singh A,Misra V,Thimmulappa R K,et al.Dysfunctional KEAP1-NRF2 interaction in non-small-cell lung cancer[J].PLoSMed,2006,3(10):1865-76.
[3] 李 航,段惠军.Nrf2/ARE信号通路及其调控的抗氧化蛋白[J].中国药理学通报,2011,27(3):300-3.
[3] Li H,Duan H J.Nrf2/ARE pathway and downstream antioxidant genes[J].Chin Pharmacol Bull,2011,27(3):300-3.
[4] Wang X J,Sun Z,Villeneuve N F,et al.Nrf2 enhances resistance of cancer cells to chemotherapeutic drugs,the dark side of Nrf2[J].Carcinogenesis,2008,29(6):1235-43.
[5] Zhang B,Chen N,Chen H,et al.The critical role of redox homeostasis in shikonin-induced HL-60 cell differentiation via unique modulation of the Nrf2/ARE pathway[J].Oxid Med Cell Longev,2012,2012:781516.
[6] 任小巧,高增平,王景霞,等.抗癌中药药物筛选研究方法思考[J].中华中医药杂志,2013,28(10):2830-3.
[6] Ren X Q,Gao ZP,Wang JX,etal.Thinking of the researchmethod for screening of anti-cancer Chinese herbs[J].China J Tradit Chin Med Pharm,2013,28(10):2830-3.
[7] Yoon Y,Kim Y O,Lim N Y,etal.Shikonin,an ingredientof Lithospermum erythrorhizon induced apoptosis in HL-60 human premyelocytic Leukemia cell line[J].Planta Med,1999,65(6):532-5.
[8] Hsu P C,Huang Y T,Tsai M L,et al.Induction of apoptosis by shikonin through coordinativemodulation of the Bcl-2 family,p27,and p53,release of cytochromec,and sequential activation of caspases in human colorectal carcinoma cells[J].J Agric Food Chem,2004,52(20):6330-7.
[9] Chang IC,Huang Y J,Chiang T I,et al.Shikonin induces apoptosis through reactive oxygen species/extracellular signal-regulated kinase pathway in osteosarcoma cells[J].Biol Pharm Bull,2010,33(5):816-24.
[10]陈菊英,刘朝纯,曾 智,等.紫草素通过PI3K/Akt通路促进人乳腺癌 MCF-7细胞自噬[J].中国药理学通报,2013,29(2):194-8.
[10]Chen JY,Liu Z C,Zeng Z,et al.Shikonin promotes autophagy of MCF-7 human breast cancer cells through PI3K/Akt pathway[J].Chin Pharmacol Bull,2013,29(2):194-8.
[11]Hou Y,Guo T,Wu C,et al.Effect of shikonin on human breast cancer cells proliferation and apoptosis in vitro[J].Yakugaku Zasshi,2006,126(12):1383-6.
[12]Gong K,LiW,Shikonin.a Chinese plant-derived naphthoquinone,induces apoptosis in hepatocellular carcinoma cells through reactive oxygen species:A potential new treatment for hepatocellular carcinoma[J].Free Radical Biol Med,2011,51(12):2259-71.
[13]Chen CH,Lin M L,Ong P L,etal.Novelmultiple apoptoticmechanism of shikonin in human glioma cells[J].Ann Surg Oncol,2012,19(9):3097-106.
[14]张亚宏,甘 莹,郭子华,等.紫草素通过ROS/p38信号通路诱导人宫颈癌HeLa细胞凋亡[J].中国药理学通报,2011,27(6):864-7.
[14]Zhang Y H,Gan Y,Gou ZH,etal.Involvementof ROS/p38 signal pathway in shikonin-induced apoptosis in HeLa cells[J].Chin Pharmacol Bull,2011,27(6):864-7.
[15]Wang H,Wu C,Wan S,et al.Shikonin attenuates lung cancer cell adhesion to extracellularmatrix and metastasis by inhibiting integrinβ1 expression and the ERK1/2 signaling pathway[J].Toxicology,2013,308:104-12.
[16]吴 振,吴立军,田代真一,等.紫草素诱导A375-S2细胞凋亡的分子机制研究[J].中国药理学通报,2005,21(2):202-5.
[16]Wu Z,Wu L J,Ashiro S,et al.Studies on the mechanisms of shikonin-induced A375-S2 cell apoptosis[J].Chin Pharmacol Bull,2005,21(2):202-5.
[17]Lee M J,Kao SH,Hunag JE,et al.Shikonin time-dependently induced necrosis or apoptosis in gastric cancer cells via generation of reactive oxygen species[J].Chem Biol Interact,2014,211:44-53.
[18]刘瑛琪,李天德,楮晓雯,等.利用荧光探针JC-1检测心肌细胞线粒体膜电位改变[J].解放军医学杂志,2002,27(8):716-8.
[18]Liu Y Q,Li T D,Chu XW,et al.Detection ofmitochondrialmembrane potential changes in cardiomyocytes by fluorescent byes JC-1[J].Med JChin People′s Liberat Army,2002,27(8):716-8.
[19]Kurosu T,Fukuda T,Miki T,et al.BCL6 overexpression prevents increase in reactive oxygen species and inhibits apoptosis induced by chemotherapeutic reagents in B-cell lymphoma cells[J].Oncogene,2003,22(29):4459-68.
[20]Masuda H,Tanaka T,Takahama U.Cisplatin generates superoxide anion by interaction with DNA in a cell-free system[J].Biochem Biophys Res Commun,1994,203(2):1175-80.
[21]Soini Y,Napankangas U,Jarvinen K,et al.Expression of gammaglutamyl cysteine synthetase in nonsmall cell lung carcinoma[J].Cancer,2001,92(11):2911-9.
[22]Yang P,Ebbert JO,Sun Z,et al.Role of the glutathionemetabolic pathway in lung cancer treatment and prognosis:a review[J].Clin Oncol,2006,24(2):1761-9.
[23]Loo G.Redox-sensitivemechanisms of phytochemical-mediated inhibition of cancer cell proliferation[J].JNutr Biochem,2003,14(2):64-73.

