酒精依赖综合征治疗药物的研究进展
魏守鹏,梁建辉
(北京大学中国药物依赖性研究所,北京 100191)
酒精是一种非特异性中枢神经系统抑制剂,具有舒缓紧张情绪、消除社交恐惧的效果,已有数千年的人类饮用史,在当今社会仍被大量使用。然而,长期无节制的饮酒会引起机体病理性行为综合征,即酒精依赖综合征(alcohol dependence syndrome,ADS)。这是一类以精神和躯体依赖为特征的临床慢性脑疾病,表现为持续或间断性酒精渴求,强迫性饮酒体验和停饮后的戒断症状,进而伤害患者的身体状况和社会功能,引起相应的医学和社会问题。据调查,我国约有4.7%的成年居民存在过量饮酒的状况[1]。而临床可用的酒精依赖治疗药物种类有限,患者依从性不高[2,3],使得研发新的戒酒药物必要且紧迫。
1 ADS发病机制
ADS与脑内奖赏通路功能紊乱密切相关。酒精的奖赏效应主要由中脑边缘多巴胺能神经元和抑制性GABA反馈神经纤维组成的“奖赏环路”进行传递:前者起源于腹侧背盖区(ventral tegmental area,VTA),而后投射至伏核(nucleus accumbens,NAc)、前额叶皮层(pre-frontal cortex,PFC)、杏仁核和终纹床核;后者则大多起源于NAc,接受神经递质调节后反馈至VTA,从而构成一个相对完整的“效应-反馈-调整”神经通路。正常情况下,包括谷氨酸、γ-氨基丁酸(γaminobutyric acid,GABA)、5-羟色胺(5-hydroxytryptamine,5-HT)、甘氨酸和下丘脑神经激素在内的多种神经递质,都可以通过调节抑制性GABA反馈神经纤维的活动以维持中脑边缘多巴胺系统的兴奋性,如Fig 1A[4]。饮酒情况下,酒精首先作用于特定靶标,包括N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid,NMDA)、GABA、甘氨酸、阿片、5-HT和烟碱型乙酰胆碱(nicotinic ACh,nACh)受体,继而通过相应的神经递质或神经肽系统,减弱中脑边缘多巴胺能神经通路受到的抑制水平,提高 NAc内多巴胺释放水平[5],如 Fig 1B[4]。酗酒情况下,高频酒精刺激可以与奖赏通路结构相互适应,导致后者功能紊乱,诱使ADS发病。
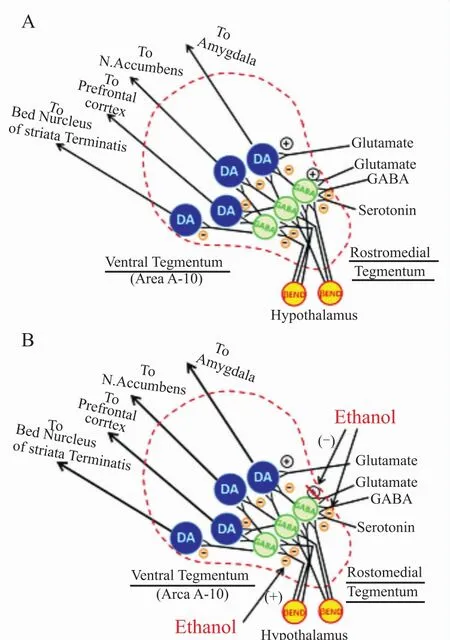
Fig 1 Central nervous rewarding pathwayA:Mesolimbic dopaminergic neurons originate from the VTA and project to the NAc,amygdala,prefrontal cortex and bed nucleusofstraiata terminals,mainly regulated by inhibitory GABA feedback neurons.Many kinds of neurotransmitters including glutamate,GABA,5-HT and β-endorphin can adjust the activity of GABA neurons to affect rewarding effectiveness.B:Alcohol affects rewarding pathway via severalways,like enhancing the levelof neuropeptide secreted by thehypothalamus,inhibiting the activity of glutamate receptor and strengthening the function of GABA receptor,to produce the effect of disinhibition[4].
饮酒者的饮酒行为从自主控制的饮酒体验发展至不受自主控制的强迫饮酒,大致经历3个阶段,即自主饮酒起始期、自主饮酒维持期和酒精依赖期。在自主饮酒起始期,酒精引起的欣快感促使着饮酒者进行反复地饮酒体验,即正性强化作用,而这种强化作用的程度则是由相应受体对酒精的敏感程度控制的,本质上由基因决定。自主饮酒维持期内,除了酒精奖赏引起的正性强化作用外,反复酒精刺激下,奖赏通路功能下调,导致机体脱离酒精后的不适感,即负性强化作用。酒精依赖期内,脑内奖赏通路功能在酒精的作用下达成新的适应状态,负性强化作用强迫个体进行饮酒行为,形成对酒精的依赖。研究表明,急性、短期饮酒情况下,NAc内的DA水平会迅速升高,主要表现为正性强化作用;而慢性、长期饮酒会引起奖赏通路结构重塑以及功能下调,主要表现为负性强化作用[5]。理想的ADS治疗药物应该在安全有效地控制酒精的正性和负性强化作用的基础上,逐渐修复已被异常重塑的中枢神经系统奖赏通路,从而彻底治愈ADS。
2 ADS治疗药物
目前临床可用于干预ADS的药物品种非常有限。美国FDA在过去的60多年内仅批准了4种药物用于ADS症状的改善和治疗,而且,临床反馈的信息证实它们的某些性质使得患者总体依从性不高,从而限制了其在临床上的应用[2-3],见Tab 1。这一背景也促使着人们去寻找新的有效制剂。
目前研究已经发现了多种能够有效改善ADS症状的化合物。它们大多通过作用于GABA受体、甘氨酸转运体、磷酸二酯酶类、阿片受体和神经肽受体,以调节神经中枢奖赏通路结构和功能,从而有效减轻ADS症状(Tab 2)。
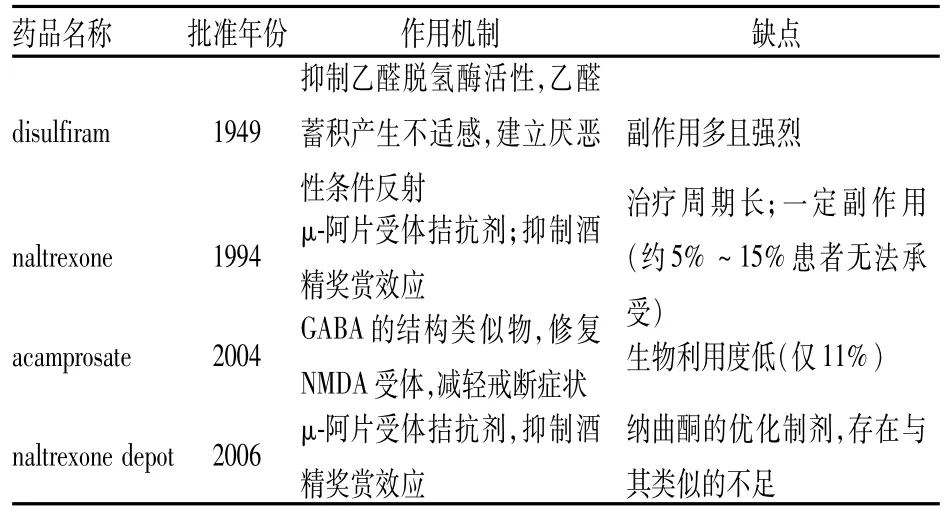
Tab 1 ADS therapeutic agents approved by the US FDA
2.1 作用于GABA受体 酒精可以抑制兴奋性谷氨酸受体功能,降低其对抑制性GABA反馈神经纤维的兴奋作用,从而引起VTA内多巴胺能神经元的脱抑制作用和NAc内DA水平升高。已发现的多种ADS治疗药物能够在抑制酒精引起的奖赏效应的同时,本身也可以将NAc内DA水平升高接近至正常水平,从而消除了酒精负性强化作用,也缓解了ADS戒断症状。目前来看,通过作用于GABA受体来调节奖赏通路活动已成为研发ADS治疗药物的重要思路,其作用靶点主要涉及GABA受体A型(氯离子通道型受体)、B型(G蛋白偶联受体)和B型受体变构位点。

Tab 2 Brief summary of the properties of ADS therapeutic agents
2.1.1 巴氯芬(baclofen) 巴氯芬是GABAB受体选择性激动剂,能够促进突触前膜超极化,抑制钙离子内流和兴奋性递质谷氨酸及天冬氨酸的释放,从而提高GABA神经元活性。巴氯芬抑制酒精对奖赏通路的刺激作用,降低酒精引起的大鼠NAc内多巴胺释放水平。临床实验表明,连续4周口服巴氯芬(30 mg·d-1),酒精依赖者的饮酒量、渴求指数和焦虑程度都明显下降[6]。同时,在减轻患者戒断症状方面,巴氯芬可以取得与地西泮一致的良好效果。该药口服生物利用度约85%,主要经肾脏排出。巴氯芬尚未发现严重不良反应。
2.1.2 托吡酯(topiramate) 托吡酯为果糖氨基磺酸酯类物质,具有抗惊厥作用。托吡酯治疗ADS机制:一方面可以拮抗AMPA和KA谷氨酸受体作用,增强抑制性GABA反馈神经纤维对下游中脑边缘多巴胺系统的抑制,降低酒精引起的NAc内多巴胺释放水平,调低奖赏效应水平;另一方面,阻断相应的L-型钙通道,限制电压依赖钠离子通道开放,易化钾离子通透性,从而减轻酒精戒断症状。托吡酯能够长期抑制酒精依赖的P系嗜酒大鼠的饮酒行为,改善酒精依赖症状[7]。临床的随机双盲对照试验显示,托吡酯能够明显改善ADS症状,减少相关并发症[8]。该药口服生物利用度达到80%,主要经肾脏排出。托吡酯能够致服药者轻度的记忆缺失和注意力损害,尚未发现严重的不良反应。
2.1.3 CGP7930 药理学上将天然配体结合部位称为正构位点,而除此以外的可被小分子调控的位点称为变构位点。作用于相应变构位点的物质称为变构调节剂。研究表明,某些变构调节剂如CGP7930,对酒精依赖症状有明显的改善或治疗作用。该药改善ADS的作用机制尚不清晰,可能通过调节变构位点,增强抑制性GABA神经纤维活动性,从而降低酒精引起的奖赏水平。运用大鼠自身给酒实验,将CGP7930(20 mg·kg-1,ip)与巴氯芬(3 mg·kg-1,ip)疗效对比后,发现两者都能明显降低嗜酒大鼠的饮酒量和渴求程度,且不影响其正常活动[9]。Orru等[10]证实,CGP7930(100 mg·kg-1,ig)能够明显抑制撒丁嗜酒大鼠的摄酒行为:给药后,对于初次接触酒精的大鼠,饮酒量被明显抑制(单日饮酒量低于1 g·kg-1体重);对于已有饮酒经历的大鼠,单日饮酒量可以降低30%~40%。变构调节剂与相应位点的结合具有高度的空间特异性,所以这类药物的副作用往往少且微弱。
2.2 作用于阿片受体 ADS发病与阿片受体系统的激活密切有关。酒精能够提高阿片受体对内源性阿片物质的敏感性以及兴奋阿片受体进而产生吗啡样效应,为饮酒者带来欣快感。酒精代谢产物乙醛与儿茶酚胺反应,生成阿片受体激动剂,从而激活奖赏通路。1980年,Nicoll等[11]证实下丘脑分泌的神经肽(如脑啡肽)可作用于特定阿片受体从而抑制GABA反馈神经纤维的活性,提高中脑边缘多巴胺系统活动性。后来的研究证明酒精可以促进下丘脑神经肽的分泌[12]。基于此,我们提出一个设想,即反复的酒精刺激使脑内阿片受体系统紊乱(下丘脑分泌的神经肽过多,阿片受体敏感性下降),从而诱发ADS。纳曲酮(μ-阿片受体拮抗剂)成功应用于临床ADS的治疗,有力地支持了这一设想。μ-阿片受体拮抗剂纳美芬(nalmefene)在化学结构和药理作用上与纳曲酮相似,同样对ADS具有良好疗效。临床研究证实纳美芬能明显降低受试患者的总饮酒量以及减少过量饮酒天数[13]。Karhuvaara等[14]研究发现,酒精依赖者服用纳美芬后过量饮酒天数明显减少,同时进行的酒精代谢生化指标测定表明,其血清丙氨酸氨基转移酶和γ-谷氨酰基转移酶水平也明显下降,提示纳美芬可以减轻肝脏的受损程度。纳美芬耐受性和患者依从性都很好。
2.3 作用于甘氨酸转运体 甘氨酸(glycine)是中枢神经系统内的一种抑制性神经递质。酒精可以增加甘氨酸与NAc内甘氨酸A型(士的宁敏感型)受体的亲和力,减轻GABA反馈神经纤维对VTA中多巴胺能神经元的抑制,促进NAc内DA释放,提高脑内奖赏水平[15]。脑内甘氨酸水平主要由甘氨酸转运体(glycine transporter,GlyT)调节。GlyT包括GlyT1和GlyT2两种类型:GlyT1能够将突触间隙内的甘氨酸转运到小胶质细胞或谷氨酸能神经细胞内,从而清除多余的甘氨酸;GlyT2则是唯一的可将突触间隙甘氨酸运回甘氨酸能神经细胞前突触的载体。生理状态下,两者共同维持甘氨酸神经递质处于正常水平。研究证实,GlyT1抑制剂可以减少甘氨酸清除,升高突触间隙甘氨酸含量,进而恢复患者奖赏通路功能,治疗 ADS,如 Fig 2[15]。GlyT1抑制剂 Org 25935和Org 24598有效抑制戒断后的复饮行为,并且,通过基因检测表明,服用Org 25935治疗的嗜酒大鼠,其ADS相关基因表达水平下调,接近于从未饮酒的大鼠相应基因表达水平,提示GlyT1抑制剂可能改变了结构或功能蛋白的表达,逐渐重塑了酒精依赖状态下奖赏通路[16]。另外,研究人员将Org 25935的疗效与阿坎酸进行了对比,发现12 mg·kg-1Org 25935比100 mg·kg-1阿坎酸能够更明显地降低嗜酒大鼠饮酒量和酒精偏爱率,且不影响饮水情况,并且,相对于阿坎酸在用药d 7就产生耐受现象,本实验中Org 25935在连续12 d给药后没有出现药效降低的情况[17]。GlyT1抑制剂具有良好的疗效,且不易产生耐受现象,可能成为治疗ADS的理想药物。
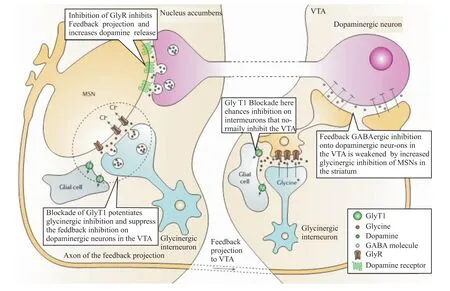
Fig 2 M echanism of ADS treatment by G lyT1 inhibitorsGlyT1 inhibitors can slow the cleaning of glycine in synaptic gaps,suppress the activation of inhibitory GABA feedback neurons,enhance the activity ofmesolimbic dopaminergic neurons and promote DA release in the NAc.It is the way that alcohol stimulates rewarding pathway.GlyT1 inhibitors drive an alcoholic independent of alcoholism via normalizing the function of rewarding pathway and then improving ADS symptoms[15].
2.4 作用于磷酸二酯酶类 酒精可以通过调节NMDA受体磷酸化水平,来调控传递至抑制性GABA反馈神经纤维的兴奋性信号,而cAMP水平则是NMDA受体磷酸化过程中的关键因子。磷酸二酯酶(phosphodiesterases,PDEs)是细胞内降解环核苷酸的唯一途径,对调节环磷酸腺苷(cAMP)的水平起到决定性作用。PDEs是一类可以水解磷酸二酯键的酶类超家族,根据其氨基酸序列和性质方面的差异,PDEs分为11个亚型,其中1、2、3、10、11型对 cAMP和 cGMP都有水解作用,4、7、8型仅对 cAMP起水解作用,5、6、9型则特异性水解cGMP[18]。已有证据证明PDE-4抑制剂对缓解酒精依赖症状有一定效果。FH/Wjd嗜酒大鼠自身给酒实验结果发现,低剂量(≤0.05 mg·kg-1)PDE-4抑制剂咯利普兰(rolipram)能够剂量依赖性地抑制其饮酒量和觅酒次数,降低嗜酒大鼠对酒精的渴求程度,并且不会扰乱其自然偏爱和长期的自主活动[19]。慢性给药实验表明该药不仅在给药期间,即使在停药后的一段时间,也可以维持其治疗效果[19]。这与此前研究人员用C57BL/6J嗜酒小鼠进行的类似实验结果一致[20]。由于第1代PDE-4抑制剂,如咯利普兰和吡拉米司特,可引起呕吐、恶心等不良反应,致使相关临床研究已经停止。但PDE-4抑制剂的良好疗效,也提示这类药物在降低不良反应方面具有巨大的改进空间。
2.5 作用于神经肽受体 目前神经肽/神经激素改善ADS的作用机制尚不清楚。
2.5.1 CRF受体拮抗剂 促肾上腺皮质激素释放因子(CRF)是机体在应激状态下产生并分泌的一种神经肽。CRF由下丘脑室旁核分泌,进入垂体门静脉,作用于垂体前叶高度表达的CRF受体,从而促进促肾上腺皮质激素(ACTH)分泌,调节机体状态和动物行为。已有证据表明CRF1型受体参与ADS的形成。Lowery等[21]研究发现CRF受体拮抗剂9-41可以降低C57BL/6J嗜酒小鼠的饮酒量,减轻其戒断症状,同时,选择性CRF1型受体拮抗剂CP-154,526对应激引起的酒精复饮具有一定的治疗效果。目前,在CRF1型受体拮抗剂类药物中,antalarmin在ADS症状改善方面具有较好的效果。研究表明,antalarmin能减轻嗜酒大鼠的酒精偏爱率,抑制育亨宾诱导的应激焦虑样饮酒和戒酒后复饮行为[22-23]。antalarmin微溶于水(≤1 g·L-1),口服途径难以进入机体内环境,应采用助溶剂溶解后或是静脉注射方式给药。
2.5.2 食欲素受体拮抗剂 食欲素(orexin)是一种下丘脑合成的神经肽,包括A、B两种形式,分别作用于各自受体(即OX1R和OX2R)。研究发现,在VTA区微量注射食欲素后,嗜酒大鼠自主活动性明显增加,兴奋程度提高,并检测到NAc区内多巴胺及其代谢产物有明显增加[24]。在自我给酒试验中,高量饮酒组的嗜酒大鼠与低量饮酒组相比,其下丘脑外侧区和下丘脑穹窿柱周围存在明显增加的食欲素释放细胞[24]。实验发现,分别给予OX1R拮抗剂和OX2R拮抗剂(各30 mg·kg-1,ip)后,嗜酒SD大鼠的酒精偏爱率和绝对饮酒量皆明显下降,而饮水量不受影响[25]。Lawrence等[26]发现OX1R拮抗剂SB-334867可以有效消除线索诱导的酒精复饮行为。OXR拮抗剂类药物可能为ADS的治疗提供新的思路。
2.5.3 神经肽Y(neuropeptide Y,NPY) NPY是一种具有C端酰胺基由36个氨基酸组成的多肽。NPY能够作用于GABA能神经元Y2受体,抑制GABA释放,从而调节人和动物的嗜酒行为。研究发现,过表达NPY的转基因小鼠,酒精摄入量明显降低;而NPY基因敲除的小鼠,则表现为高度焦虑极端嗜酒的状态[27]。嗜酒大鼠杏仁核内NPY含量呈明显低下的水平,当注入一定量的NPY到其杏仁核后,其饮酒量和酒精偏爱率明显降低[28]。目前就NPY临床效果知之甚少,但肯定的是,关于NPY神经效应的研究对认识和治疗ADS有积极意义。
3 结语
ADS治疗尚未有一个理想的方案。传统治疗药物在临床应用上的不足也促使着研究人员寻找更为有效安全的药物。当然,完全解决这一棘手的问题,离不开全社会对该病深刻的认识,对酒精滥用者和依赖者的关怀与支持。另外,我们也应该尝试其他多种途径,如电针刺激等物理手段,来全方位地探索ADS的预防、治疗和康复途径。作为目前最有效的治疗手段,药物治疗应该朝着有效控制依赖症状、防止戒酒后复饮和提高药物安全性方面进行深入研究,以期找到效果令人满意的制剂。
参考文献:
[1] 马冠生,杜松明,郝利楠,等.中国成年居民过量饮酒现况的分析[J].营养学报,2009,31(3):213-7.
[1] Ma G S,Du SM,Hao L N,etal.The prevalence of heavy drinking among adults in China[J].Acta Nutrim Sin,2009,31(3):213-7.
[2] 王小铁,秦伯益.纳曲酮与酒依赖的治疗[J].中国新药与临床杂志,2000,19(3):223-5.
[2] Wang X T,Qin B Y.Naltrexone and alcohol dependence treatment[J].Chin JNew Drugs Clin Rem,2000,19(3):223-5.
[3] Mason B J,Goodman A M,Dixon R M,et al.A pharmacokinetic and pharmacodynamic drug interaction study of acamprosate and naltrexone[J].Neuropsychopharmacol,2002,27(4):596-606.
[4] Tabakoff B,Hoffman P L.The neurobiology of alcohol consumption and alcoholism:an integrative history[J].Pharmacol Biochem Behav,2013,113:20-37.
[5] Soderpalm B,Ericson M.Neurocircuitry involved in the development of alcohol addiction:the dopamine system and its access points[J].Curr Top Behav Neurosci,2013,13:127-61.
[6] Addolorato G,Caputo F,Capristo E,et al.Rapid suppression of alcoholwithdrawal syndrome by baclofen[J].Am JMed,2002,112(3):226-9.
[7] Lynch W J,Bond C,Breslin F J,et al.Severity of drinking as a predictor of efficacy of the combination of ondansetron and topiramate in ratmodelsof ethanol consumption and relapse[J].Psychopharmacology(Berl),2011,217(1):3-12.
[8] Johnson B A,Ait-Daoud N,Akhtar F Z,etal.Oral topiramate reduces the consequences of drinking and improves the quality of life of alcohol-dependent individuals:a randomized controlled trial[J].Arch Gen Psychiatry,2004,61(9):905-12.
[9] Liang JH,Chen F,Krstew E,et al.The GABA(B)receptor allosteric modulator CGP7930,like baclofen,reduces operant selfadministration of ethanol in alcohol-preferring rats[J].Neuropharmacology,2006,50(5):632-9.
[10]Orru A,Lai P,Lobina C,etal.Reducing effectof the positive allosteric modulators of the GABA(B)receptor,CGP7930 and GS39783,on alcohol intake in alcohol-preferring rats[J].Eur J Pharmacol,2005,525(1-3):105-11.
[11]Nicoll R A,Alger B E,Jahr C E.Enkephalin blocks inhibitory pathways in the vertebrate CNS[J].Nature,1980,287(5777):22-5.
[12]Cowen M S,Lawrence A J.The role of opioid-dopamine interactions in the induction and maintenance of ethanol consumption[J].Prog Neuropsychopharmacol Biol Psychiatry,1999,23(7):1171-212.
[13]Mann K,Bladstrom A,Torup L,et al.Extending the treatment options in alcohol dependence:a randomized controlled study of asneeded nalmefene[J].Biol Psychiatry,2013,73(8):706-13.
[14]Karhuvaara S,Simojoki K,Virta A,et al.Targeted nalmefene with simple medicalmanagement in the treatment of heavy drinkers:a randomized double-blind placebo-controlled multicenter study[J].Alcohol Clin Exp Res,2007,31(7):1179-87.
[15]Harvey R J,Yee B K.Glycine transporters as novel therapeutic targets in schizophrenia,alcohol dependence and pain[J].Nat Rev Drug Discov,2013,12(11):866-85.
[16]Vengeliene V,Leonardi-Essmann F,SommerW H,etal.Glycine transporter-1 blockade leads to persistently reduced relapse-like alcohol drinking in rats[J].Biol Psychiatry,2010,68(8):704-11.
[17]Molander A,Lof E,Stomberg R,et al.Involvement of accumbal glycine receptors in the regulation of voluntary ethanol intake in the rat[J].Alcohol Clin Exp Res,2005,29(1):38-45.
[18]李灵君,韩尚河,陈国良.磷酸二酯酶-4抑制剂的研究进展[J].沈阳药科大学学报,2013,30(7):568-76.
[18]Li L J,Han SH,Chen G L.Advances in research of phosphodiesterase-4 inhibtors[J].J Shenyang Pharm Univ,2013,30(7):568-76.
[19] Wen R T,Zhang M,Qin W J,et al.The phosphodiesterase-4(PDE4)inhibitor rolipram decreases ethanol seeking and consumption in alcohol-preferring Fawn-Hooded rats[J].Alcohol Clin Exp Res,2012,36(12):2157-67.
[20]Hu W,Lu T,Chen A,etal.Inhibition of phosphodiesterase-4 decreases ethanol intake in mice[J].Psychopharmacology(Berl),2011,218(2):331-9.
[21]Lowery E G,Spanos M,Navarro M,et al.CRF-1 antagonist and CRF-2 agonist decrease binge-like ethanol drinking in C57BL/6J mice independent of the HPA axis[J].Neuropsychopharmacol,2010,35(6):1241-52.
[22]Lodge D J,Lawrence A J.The CRF1 receptor antagonistantalarmin reduces volitional ethanol consumption in isolation-reared fawnhooded rats[J].Neuroscience,2003,117(2):243-7.
[23]Marinelli PW,Funk D,Juzytsch W,et al.The CRF1 receptor antagonist antalarmin attenuates yohimbine-induced increases in operant alcohol self-administration and reinstatementof alcohol seeking in rats[J].Psychopharmacology(Berl),2007,195(3):345-55.
[24]Korotkova TM,Sergeeva O A,Eriksson K S,et al.Excitation of ventral tegmental area dopaminergic and nondopaminergic neurons by orexins/hypocretins[J].JNeurosci,2003,23(1):7-11.
[25]Moorman D E,Aston-Jones G.Orexin-1 receptor antagonism decreases ethanol consumption and preference selectively in high-ethanol-preferring Sprague-Dawley rats[J].Alcohol,2009,43(5):379-86.
[26]Lawrence A J,Cowen M S,Yang H J,et al.The orexin system regulates alcohol-seeking in rats[J].Br JPharmacol,2006,148(6):752-9.
[27]Gilpin NW.Neuropeptide Y(NPY)in the extended amygdala is recruited during the transition to alcohol dependence[J].Neuropeptides,2012,46(6):253-9.
[28]Gilpin NW,Misra K,Herman M A,et al.Neuropeptide Y opposes alcohol effects on gamma-aminobutyric acid release in amygdala and blocks the transition to alcohol dependence[J].Biol Psychiatry,2011,69(11):1091-9.

