四物汤效应成分基于CYP酶的相互作用研究
谭 妍,沈国林,庄笑梅,李 桦,高 月
(军事医学科学院1.毒物药物研究所、2.放射与辐射医学研究所,北京 100850)
四物汤是中医经典良方,见于宋代《太平惠民和剂局方》,是治疗血虚证的首选药,由熟地、当归、白芍和川芎4味药组成,临床上用于补血、活血和调经。近年研究发现,它还具有调节心血管功能、抗放射线损伤、抗自由基损伤、调节免疫功能等药理学作用[1-2]。高月等[3-4]通过四物汤的方证结合研究以及分子中药的组学研究,确定了四物汤促进造血作用的主要效应成分是果糖、阿魏酸、芍药苷和川芎嗪,它们的药理作用和动物药代动力学已有报道[2,5]。
中药复方具有多组分、多作用靶点的特点。配伍使用时,不同中药的众多成份间构成了复杂的相互作用体系,包括药效学和药代动力学两个层面上的相互作用,形成了复方整体效应的重要基础。细胞色素P450酶(CYP)是介导体内药物代谢清除的主要酶系,也是导致药物代谢性相互作用的重要因素。研究中药有效成分对CYP酶的抑制和诱导作用,对于代谢性相互作用的评价及其内在机制的理解,具有重要意义[6]。我们的前期工作表明,CYP酶参与了四物汤主要效应成分芍药苷、川芎嗪和阿魏酸的代谢[7-8]。除了阿魏酸和川芎嗪对CYP酶的抑制或诱导作用已有初步研究外[6,9],其他效应成分及配伍对CYP酶的作用尚未见报道。为此,本文在体外人肝微粒体 (human liver microsome,HLM)和大鼠肝细胞孵育体系中,评价了四物汤效应成分及其配伍对6个常见CYP同工酶的抑制和诱导活性,为从代谢角度解释中药方剂的配伍规律提供实验资料和依据。
1 材料与方法
1.1 药品与仪器 果糖(批号:100231-200904)、阿魏酸(批号:110773-201012)、芍药苷(批号:110736-201035)和川芎嗪(批号:110817-201006)标准品均购自中国食品药品检定研究院。CYP1A和CYP3A的阳性诱导剂3-甲基胆蒽和苯巴比妥钠、盐酸普萘洛尔(内标)、CYP同工酶的特异性底物非那西丁(CYP1A2)、安非他酮 (CYP2B6)、甲苯磺丁脲(CYP2C9)、S-美芬妥因(CYP2C19)和右美沙芬(CYP2D6)购自 Sigma公司;咪达唑仑(CYP3A4)、CYP同工酶的代谢产物对乙酰氨基酚(CYP1A2)均购自中国食品药品检定研究院;羟基安非他酮(CYP2B6)、4-羟基甲苯磺丁脲(CYP2C9)、4-羟基美芬妥因(CYP2C19)、右啡烷(CYP2D6)、1′-羟基咪达唑仑(CYP3A4)、混合人肝微粒体(蛋白含量20 g·L-1,批号34689)购自BD Gentest公司。肝细胞培养液购自Gibco公司。甲醇(色谱纯)和乙腈(色谱纯)为Fisher公司产品。清洁级♂ SD大鼠,体质量(220±20)g,由军事医学科学院实验动物中心提供,动物许可证号 SCXK(军)2007-004。UHPLCMS/MS液质联用系统由Agilent UHPLC 1290液相色谱和Agilent6410B三重四级杆串联质谱组成,色谱柱为 Agilent ZORBAX SB C18柱(100 mm×3.0 mm,3.5μm)。
1.2 实验分组 实验分为药物组和对照组,药物组设置 15个组别(Tab 1),包括果糖(G)、阿魏酸(A)、芍药苷(S)和川芎嗪(C)单药组、两药组、三药组和四药组。

Tab 1 Experimental grouping for CYP inhibition and induction studies
1.3 大鼠原代肝细胞的分离和培养 依据文献,采用两步灌流法分离并获得大鼠原代肝细胞,“三明治”夹心法培养原代肝细胞[10],肝细胞密度为109·L-1。
1.4 孵育条件 CYP酶抑制实验:用pH 7.4的K2HPO4缓冲液配制总体积为250μl的反应体系,其中含 NADPH再生系统(1 mmol·L-1NADP、5 mmol·L-16-磷酸葡萄糖、1 kU·L-16-磷酸葡萄糖脱氢酶和3.3 mmol·L-1氯化镁),人肝微粒体0.2 g·L-1,CYP酶探针底物非那西丁(50μmol·L-1)、安非他酮(100μmol·L-1)、甲苯磺丁脲(120 μmol·L-1)、S-美芬妥因(40μmol·L-1)、右美沙芬(5μmol·L-1)和咪达唑仑(5μmol·L-1),系列浓度的阳性抑制剂或各实验药物。平行设置药物组、阳性抑制剂组和阴性对照组。药物组各成分的浓度为 0、0.15、0.5、1.5、5、10、50和 100μmol·L-1。参照本实验室前期研究设置阳性抑制剂及其浓度范围[11]:α-萘黄酮、奎尼丁和酮康唑的浓度为0、0.003、0.015、0.06、0.3、1.5和 6μmol·L-1;噻氯匹定为 0.015、0.05、0.15、0.5、1.5、5、10和 50 μmol·L-1;磺胺苯吡唑为 0、0.03、0.15、0.6、3、15和60μmol·L-1;反苯环丙胺为 0、0.3、1.5、6、30、150和600μmol·L-1,每组每个浓度3个复管。阴性对照组不加待测药物或阳性抑制剂。将各组于37℃水浴中孵育30 min,加入沉淀剂250μl终止反应,涡旋,13 800×g、4℃离心10 min,取上清进样分析,测定探针底物的产物生成量,计算相对酶活性和对应的IC50。
CYP酶诱导实验:实验平行设置阴性对照组、阳性诱导剂对照组以及药物组(Tab 1)。大鼠肝细胞来自3个供体,每组每个浓度2个复管。将分离得到的大鼠原代肝细胞用含实验药物(药物分组同抑制实验)或阳性诱导剂的培养液培养72 h;诱导期结束后,洗去培养液,换用含探针底物咪达唑仑(CYP3A,10μmol·L-1)或非那西丁(CYP1A,50 μmol·L-1)的细胞培养液孵育1 h;孵育终点每孔取孵育液 200μl,用 200μl含内标的甲醇/乙腈(1∶1)终止反应,13 800×g、4℃离心10min,取上清液进样分析,得到各探针底物的产物生成量,得到酶活性。药物组各成分的终浓度为10、25和50 μmol·L-1,阳性诱导剂组 3-甲基胆蒽(CYP1A2)和苯巴比妥钠(CYP3A1/2)的终浓度均为 1μmol·L-1和1 mmol·L-1,空白对照组的细胞孵育液不含药物或阳性抑制剂。
1.5 HPLC-MS/MS条件 应用本实验室已建立的LC-MS-MS方法,定量检测孵育体系中的6个探针代谢产物[11]。流动相A为含0.1%甲酸和5 mmol·L-1甲酸铵的纯水,流动相B为含0.1%甲酸的乙腈,梯度洗脱,内标为盐酸普奈洛尔(50μg·L-1)。以ESI+源MRM方式进行质谱检测,各代谢产物的反应离子对为 m/z:152.1/110.1(对乙酰氨基酚,CYP1A2)、256.7/239.1(羟基安非他酮,CYP2B6)、287/171.1(4-羟 基 甲 苯 磺 丁 脲,CYP2C9)、235.2/150.1 (4-羟 基 美 芬 妥 因,CYP2C19)、258.2/157.1(右啡烷,CYP2D6)、342.1/324.1(1′-羟基咪达唑仑,CYP3A4)、260/116.2(盐酸普萘洛尔,内标)。毛细管温度300℃,毛细管电压+4 000 V,雾化电压172.375 kPa,干燥气流速10 L·min-1。
1.6 数据处理 CYP酶抑制实验:由探针底物代谢产物的生成量计算CYP酶的相对活性,由公式1计算不同浓度药物作用下的相对酶活性Er:
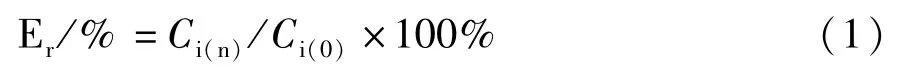
式中,Ci(n)为不同药物组浓度的代谢产物生成量,Ci(0)为空白对照组的代谢产物生成量。以相对酶活性Er为纵坐标,药物组浓度的对数值为横坐标,由GraphPad Prism 5软件绘制抑制曲线并计算IC50值,以此来评价药物对CYP酶的抑制作用。
对于IC50>100μmol·L-1的药物组,用抑制率评价其对CYP酶的抑制作用。由不同浓度药物组的Ci(n)与空白组 Ci(0)的比值,计算 CYP酶的抑制率。
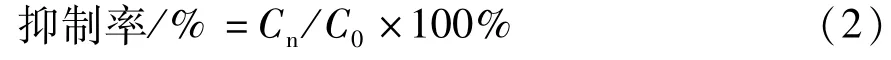
CYP酶诱导实验:参考美国FDA推荐的酶诱导评价标准[12,17-18],以受试药组酶活性相对于空白对照组的提高≥阳性对照组酶活性提高的40%,为受试药酶诱导作用的阈值。由公式2计算受试药组相对于阳性组的诱导百分比Er.ind。
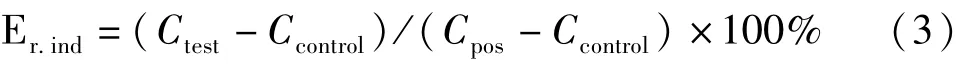
式中,Ctest、Ccontrol和 Cpos分别代表受试药组、空白对照组和阳性对照组探针底物代谢产物生成量。统计学检验采用成组t检验进行。
2 结果
2.1 CYP酶抑制活性评价 首先用已知的阳性抑制剂,验证肝微粒体孵育体系。得到的阳性抑制剂IC50值均在文献报道的范围[13],表明孵育体系满足CYP酶抑制活性的评价要求。
在0.15~100μmol·L-1的浓度范围内,各单药和配伍组对CYP3A4和CYP2D6的活性无影响。CYP1A2、2B6、2C9和2C19的酶活性随药物浓度增高呈现下降趋势,但抑制作用很弱,在最高抑制浓度(100μmol·L-1)对人肝微粒体 CYP1A2、2B6、2C9和2C19的抑制率均<62%。Tab 2展示了在100 μmol·L-1水平酶抑制率>40%的药物组结果。将各药物组的剩余酶活性对对数抑制浓度作图,得到的IC50值均>100μmol·L-1,表明各单药和配伍组对本研究测试的6个CYP同工酶活性无明显的抑制作用。
Tab 2 Inhibitory effects of active components and their combinations on CYP isoforms at concentration of 100μmol·L-1
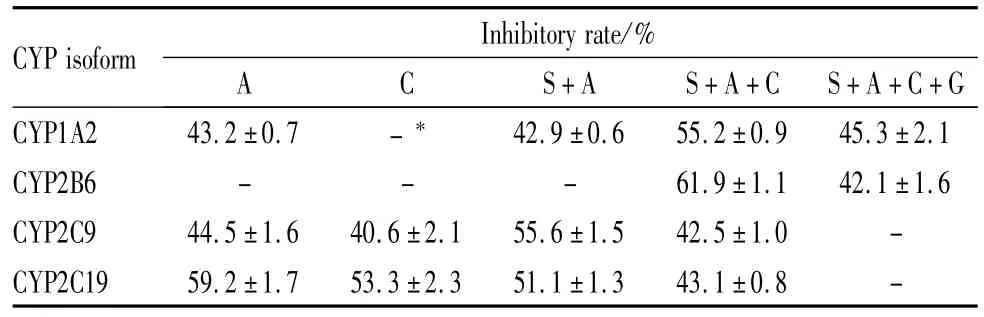
Tab 2 Inhibitory effects of active components and their combinations on CYP isoforms at concentration of 100μmol·L-1
*Inhibitory rate<40%.
CYP isoform Inhibitory rate/%S+A S+A+C S+A+C+G CYP1A2 43.2±0.7 -*A C 42.9±0.6 55.2±0.9 45.3±2.1 CYP2B6 - - - 61.9±1.1 42.1±1.6 CYP2C9 44.5±1.6 40.6±2.1 55.6±1.5 42.5±1.0 -CYP2C19 59.2±1.7 53.3±2.3 51.1±1.3 43.1±0.8-
2.2 CYP酶诱导活性评价 将 CYP1A2和CYP3A1/2的阳性诱导剂3-甲基胆蒽和苯巴比妥钠分别与“三明治”夹心培养大鼠肝原代细胞孵育72 h,与不加诱导剂的空白对照组相比,3-甲基胆蒽组酶活性的诱导倍数为11.8,苯巴比妥钠组酶活性的诱导倍数为4.8,表明所建立的大鼠肝细胞诱导模型符合要求,可用于药物 CYP酶诱导活性的评价[18]。
研究结果显示,果糖、阿魏酸、芍药苷、川芎嗪的单药和配伍组,在不同浓度水平对大鼠肝细胞CYP3A1/2酶活性的提高均低于阳性诱导剂组的40%,表明4个单药及其配伍对大鼠CYP3A酶无明显的诱导作用。对于CYP1A2酶,芍药苷的药对和配伍组(S+A、S+C、S+A+C、S+A+G、S+C+G、S+A+C+G)在 25μmol·L-1和 50μmol·L-1浓度水平,对CYP1A酶活性的提高均大于阳性诱导组的40%(Fig1),显示了酶诱导作用。芍药苷单药及其与果糖的药对组(S和S+G)在50μmol·L-1时对CYP1A2也有一定的诱导作用。以芍药苷单药(S)及其与阿魏酸和川芎嗪的配伍组(S+A+C)为例,在50μmol·L-1时,两组的CYP1A酶活性分别为空白对照组的4.4和10.2倍,酶活性的提高是阳性对照组的45.5%和86.6%(Tab3),表明芍药苷与阿魏酸和川芎嗪合用对大鼠CYP1A酶有明显的诱导作用。

Fig1 Inductioneffectsofactivecomponentsand theircombinationsonCYP1A2horizontalline:Cutoffvalueof40%ofpositivecontrol,NC:Negativecontrol,PC:positivecontrol.
3 讨论
中药复方按中医理论和经验用药,是中药临床应用的主要形式,也是其特色和优势。中药复方配伍使用时,多种有效成分之间构成的相互作用体系,是中药配伍整体效应物质基础的一部分。中药有效成分之间、以及与其他中药或西药基于CYP酶抑制和诱导的相互作用,可以通过改变有效成分或合用药物的药代动力学行为,影响它们的药理效应或产生毒副作用[14-15],这是中药成分间相互作用和配伍的主要机制之一[16]。
Tab3 Inductioneffectsofpeoniflorinanditscombinationswith ferulicacidandligustrazinonCYP1A2inrathepatocyte
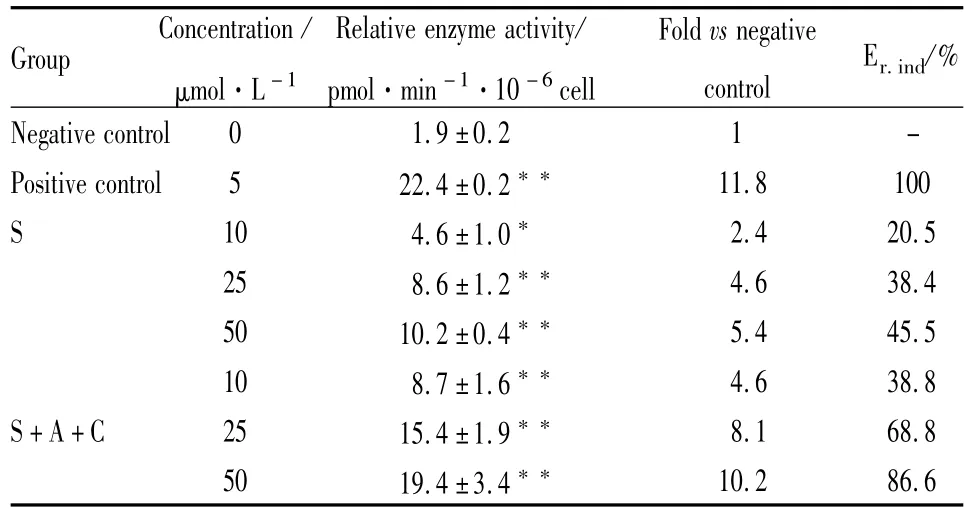
Tab3 Inductioneffectsofpeoniflorinanditscombinationswith ferulicacidandligustrazinonCYP1A2inrathepatocyte
*P<0.05,**P<0.01vsnegativecontrol.
Group Concentration/μmol·L-1 Relativeenzymeactivity/pmol·min-1·10-6cell Foldvsnegative control Er.ind/%Negativecontrol 0 1.9±0.2 1 -Positivecontrol 5 22.4±0.2** 11.8 100 S 10 4.6±1.0* 2.4 20.5 25 8.6±1.2** 4.6 38.4 50 10.2±0.4** 5.4 45.5 10 8.7±1.6** 4.6 38.8 S+A+C 25 15.4±1.9** 8.1 68.8 50 19.4±3.4**10.2 86.6
本研究在人肝微粒体和大鼠原代肝细胞试验体系中,评价和分析了四物汤效应成分单药、药对和多药配伍组的CYP酶抑制和诱导作用。人肝微粒体的体外抑制结果表明,在浓度为0.15~100μmol·L-1时,四物汤各效应成分、药对及配伍对6个CYP同工酶均无明显的抑制作用,它们在临床上引起CYP抑制相互作用的可能性较小,体现了四物汤君臣佐使配伍在代谢酶抑制方面的完整性。
本研究以酶活性作为CYP酶诱导评价终点。由于体外肝细胞试验与体内肝脏的环境不同,药物体外对肝细胞的作用与体内给药经历吸收、分布、排泄和代谢过程导致药物浓度的差异,以及体外试验因实验条件的不同而结果差异较大等原因,使得肝细胞诱导评价结果的判断相对困难。尽管与空白对照组相比,有些药物能明显提高肝细胞的酶活性,但在体内不一定具有临床意义的诱导作用。为此,美国FDA和制药协会推荐用受试药对酶活性的提高≥40%的阳性对照活性提高为阈值,以此判定受试物是否具有CYP酶诱导活性[12,17-18]。体外肝细胞诱导实验的结果是否可被接受,还取决于阳性诱导剂的选择及其对细胞的诱导能力。本研究分别选用大鼠CYP1A2和CYP3A1/2的特异性诱导剂3-甲基胆蒽和苯巴比妥[18]作为阳性对照,在大鼠肝细胞体系中,二者分别将 CYP1A2和3A1/2的活性提高11.8和4.8倍,表明孵育体系可用于受试药的评价[18]。
本研究中,所有试验组的相对酶活性与空白对照组相比,均有明显提高(P<0.05或P<0.01),但根据40%阳性对照的阈值[12],药效成分单体中只有芍药苷对CYP1A2表现出一定的诱导潜能,在50 μmol·L-1浓度水平,CYP1A2活性的提高为阳性组的45.5%;当芍药苷与阿魏酸、川芎嗪以不同形式配伍时,在25μmol·L-1浓度水平CYP1A2活性提高为阳性组的68.8%,4个药效成分的配伍组(S+A+C+G)对 CYP1A2活性提高是阳性组的66.1%,表现出明显的诱导作用。高月教授课题组将四物汤各味中药及配伍给大鼠连续服用14 d,考察体内酶诱导作用,他们的结果发现,只有服用四物汤复方的大鼠组,CYP1A2酶的mRNA表达水平和酶活性明显增高,提示四物汤各药合用时,可上调CYP1A2的活性[18],本研究的结果与大鼠体内结果相符,同时从药效成分的角度,解释和四物汤CYP1A2酶诱导作用的分子基础。体外肝细胞研究结果表明,芍药苷可能是引起CYP1A2酶诱导的主要分子,其他药效成分与其配伍可明显提高酶诱导活性。
我们的前期研究表明,CYP3A4、2C8和2C9是代谢芍药苷的主要CYP酶表型,CYP1A2酶参与了阿魏酸和川芎嗪的代谢,对阿魏酸和川芎嗪的CYP酶代谢的贡献率分别约为30%和20%。还有研究还表明[19],白芍在四物汤中有反佐作用。FA的CYP1A2酶诱导作用,以及复方合用时酶活性诱导的增强效应,可能是其反佐作用的机制之一,CYP1A2酶的诱导会加快四物汤中阿魏酸和川芎嗪的代谢消除,减弱其药理效应[20]。
对中药复方配伍规律的解释历来是个研究难题,本研究尝试在体外试验体系中,采用通用探针底物方法,评价四物汤效应成分及配伍的CYP酶诱导和抑制作用,为从代谢角度阐明四物汤的配伍规律提供思路和实验基础。本研究得到的体外酶诱导结果及其临床意义,还有待于在动物整体药理学和药代动力学试验中进一步的评价和研究。
参考文献:
[1] 张荣桃.四物汤的现代研究进展[J].北京中医药,2012,31(1):73-5.
[1] Zhang R T.Modern research progression of Siwu decoction[J].Beijing JTradit Chin Med,2012,31(1):73-5.
[2] 李春荣,王升启.四物汤及其单药主要活性成分免疫药理研究进展[J].时珍国医国药,2006,17(9):1624-5.
[2] Li CR,Wang SQ.Progress in the study on the immunomodulatory effect of Siwu Decoction and its active components[J].Lishizhen Med Mater Med Res,2006,17(9):1624-5.
[3] 高 月,马增春,梁乾德,等.四物汤的方证结合研究[J].世界科学技术-中医药现代化★中药研究,2010,12(2):211-6.
[3] Gao Y,Ma ZC,Liang QD,etal.Si-Wu-Tang and blood deficiency[J].World Sci Technol-Moderniz Tradit Chin Med,2010,12(2):211-6.
[4] 马增春,高 月,谭洪玲,等.用分子中药组学技术研究四物汤补血的作用机理[J].世界科学技术-中医药现代化★基础研究,2005,7(2):24-8.
[4] Ma ZC,Gao Y,Tan H L,etal.Study of blood-tonifyingmechanisms of Siwutang of traditional Chinesemedicine by technology of TCM moleculomics[J].World Sci Technol-moderniz Tradit Chin Med,2005,7(2):24-8.
[5] 李爱媛,赵 一.四物汤和兔体内阿魏酸血药浓度测定及其补血作用的研究[J].中国实验方剂学杂志,1999,5(4):42-4.
[5] Li AY,Zhao Y.The determination of drug concentration of ferulic acid in Siwu Decoction and rabbit blood and its effect on blood[J].Chin JExp Tradit Med Form,1999,5(4):42-4.
[6] 艾常虹,孙汉雄,李 桦,等.中药有效成分对细胞色素 P450酶的抑制活性评价[J].中国药理学通报,2011,27(4):519-23.
[6] Ai C H,Sun H X,Li H,et al.In Vitro inhibition of cytochrome P450 activities by active constituents of Chinese herbal drugs[J].Chin Pharmacol Bull,2011,27(4):519-23.
[7] 谭 妍,沈国林,庄笑梅,等.芍药苷的体外代谢性质[J].国际药学杂志,2013,40(5):625-9.
[7] Tan Y,Shen G L,Zhuang X M,etal.Metabolic characteristics of paeoniflorin in vitro[J].J Int Pharm Res,2013,40(5):625-9.
[8] 谭 妍,庄笑梅,沈国林,等.川芎嗪的肝微粒体代谢动力学及代谢表型研究[J].药学学报,2014,49(3):374-9.
[8] Tan Y,Zhuang X M,Shen G L,et al.Investigation ofmetabolic kineticsand reaction phenotyping of ligustrazin by using livermicrosomes and recombinant human enzymes[J].Acta Pharm Sin,2014,49(3):374-9.
[9] 石 杰,陈安进,张 芳,等.血塞通及川芎嗪对细胞色素P450不同亚型代谢酶影响的研究[J].中国中西医结合急救杂志,2008,15(6):342-5.
[9] Shi J,Chen A J,Zhang F,et al.Effects of traditional Chinese medicine Panax notoginoide and Tetramethylpyrazine on cytochrome P450 subtype enzymes[J].Chin J Integr Tradit ChinWest Med Intensive Crit Care,2008,15(6):342-5.
[10]Swift B,Pfeifer N D,Brouwer K L.Sandwich-cultured hepatocytes:an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity[J].Drug Met Rev,2010,42(3):446-71.
[11]沈国林,钟玉环,原 梅,等.超高效液相串联质谱法同时定量检测6个细胞色素P450酶探针代谢产物[J].分析化学,2013,41(4):488-93.
[11]Shen G L,Zhong Y H,Yuan M,et al.Simultaneous quantitation of six cytochrome P450 enzyme probe metabolites by ultra-high performance liquid chromatography tandem mass spectrometry[J].Anal Chem,2013,41(4):488-493.
[12]US FDA.Guidance for industry:drug interaction studies-study design,data analysis,implications for dosing,and labeling recommendations[EB/OL].[2012-2-1].www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM292362.pdf
[13]曹 艳,钟玉环,原 梅,等.欧前胡素和异欧前胡素对人和大鼠肝微粒体细胞色素P450酶的抑制作用[J].中国中药杂志,2013,38(8):1237-41.
[13]Cao Y,Zhong Y H,Yuan M,etal.Inhibitory effectof imperatorin and isoimperatorin on activity of cytochrome P450 enzyme in human and rat livermicrosomes[J].Chin JChin Mater Med,2013,38(8):1237-41.
[14]Rommel G T,David G B.Herbal product-drug interactionsmediated by induction[J].BriClin Pharmacol,2006,61(6):677-81.
[15]Hu Z,Yang X,Ho P C,et al.Herb-drug interactions:a literature review[J].Drugs,2005,65(9):1239-82.
[16]张咏莉,崔玉强,汪向升,等.黄芪颗粒和黄芪注射液对CYP1A2、CYP2D、CYP2C亚酶活性影响的实验研究[J].中国药理学通报,2013,29(4):512-9.
[16]Zhang YL,CuiYQ,Wang XS,etal.Experimental study on effect of astragalus granules and astragalus injection on enzymatic activities of CYP1A2,CYP2D and CYP2C[J].Chin Pharmacol Bull,2013,29(4):512-9.
[17]Zhang L,Zhang Y,Zhao P,et al.Predicting drug-drug interactions:an FDA perspective[J].The AAPS J,2009,11(2):300-6.
[18]刘治军,傅得兴,汤 光.FDA药物相互作用研究指南(草案)2006版解读[J].国际药学研究杂志,2008,35(1):50-8.
[18]Liu Z J,Fu D X,Tang G.Unscramble of PDA guidance for drug interaction study(draft)[J].J Int Pharm Res,2008,35(1):50-8.
[19]梁 淼,马增春,易剑峰,等.四物汤及其配伍对大鼠肝脏P450酶活性及mRNA表达的影响[J].中国中药杂志,2013,38(21):3720-5.
[19]Liang M,Ma Z C,Yi JF,et al.Effect of Siwu decoction and its combined administration on hepatic P450 enzymatic activity and mRNA expression in rats[J].Chin JChin Mater Med,2013,38(21):3720-5.
[20]高 月,刘永学,马增春,等.白芍在四物汤中的反佐作用[J].中国实验方剂学杂志,2004,10(2):26-9.
[20] Gao Y,Liu Y X,Ma Z C,et al.Incompatible effects of BAISHAO in SIWU Decoction[J].Chin JExp TraditMed Form,2004,10(2):26-9.

