多沙唑嗪对映体对大鼠肠系膜微动脉α1受体介导收缩反应的作用
高玲娜,李同荟,赵 静,卢丹丹,任雷鸣
(河北医科大学中西医结合学院,中西医结合研究所,河北石家庄 050017)
消旋多沙唑嗪[racemic-doxazosin,(±)DOX]是一种长效α1受体选择性阻断剂[1],也是治疗良性前列腺增生(benign prostate hyperplasia,BPH)所致下尿路症状(lower urinary tract symptoms,LUTS)的一线药物[2]。(±)DOX含有等量的左旋多沙唑嗪[(-)DOX]以及右旋多沙唑嗪 [(+)DOX][3-4]。在兔离体耳动脉、肠系膜动脉、肺动脉、颈总动脉及胸主动脉,我们首先发现 (-)DOX、(+)DOX和(±)DOX均能拮抗去甲肾上腺素(NA)诱发的血管收缩反应,其中(-)DOX拮抗NA诱发血管收缩的拮抗参数(pA2)明显小于(+)DOX[5-6]。最近我们又发现,(-)DOX和(+)DOX对兔前列腺平滑肌功能性α1A受体的阻断作用强度相同;而(-)DOX对鼠主动脉平滑肌功能性α1D受体的阻断作用明显弱于(+)DOX;特别是(±)DOX和(+)DOX对离体大鼠右心室肌具有显著的负性肌力作用,(-)DOX对大鼠则无明显影响;(-)DOX明显增强大鼠离体左心房肌条的收缩力[7-8]。大鼠连续灌胃给予(-)DOX、(+)DOX和(±)DOX 3个月后,(±)DOX降低清醒大鼠血压的作用明显强于(+)DOX,其中(-)DOX的降压作用十分轻微[9-10]。(-)DOX可能成为心血管不良反应轻微,治疗BPH/LUTS有效的光学纯药物[11-13]。
我们也曾在大鼠肠系膜动脉研究了(-)DOX、(+)DOX及(±)DOX拮抗NA诱发血管收缩的作用,其 pKB值分别为7.985±0.273、9.084±0.319和8.911±0.313[14]。然而,这些用于离体实验的家兔或大鼠的动脉均属于传输血管,其实验结果与清醒大鼠的血压实验结果[10]不完全吻合。因此,本研究采用DMT 620 M微血管张力测定系统,在大鼠离体肠系膜动脉第二级和第三级阻力血管,分析(-)DOX、(+)DOX及(±)DOX对不同直径阻力血管α1受体的阻断作用;以期解释(±)DOX及其对映体降低清醒大鼠血压的可能机制。
1 材料
1.1 仪器 CP213型电子天平,Ohaus Corporation公司;BS210S型电子天平,Sartorius公司;Power-Lab8/35型数据采集系统,AD Instrument Pty Ltd公司;DMT 620 M微血管张力测定系统,丹麦DMT有限公司;146型纯水仪,Thermo公司;SZX7型显微镜,Olympus公司。
1.2 药品 甲磺酸左旋多沙唑嗪原粉、甲磺酸右旋多沙唑嗪原粉、甲磺酸消旋多沙唑嗪原粉(纯度均大于>0.99),均由华北制药集团新药研究开发有限责任公司提供。盐酸苯肾上腺素(phenylephrine,
Phe)、盐酸普萘洛尔、盐酸育亨宾、NaCl、KCl、Mg-SO4、NaH2PO4、CaCl2、NaHCO3以及 glucose均购自美国 Sigma-Aldrich(St Louis,MO,USA)公司。
1.3 动物 Wistar大鼠,清洁级,♂,体质量250~350 g,由河北省实验动物中心提供。饲养于室温(23±1)℃,相对湿度0.5±0.05,明暗各12 h的清洁级动物实验室内,自由进食和饮水。适应环境性饲养7 d,实验前12 h禁食。
2 方法
2.1 药品配制 精确称取一定量的甲磺酸(-)DOX、(+)DOX、(±)DOX药粉,加适量超纯水;超声20 min,配制成母液;置阴凉、避光处备用。实验前,取一定量母液,用超纯水倍比稀释成所需浓度的溶液。
2.2 营养液配制 改良K-H液(Krebs-Henseleit solution)成份为(mmol·L-1):NaCl118.3、KCl4.6、MgSO41.2、NaH2PO41.0、CaCl22.5、NaHCO325.0、glucose 11.1[15]。除 NaHCO3、CaCl2和 glucose于实验前临时加入外,其他成份均配成高浓度母液。实验当日,取适量的各母液,加入超纯水,稀释至所需浓度。配制好的营养液以0.95 O2和0.05 CO2的混合气体充分预饱和,并用盐酸调pH至7.4备用。营养液中含有普萘洛尔(1μmol·L-1)及育亨宾(0.3μmol·L-1)分别阻断 β受体和 α2受体[16]。
2.3 离体肠系膜动脉阻力血管制备 Wistar大鼠,以质量浓度250 g·L-1乌拉坦(1.5 g·kg-1)皮下注射,待动物麻醉后断头放血处死;迅速打开腹腔,从空肠起始端至回肠末端,仔细分离并剪取含肠系膜动脉血管床的全部肠管,置于盛有改良K-H液(4℃冰浴)的硅胶平皿中。在显微镜下找到肠系膜动脉的第二级和第三级分支,小心剪除血管周围的结缔组织,借助测微尺测定两种微动脉在静息状态下的内径。在显微镜下将二级或三级动脉分支剪成2.1 mm或1.8 mm左右的血管段。将一根直径40 μm或25μm、长2 cm的金属丝穿过血管段内腔,固定标本于张力换能器一侧的血管钳上;另取一根直径相同、长1.6 cm金属丝穿过血管段内腔,固定于对侧的血管钳上。轻轻旋转螺旋微调,确认两根金属丝平行放置于微血管内,切勿抻拉损伤微血管。静置5 min后,系统调零。
2.4 实验处理
2.4.1 肠系膜微动脉最适前负荷的确定 待血管张力稳定在零值后,使用LabChart软件的DMT标准化程序,对标本进行标准化处理,得出最适初始张力,并将标本调至该张力。平衡45 mim后,建立5轮(二级血管)或4轮(三级血管)Phe(0.03~300 μmol·L-1)累积给药诱发的收缩反应量效曲线。每轮量效曲线完成后,用改良K-H液反复冲洗标本,直至血管张力达到基线水平。每轮量效曲线间隔45 min。对于二级阻力血管,在建立第2、3、4和5轮量效曲线前30 min,调整微血管张力至5、10、15和20 mN。对于三级阻力血管,在建立第2、3和4轮量效曲线前30 min,调整微血管张力至3、4、5和6 mN。
2.4.2 (±)DOX及其对映体对Phe诱发肠系膜微动脉收缩反应的影响 取新鲜肠系膜动脉二级或三级血管标本,给予标准化前负荷。每只大鼠取8个标本,分为4组:溶媒对照组、(-)DOX组、(+)DOX组和(±)DOX组,每组2个标本。各微动脉均建立5轮 Phe累积效曲线(0.03~300μmol·L-1)。每轮量效曲线间隔45min。以第2次Phe量效曲线作为对照,在建立第3、4和5次Phe量效曲线前20 min,依次分别于浴槽中加入0.001、0.01和0.1μmol·L-1浓度的(-)DOX、(+)DOX或(±)DOX,对照组给予溶媒;每个标本只给一种阻断剂。
2.5 统计学处理 药物诱发的血管收缩反应以实测值(mN)的表示。采用加权回归法计算Phe诱发收缩反应量效曲线的-Log EC50值和实测Emax值。不同前负荷下Phe诱发收缩反应量效曲线的统计学分析采用双因素方差分析(two-way ANOVA),当F值有显著性时,则进一步采用Bonferroni′s test检验,比较两对应浓度间的药物效应。采用Gaddum/Schild EC50shift analysis程序计算多沙唑嗪及其对映体的拮抗参数pKB值,其显著性采用组间Student’s t test进行统计学分析。统计分析及图形处理使用GraphPad Prism 5.0软件(San Diego California USA)。
3 结果
3.1 肠系膜动脉二级和三级阻力血管最适前负荷的测定 在静息状态下,二级分支的血管内径为(162.5±5.3)μm(n=11,mean±SEM),三级分支的内径为(103.1±2.3)μm(n=23),二者血管内径的差异有显著性(P<0.01)。LabChart软件的标准化程序测算的肠系膜动脉二级分支血管的标准前负荷为(2.93±0.15)mN(n=11,mean±SEM),三级分支血管的标准前负荷为(2.64±0.10)mN(n=23),二者的标准化前负荷无差异(P>0.05)。肠系膜动脉二级分支血管在5 mN前负荷时,Phe(0.03~300μmol·L-1)诱发收缩反应的量效曲线与标准前负荷条件相比,差异无统计学意义(P>0.05,Fig 1A);但是,与标准前负荷相比,当标本的前负荷增加至10、15和20 mN时,Phe诱发的收缩反应的Emax值分别下降了12%、29%和43%(P<0.01,Fig 1A)。在肠系膜动脉三级分支血管,与标准前负荷相比,当标本的前负荷增加至3、4、5或6mN时,Phe(0.03~300μmol·L-1)诱发收缩反应的量效曲线未见明显改变(P>0.05,Fig 1B)。
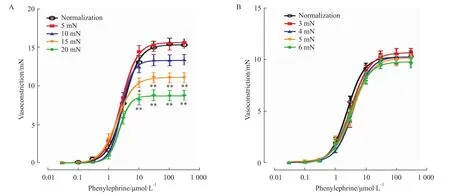
Fig 1 Vasoconstrictive responses to phenylephrine under different preloads in the second branch(A,n=11)and the third branch(B,n=23)of the rat mesenteric artery.Points represent themean values and vertical bars show SEM.*P<0.05,**P<0.01 vs normalization by Bonferroni’s test.
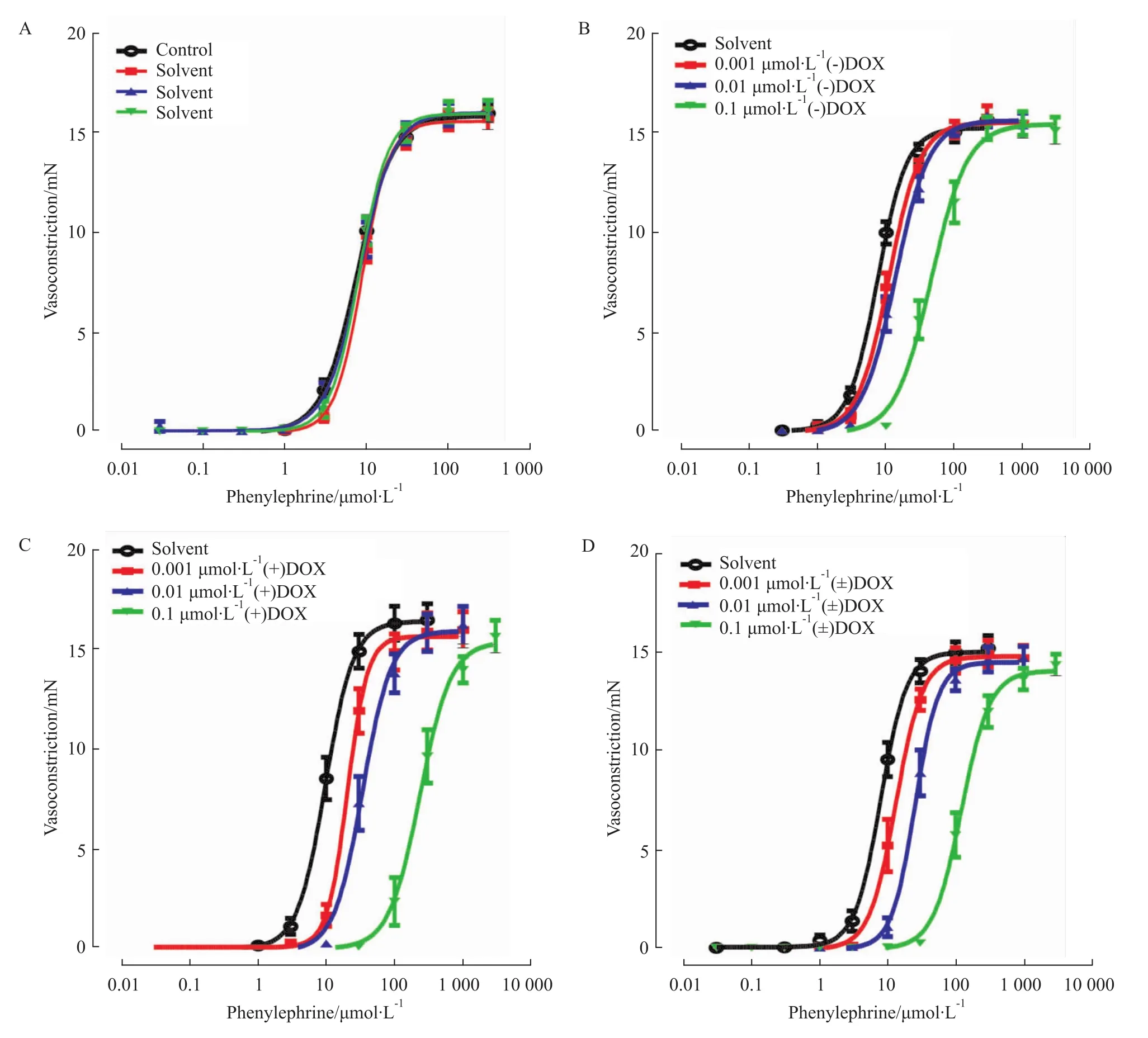
Fig 2 Effects of solvent(A,n=15),(-)doxazosin(B,n=14);(+)doxazosin(C,n=14)or(±)doxazosinon(D,n=12)on phenylephrineinduced vasoconstrictive responses in the second branch of the ratmesenteric artery.Points represent themean values and vertical bars show SEM.
3.2 (±)DOX及其对映体对Phe诱发肠系膜微动脉收缩反应的影响 在大鼠肠系膜动脉二级分支血管标本,建立5轮Phe诱发的收缩反应量效曲线。与第2轮(对照组)收缩反应量效曲线相比,溶媒对后续3轮Phe诱发的收缩反应量效曲线均无明显影响(P>0.05,Fig 2A)。后4轮收缩反应量效曲线的Emax值为:(15.88±0.25)mN、(15.61±0.23)mN、(16.06±0.33)mN和(16.00±0.25)mN(n=15,)。在大鼠肠系膜动脉三级分支血管标本,溶媒对Phe诱发收缩反应量效曲线的影响,与二级分支血管的结果相同(P>0.05,Fig 3A)。后4轮收缩反应量效曲线的 Emax值为:(10.74±0.23)mN、(11.09±0.24)mN、(11.13±0.27)mN和(11.26±0.24)mN(n=13
0.001~0.1μmol·L-1浓度的(-)DOX(Fig 2B)、(+)DOX(Fig 2C)和 (±)DOX(Fig 2D),分别使Phe诱发的大鼠肠系膜动脉二级分支血管收缩反应量效曲线右移。Schild plot分析结果表明,(-)DOX、(+)DOX和(±)DOX拮抗 Phe诱发收缩反应的斜率分别是:0.75±0.07、0.78±0.04和0.75±0.04,各斜率均明显小于1(P<0.01,n=12~14);表明(-)DOX、(+)DOX和 (±)DOX非竞争性拮抗Phe诱发的血管收缩反应。三者的pKB值由小到大的排列顺序是:(-)DOX(7.85±0.09)、(±)DOX(8.53±0.09)、(+)DOX(8.67±0.10);其中(±)DOX与(-)DOX相比、(+)DOX与(-)DOX相比,差异均具有统计学意义(P<0.01,n=12~14)。
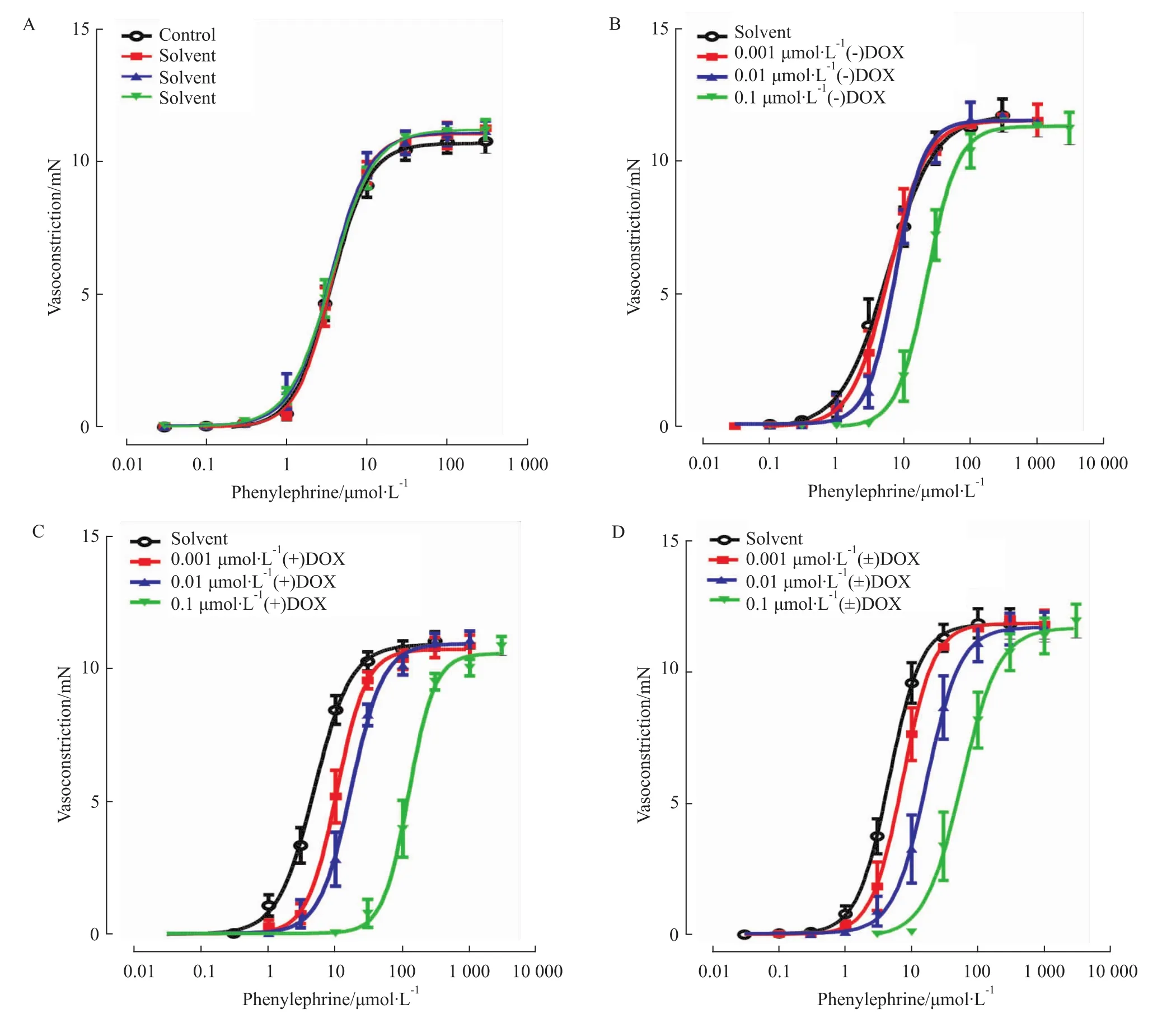
Fig 3 Effects of solvent(A,n=13),(-)doxazosin(B,n=11)(+)doxazosin(C,n=11)or(±)doxazosin(D,n=11)on phenylephrine-induced vasoconstrictive responses in the third branch of the ratmesenteric artery.Points represent themean values and vertical bars show SEM.
同浓度(-)DOX(Fig 3B)、(+)DOX(Fig 3C)和 (±)DOX(Fig 3D),分别使Phe诱发的大鼠肠系膜动脉三级分支血管收缩反应量效曲线右移。Schild plot分析结果表明,(-)DOX、(+)DOX和(±)DOX拮抗Phe诱发收缩反应的斜率分别是:1.01±0.23、0.87±0.12和0.64±0.06;其中(-)DOX和(+)DOX的斜率与1相比,差异无统计学意义(P>0.05,n=11);表明(-)DOX和 (+)DOX在三级分支血管竞争性拮抗Phe诱发的血管收缩反应。三者的pKB值由小到大,分别为(-)DOX(7.48±0.14)、(+)DOX(8.48±0.10)、(±)DOX(8.68±0.17)。4 讨论
本课题组最近报道,大鼠连续灌胃给予(-)DOX、(+)DOX和(±)DOX 3个月后,(±)DOX降低清醒大鼠血压的作用明显强于(+)DOX,而(-)DOX的降压作用十分轻微;研究结果提示,(-)DOX与(+)DOX在降低清醒大鼠动脉血压方面,可能存在协同效应[10]。在大鼠离体尾动脉标本,DOX及其对映体拮抗NA诱发血管收缩的pKB值分别是(-)DOX(8.032±0.039)、(+)DOX(8.995±0.032)和(±)DOX(8.694±0.032),其中不仅(-)DOX阻断尾动脉 α1受体的作用明显小于(+)DOX,而且(±)DOX阻断尾动脉α1受体的作用亦明显小于(+)DOX[10]。在大鼠离体胸主动脉,DOX及其对映体竞争性拮抗NA诱发血管收缩,它们的pA2值分别是(-)DOX(8.625±0.053)、(+)DOX(9.503±0.051)和(±)DOX(9.236±0.054),同样,不仅(-)DOX阻断胸动脉α1受体的作用明显小于(+)DOX,而且(±)DOX阻断胸主动脉α1受体的作用亦明显小于(+)DOX[7]。我们也曾在大鼠肠系膜动脉研究了(-)DOX、(+)DOX及(±)DOX拮抗NA诱发血管收缩的作用,其pKB值由大至小的排列顺序是(-)DOX(7.985±0.273)、(±)DOX(8.911±0.313)、(+)DOX(9.084±0.319)[14]。然而,这些用于离体实验的家兔或大鼠的动脉均属于传输血管,其实验结果与清醒大鼠的血压实验结果[10]不完全吻合。因此,本研究采用DMT 620 M微血管张力测定系统,在大鼠离体肠系膜动脉第二级和第三级阻力血管,分析(-)DOX、(+)DOX及(±)DOX对不同直径阻力血管α1受体的阻断作用;以期解释(±)DOX及其对映体降低清醒大鼠血压的可能机制。
在本实验中,我们预先应用普萘洛尔和育亨宾分别阻断了微血管的 α2受体和 β受体[16],因此Phe仅通过激动α1受体诱发血管收缩反应。使用0.001~0.1μmol·L-1浓度的(-)DOX、(+)DOX和(±)DOX预处理微血管标本后,Phe诱发的收缩反应量效曲线随着DOX浓度的升高而逐渐向右侧偏移。在大鼠离体肠系膜动脉第二级阻力血管,(-)DOX、(+)DOX和(±)DOX非竞争性拮抗Phe诱发收缩反应;三者的pKB值由小到大的排列顺序是:(-)DOX(7.85±0.09)、(±)DOX(8.53±0.09)、(+)DOX(8.67±0.10)。然而,对于大鼠离体肠系膜动脉第三级阻力血管,(-)DOX和(+)DOX竞争性拮抗Phe诱发收缩反应;三者的pKB值小到大的排列顺序是:(-)DOX(7.48±0.14)、(+)DOX(8.48±0.10)、(±)DOX(8.68±0.17)。与大鼠胸主动脉和尾动脉不同,(+)DOX及(±)DOX阻断α1受体介导微动脉血管收缩的作用差异无统计学意义;特别需要指出的是,随着微动脉血管直径变细,(±)DOX阻断α1受体的活性有逐渐增强趋势(pKB值由8.53±0.09升至8.68±0.17),而(+)DOX阻断α1受体的活性有逐渐减弱趋势(pKB值由8.67±0.10降至8.48±0.10)。一般观点认为,外周阻力血管的张力变化决定了动脉血压的水平;α1受体阻断剂通过阻断支配外周阻力血管的交感神经递质NA,对血管平滑肌α1受体的激动作用,而降低动脉血压。理论上讲,肠系膜动脉三级阻力血管对动脉血压的调控更为重要。在肠系膜动脉三级阻力血管上,我们发现(±)DOX阻断α1受体介导血管收缩的pKB值大于(+)DOX。该实验结果与以往在传输血管观察的实验结果相反;在大鼠肠系膜微动脉,(-)DOX阻断α1受体的活性明显低于(+)DOX和(±)DOX。尽管(+)DOX和(±)DOX阻断α1受体的活性差异无显著性,在血管三级分支(±)DOX的作用有增强的趋势。
参考文献:
[1] Fulton B,Wagstaff A J,Sorkin EM.Doxazosin.An update of its clinical pharmacology and therapeutic applications in hypertension and benign prostatic hyperplasia[J].Drugs,1995,49(2):295-320.
[2] McVary K T,Roehrborn CG,Avins A L,et al.Update on AUA guideline on themanagement of benign prostatic hyperplasia[J].JUrol,2011,185(5):1793-803.
[3] 牛长群,任雷鸣.3种新型α1-受体阻断剂的高效毛细管电泳手性分离[J].药学学报,2000,35(6):451-3.
[3] Niu C Q,Ren L M.Chiral separation of three new antagonists of alpha1-adrenoceptors by capillary electrophoresis[J].Acta Pharm Sin,2000,35(6):451-3.
[4] 牛长群,任雷鸣.3种新型α1-受体阻断剂的手性流动相HPLC分离与制备[J].药学学报,2002,37(6):450-3
[4] Niu CQ,Ren LM.Chiral separation and preparation of three new antagonists ofα1-adrenoceptorsby chiralmobile phase HPLC[J].Acta Pharm Sin,2002,37(6):450-3.
[5] 卢海刚,刘丽芳,任雷鸣,等.多沙唑嗪对映体对兔四种血管α受体的作用[J].药学学报,2007,42(2):145-51.
[5] Lu H G,Liu L F,Ren L M,et al.Effects of doxazosin enantiomers onα-adrenoceptors of isolated rabbitblood vessels[J].Acta Pharm Sin,2007,42(2):145-51.
[6] Niu CQ,Zhao D,Jia X M,Ren L M.α1-Adrenoceptor antagonist profile of doxazosin and itsenantiomers in isolated rabbitblood vessels[J].Chin JPharmacol Toxicol,2003,17(5):354-9.
[7] Zhao D,Duan L H,Wang F Y,et al.Chiral recognition of doxazosin enantiomers in 3 targets for therapy as well as adverse drug reactions in animal experiments[J].Can JPhysiol Pharmacol,2012,90(12):1623-33.
[8] 李同荟,高玲娜,孙家安,等.多沙唑嗪对映体诱发大鼠心房肌收缩力变化的作用机制[J].中国药理学通报,2014,30(7):989-94.
[8] Li T H,Gao L N,Sun J A,et al.Mechanisms underlying the contractile responses to doxazosin enantiomers in the rat isolated atrium[J].Chin Pharmacol Bull,2014,30(7):989-94.
[9] Sun JA,Kong D Z,Zhen Y Q,et al.Stereoselective binding of doxazosin enantiomers to plasma proteins from rats,dogs and humans in vitro[J].Acta Pharmacol Sin,2013,34(12):1568-74.
[10]Zhao J,Kong D Z,Li Q,et al.(-)Doxazosin is a necessary component for the hypotensive effectof(±)doxazosin during longterm administration in conscious rats[J].Acta Pharmacol Sin,2014,35(1):48-57.
[11]Ma S P,Ren L M,Zhao D,et al.Chiral selective effects of doxazosin enantiomers on blood pressure and urinary bladder pressure in anesthetized rats[J].Acta Pharmacol Sin,2006,27(11):1423-30.
[12]田河林,任雷鸣,何东伟,赵 丁.多沙唑嗪对映体对大鼠血压和排尿功能的影响[J].中国药理学通报,2007,23(2):240-6.
[12]Tian H L,Ren LM,He DW,Zhao D.Effects of doxazosin enantiomers on blood pressure and urinary bladder function in anesthetized rats[J].Chin Pharmacol Bull,2007,23(2):240-6.
[13]段丽华,田河林,张 瑾,等.多沙唑嗪对映体对麻醉猫心血管功能的选择性作用[J].中国药理学通报,2011,27(12):1696-9.
[13]Duan L H,Tian H L,Zhang J,etal.Effects of doxazosin enantiomers on blood pressure in anesthetized cat[J].Chin Pharmacol Bull,2011,27(12):1696-9.
[14]Wang M,Ren X J,Zhao Q H,et al.Relaxant and contractile responses of detrusormuscle strips obtained from bladder outlet-obstructed rats treated with doxazosin enantiomers[J].Can JPhysiol Pharmacol,2011,89(12):883-90.
[15]Li L,Wu T,WeiC,et al.Exhaustive swimming differentially inhibits P2X1 receptor-andα1-adrenoceptor-mediated vasoconstriction in isolated rat arteries[J].Acta Pharmacol Sin,2012,33(2):221-9.
[16]Muramatsu I,Ohmura T,Kigoshi S,et al.Pharmacological subclassification ofα-adrenoceptors in vascular smoothmuscle[J].Br JPharmacol,1990,99(1):197-201.

