反相高效液相色谱法测定泡萝卜中的有机酸
王 冉,李小林,李 敏,魏 静,陈安均,敖晓琳,蒲 彪,*
(1.四川农业大学食品学院,四川雅安625014;2.四川省农业科学院土壤肥料研究所,四川成都610066)
泡菜是我国传统特色发酵食品的典型代表之一[1]。传统四川泡萝卜借助于老盐水中的微生物以及天然附着在蔬菜表面上的微生物进行发酵作用,在发酵过程中,由于乳酸菌、醋酸菌等微生物的活动,会产生大量的乳酸、乙酸等有机酸,这些有机酸赋予了四川泡萝卜适宜的酸味,同时这些有机酸可以与醇类等其它物质相互作用产生酯类等香味物质,增加泡萝卜的风味[2]。近年来,高效液相色谱法已被广泛应用于有机酸的分析中[3-5],但在泡萝卜中的研究鲜有报道。本文试图建立反相高效液相色谱法分析泡萝卜中草酸、酒石酸、苹果酸、抗坏血酸、乳酸、乙酸、柠檬酸和琥珀酸等8种有机酸的含量,以期对研究萝卜泡制过程中有机酸等风味物质的形成与微生物之间的关系提供依据。
1 材料与方法
1.1 材料与仪器
红皮萝卜 购于雅安菜市场;老泡菜水 收集于学校周边饭店。
琥珀酸、草酸、柠檬酸、苹果酸、酒石酸 购于美国化学试剂公司;乙酸、乳酸、抗坏血酸 购于美国sigma公司;磷酸、磷酸二氢钾均为分析纯 成都市科龙化工试剂厂;甲醇为色谱纯 广东光华科技股份有限公司。
岛津LC-20101C高效液相色谱仪 LC solution工作站,UV-VIS检测器,日本岛津公司;YMC-Pack ODS-AQ C18色谱柱(5μm,120A,4.6mm ×150mm)YMC公司;精密PHS-4C+型酸度计 成都世纪方舟科技有限公司;超纯水制备仪 四川优普超纯科技有限公司;KQ5200DB型数控超声波清洗机 昆山市超声仪器有限公司;CP225D型电子天平 德国赛多利斯股份公司。
1.2 方法
1.2.1 泡萝卜的制备 传统发酵泡萝卜:以红皮萝卜为原料,将新鲜的红皮萝卜洗净、晾干,以料液比1∶1用老盐水泡制,并补盐至泡菜水盐浓度为7%,于常温条件下泡制。
1.2.2 有机酸标准溶液的配制 有机酸的单标溶液:分别称取乳酸4.35mg、苹果酸3.68mg、柠檬酸4.35mg、酒 石 酸 3.40mg、抗 坏 血 酸 2.62mg、草 酸1.10mg、琥珀酸 8.01mg、乙酸 2.35μL,分别用超纯水溶解并定容至10mL,于4℃冰箱保存,使用前经0.45μm 滤膜过滤[6]。
有机酸混合标准溶液:称取适量各有机酸标准品,配制成5mg/mL乳酸、1mg/mL的酒石酸和抗坏血酸,其余酸质量浓度为2mg/mL的混合标准溶液,作为母液,于4℃冰箱保存。在使用时,将其依次稀释为母液浓度的 1、0.2、0.04、0.008、0.0016、0.00032倍,经 0.45μm 滤膜过滤后使用[6]。
1.2.3 色谱条件 YMC-Pack ODS-AQ C18色谱柱(5μm,120A,4.6mm ×150mm);流动相为 4% 甲醇-96%的0.05mol/L KH2PO4溶液(用 H3PO4调节pH2.9);流速0.6mL/min;柱温27℃;进样量10μL;检测波长210nm。
1.2.4 样品预处理 准确称取已切碎混匀的样品2.5000g,用超纯水定容至50mL,过滤后取滤液离心(10000r/min,10min),上清液经 0.45μm 滤膜过滤后直接进样。
1.2.5 数据处理 在LC solution工作站中,根据色谱图中各峰的保留时间和内标法进行定性分析;根据峰面积和标准曲线,对样品中有机酸进行定量分析,利用SPSS19.0软件进行统计分析。
2 结果与分析
2.1 单因素实验初步确定有机酸分离色谱分离条件
2.1.1 检测波长的确定 结果表明抗坏血酸和乙酸的最大吸收分别为242nm和233nm,其余6种有机酸在210nm处的吸收与204nm处的最大吸收相差不大,综合考虑抗坏血酸和乙酸的最大吸收波长,以下实验均采用210nm波长进行检测。
2.1.2 色谱柱的选择 对于有机酸的分离,目前国内使用键合十八烷基填料(C18)色谱柱的较多[3-8],实验中考虑使用 Kromasil 100-5C18色谱柱和 YMCPack ODS-AQ C18色谱柱。由于泡萝卜中的有机酸为水溶性物质,因此在分离有机酸时使用的流动相应为高比例的水相溶剂。而Kromasil 100-5C18色谱柱以硅胶为基质,硅胶在水中的溶解度较流动相中高,若长时间用纯水相或高比例水相冲洗柱子,很容易造成固定相流失,使柱效下降。而YMC-Pack ODS-AQ C18色谱柱是亲水性色谱柱,在高含水量甚至纯水中对有机酸等强极性物质具有较强的保留能力。因此,选择YMC-Pack ODS-AQ C18色谱柱进行本实验。
2.1.3 流动相种类的选择 甲醇-水系统和磷酸盐缓冲液系统是C18柱中应用最广泛的流动相,其中磷酸盐缓冲液系统较适宜于有机酸的测定[9]。在流速1mL/min,柱温25℃,进样量 10μL,检测波长 210nm的初始色谱条件下,分别用0.05mol/L的 KH2PO4、NaH2PO4、NaHPO4溶液(H3PO4调节 pH2.5)作为流动相对配制的有机酸混合标准溶液进行分离,结果见图1,三种磷酸盐作为流动相时有机酸的分离效果差别不大,均可以作为流动相。本实验中选择KH2PO4作为流动相。
2.1.4 流动相浓度的选择 磷酸盐缓冲液浓度的高低影响酸存在形式的稳定性,从而影响分离效果[3]。将流动相配制成不同浓度的溶液,其余按照2.1.3的较优色谱条件,研究流动相浓度对各酸保留时间的影响(见图2)。由图2可知,流动相浓度对琥珀酸与苹果酸2以及苹果酸2与柠檬酸的分离效果影响较大,当流动相浓度为0.05mol/L时,它们能较好分离,随着流动相浓度的继续增加,其分离效果稍有增强。但由于高浓度的盐会对泵和柱子的寿命产生影响,因此选择0.05mol/L的KH2PO4溶液进行后续单因素实验。

图2 流动相浓度对保留时间的影响Fig.2 Effect of mobile phase’s concentrations on retention time
2.1.5 流动相pH的选择 有机酸为弱酸,在水溶液中会解离,可通过调节流动相的pH以达到抑制解离的作用。将流动相调成不同pH,其余按照2.1.4的较优色谱条件,得到流动相pH对有机酸分离的影响,由图3可知流动相pH对有机酸的分离影响很大,其中对柠檬酸、苹果酸2的保留时间影响最大。另外,当 pH 为2.1、2.3、2.5、2.7、3.1 时,乳酸和抗坏血酸完全不能分开,仅pH为2.9时,乳酸和抗坏血酸可以分开,各酸均能较好地分离,因此选择pH2.9进行后续单因素实验。
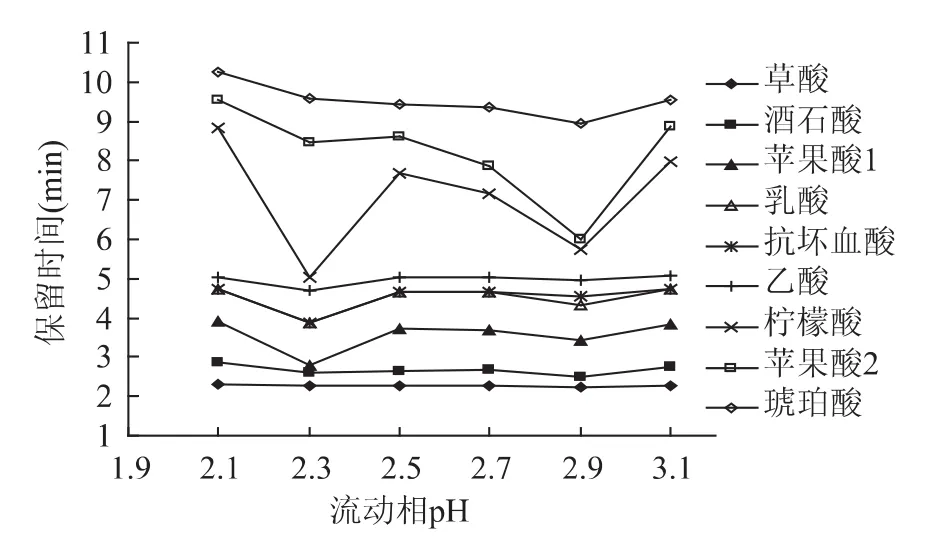
图3 流动相pH对保留时间的影响Fig.3 Effects of different pH values on retention time
2.1.6 甲醇添加量的选择 在流动相中加入甲醇可以有效的改善峰形,且对各有机酸的出峰时间也有较大影响[4]。在流动相中分别添加不同体积的甲醇,在2.1.5的较优色谱条件下,考察甲醇添加量对有机酸分离效果的影响。由图4可知,甲醇添加量为0%时,各峰的拖尾严重,峰形不好,分析时间较长。加入甲醇后,乳酸和抗坏血酸的出峰顺序发生变化,且随着甲醇含量的增加,有机酸的疏水基与固定相的相互作用减弱,保留时间下降,柠檬酸和乙酸的分离度降低;抗坏血酸和苹果酸1的分离度也逐渐较小,但乳酸和抗坏血酸的分离度增加。当甲醇添加量为1%时,乳酸和抗坏血酸分离度很小;当甲醇添加量为3%时,乳酸和抗坏血酸的分离度较小,但柠檬酸和乙酸的分离度较大;当甲醇添加量为5%时,各酸均能较好分离;当甲醇添加量为7%和9%时,柠檬酸和乙酸已经完全不能分开。因此,选择5%进行后续单因素实验,选择3%~5%进行正交实验。

图4 甲醇添加量对各有机酸保留时间的影响Fig.4 Effects of methanol content on retention time
2.1.7 流速的选择 在2.1.6的较优色谱条件下,调整流动相的流速,可知(图5)流速太高,各酸的保留时间下降,分离度降低,且柱压随着流速的升高而升高,当柱压太高时,对柱子的保护和长期使用不利。但当流速太低时,各酸的保留时间明显增加,分析时间大大延长,当流速降低到0.2mL/min时,25min尚未完成对8种有机酸的检测。综合分析,选择0.6mL/min进行后续单因素实验,选择0.6~0.8mL/min进行正交实验。
2.1.8 柱温的选择 在2.1.7较优色谱条件下,改变柱温,考察柱温对有机酸分离效果的影响,如图6所示,柱温对抗坏血酸、柠檬酸、苹果酸2和琥珀酸的保留时间影响较大,且随柱温的升高均逐渐减小。随着柱温的逐渐升高,乙酸和柠檬酸的分离度逐渐降低,当柱温达到30℃时,乙酸和柠檬酸在同一时间出峰,完全不能分离,继续升高柱温至35℃时,乙酸和柠檬酸改变出峰顺序;而乳酸和抗坏血酸的分离度则随着柱温的升高而增大。结果表明,当温度达到25℃时,各酸在10min以内可以达到有效的分离。

图5 流速对各有机酸保留时间的影响Fig.5 Effects of flow rate on retention time

图6 柱温对各有机酸保留时间的影响Fig.6 Effects of column temperature on retention time
2.2 正交实验优化有机酸分离色谱分离条件
在单因素实验结果的基础上,采用正交实验表L9(34),以流动相pH、甲醇添加量、流速和柱温四个因素进行正交实验,采用串行色谱响应函数HCRF[7]作为优化指标,确定各因素主次,并确定最优组合。正交实验因素水平表和正交实验表见表1和表2。
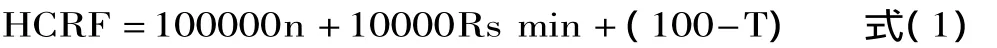
式中:n是色谱峰的数目,Rs min是最难分离物质对的分离度,T是最后流出色谱峰的保留时间。

表1 正交实验因素水平表Table 1 The factors and levels table of orthogonal test
对正交实验的结果进行极差分析,结果见表2。由极差分析可知,R越大,表明该因素对指标的影响越大,因此各因素对有机酸分离效果的的主次顺序为:流动相pH>柱温>甲醇添加量>流速。最终选择的最优分离条件为:4%甲醇-96%的0.05mol/L KH2PO4(用 H3PO4调节 pH2.9);流速0.6mL/min;柱温27℃;进样量10μL;检测波长210 nm。
图7和图8分别是该色谱条件下测定有机酸混合标液与泡萝卜中有机酸的色谱图,从色谱图可以看出,泡萝卜中的8种有机酸均能得到有效分离,可根据各酸的保留时间对样品中的有机酸进行初步定性分析。

表2 正交实验表和极差分析Table 2 The orthogonal test table and range analysis

图7 有机酸混合标准样品色谱分离图Fig.7 Chromatogram of standard organic acids
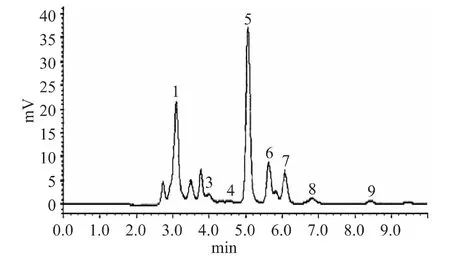
图8 泡萝卜样品中有机酸的色谱分离图Fig.8 Chromatogram of organic acids in pickled radish
2.3 标准曲线的制作
在上述得到的最优条件下,将有机酸混合标样母液稀释成6个浓度梯度的有机酸溶液,分别以10μL进样,以峰面积 y对质量浓度(x,mg/mL)作图,制作标准曲线(表3),对结果进行回归分析,由表3可知,各有机酸的相关系数在0.99~1.0范围内,线性关系良好。再以3倍信噪比(S/N)时各有机酸的浓度作为最小检测限(表3)。
2.4 样品预处理方法的优化
分别用超纯水和流动相提取样品中的有机酸,根据提取有机酸总量的多少选择较优的提取方式。结果表明,流动相和超纯水两种不同提取方式所提取得到的8种有机酸的总量分别为12.97mg/100g和13.43mg/100g。虽然两种提取方式的提取结果相差不大,但由于超纯水提取方式更方便,且经济成本较低,因此本实验选择用超纯水提取作为样品的前处理方式。
2.5 精密度和回收率的测定
取同一样品5份,分别采用超纯水提取有机酸,经0.45μm滤膜过滤后上样,用于考察方法的精密度,如表3所示,8种有机酸的RSD在0.34%~2.18%之间。另取同一样品4份,1份作为本底,另外3份样品分别按测试样品有机酸总量的 80%、100%、120%加入有机酸混合标样,得到各有机酸的回收率,如表3所示,均在90.59%~103.85%之间。表明该方法准确灵敏、重现性好、回收率高。
2.6 泡萝卜样品中有机酸的分析
新鲜萝卜和泡菜样品按上述得到的最佳样品预处理方法处理后,按最佳色谱条件进行测定,结果见表4,在新鲜萝卜和泡萝卜中均检测出除酒石酸之外的7种有机酸。草酸是一种广泛存在于植物中的有机酸,草酸含量过多,产品口感发涩,影响品质[10]。苹果酸和抗坏血酸均有爽快的酸味,但苹果酸略有苦味[11]。乳酸的酸味柔和,有后酸味,可提供柔和的风味[12]。醋酸有较强的刺激味,适量的醋酸,酸味柔和,有强化食欲的功能。柠檬酸爽快可口,能赋予泡萝卜较好的酸味。琥珀酸的呈味特点是酸和鲜,且琥珀酸的钠盐阈值较低,可以赋予产品鲜美的味道[13]。由表4知,使产品具有涩味和苦味的草酸与苹果酸的含量在萝卜泡制后减少,而赋予泡萝卜爽快酸味和鲜味的乳酸、乙酸、柠檬酸、琥珀酸的含量则升高,其中乳酸是泡萝卜中含量最高的有机酸。

表3 回归分析、精密度和回收率、检测限Table 3 Regression analysis,precision and recovery,detection limit

表4 萝卜泡制前后有机酸的变化(mg/100g)Table 4 Contents of organic acid in pickled radish(mg/100g)
3 结论
3.1 在实验中建立了反相高效液相色谱法同时分析泡萝卜中8种有机酸的方法:YMC-Pack ODS-AQ C18 色谱柱(5μm,120A,4.6mm ×150mm),4%甲醇-96%的0.05mol/L KH2PO4(H3PO4调节pH2.9)作为流动相,流速0.6mL/min,柱温27℃,进样量10μL,检测波长210nm。在此条件下,8种有机酸能够获得较好的分离,回收率为 90.59%~103.85%,RSD为0.34%~2.18%。该方法具有灵敏度高、测试组分多、速度快等优点,适用于泡萝卜中有机酸的测定。
3.2 实验比较了超纯水和流动相提取泡萝卜中有机酸的效果,表明超纯水提取效果好于流动相提取。与孙基梁[14]在采用蒸馏水提取、流动相提取以及甲醇提取法提取银杏果和枸杞中有机酸时的结果一致。另外,贾洪锋等[3]用加热提取和超声波提取方式提取发酵辣椒中有机酸,结果表明加热提取的效果好于超声波提取,然而本实验中检测的酸中含有抗坏血酸,加热可能会造成抗坏血酸的分解,因此实验中不予加热。
3.3 实验对泡萝卜中的8种有机酸进行了定量分析。其中,乳酸是含量最多的有机酸,其他酸虽然含量相对较少,但是在泡萝卜的风味形成中同样具有重要的作用。而酒石酸在新鲜萝卜和泡萝卜中均未检测到,可能是由于酒石酸含量太少或是草酸影响了酒石酸的检测,还需进一步研究。
[1]陈功.试论中国泡菜历史与发展[J].食品与发酵科技,2010(3):1-5.
[2]夏延斌.食品风味化学[M].北京:化学工业出版社,2008:208-209.
[3]贾洪锋,贺稚非,李洪军,等.高效液相色谱法测定发酵辣椒中的有机酸[J].食品科学,2008,29(3):374-379.
[4]袁玲,黄建安,龚志华,等.茯砖茶有机酸反相高效液相色谱分析方法建立及其应用[J].中国农学通报,2011,27(30):246-252.
[5]莫海涛,杜玉兰,黎庆涛,等.反相高效液相色谱法测定发酵饮料中有机酸和维生素C的含量[J].食品工业科技,2007,28(2):230-232.
[6]高海燕,廖小军,王扇广,等.反相高效液相色谱法测定果汁中11种有机酸条件的优化[J].分析化学研究简报,2004,32(12):1645-1648.
[7]黄红心,张玉奎,林从敬,等.智能搜索用于实际样品的液相色谱分离条件的优化[J].色谱,1992,10(3):125-128.
[8]吕利华,梁丽绒,赵良启.山西老陈醋中有机酸的HPLC测定分析[J].食品科学,2007,28(11):456-459.
[9]高海燕,王善广,胡小松.利用反相高效液相色谱法测定梨汁中有机酸的种类和含量[J].食品与发酵工业,2004,30(8):96-100.
[10]任宇环,李林祥.草酸生产工艺与市场分析[J].上海化工,2010,12(3):36-38.
[11]徐娟娣,刘东红.腌制蔬菜风味物质组成及其形成机理研究进展[J].食品工业科技,2012(11):414-417.
[12]张静,张锦丽,杨娟侠.乳酸菌群对乳酸发酵作用的探讨[J].天津农业科学,2002,8(2):18-20.
[13]周晓媛,夏延斌.蔬菜腌制品的风味研究进展[J].食品与发酵工业,2004(4):104-108.
[14]孙基梁.高效液相色谱法测定番茄红素和有机酸[D].烟台:烟台大学,2010:31-32.

