大黄素对肝纤维化大鼠肺损伤的保护作用*
张丽丽,张慧英△,王黎敏,李旭炯,贾建桃,吕敏丽,范毅敏,张翠英,刘明社,赵中夫,韩德五,CHENG Ji
(长治医学院1病理生理学教研室,2机能实验室,3生理学教研室,5肝病研究所,山西长治 046000;山西医科大学4第二医院ICU,6肝病研究所,山西太原 030001;7南加州大学Keck医学院肝病研究中心,美国加利福尼亚州洛杉矶 90089)
大黄素对肝纤维化大鼠肺损伤的保护作用*
张丽丽1,张慧英1△,王黎敏2,李旭炯3,贾建桃1,吕敏丽4,范毅敏2,张翠英3,刘明社5,赵中夫5,韩德五6,CHENG Ji7
(长治医学院1病理生理学教研室,2机能实验室,3生理学教研室,5肝病研究所,山西长治 046000;山西医科大学4第二医院ICU,6肝病研究所,山西太原 030001;7南加州大学Keck医学院肝病研究中心,美国加利福尼亚州洛杉矶 90089)
目的:探讨不同剂量大黄素对肝纤维化大鼠肺损伤的保护作用。方法:采用复合致病因素法(CCl4、乙醇、高脂、高胆固醇和低胆碱)建立肝纤维化大鼠模型并以不同剂量(20 mg/kg和40 mg/kg)大黄素进行治疗。4周后,测定肝指数,检测血清内毒素、同型半胱氨酸、反映肝功能的指标白蛋白、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、总胆红素、总胆固醇、甘油三酯和肝纤维化指标透明质酸、层黏连蛋白、Ⅳ型胶原蛋白、Ⅲ型前胶原蛋白的含量,观察肝组织病理学改变;测定肺指数,光镜下行肺组织病理学观察,检测肺组织匀浆肿瘤坏死因子α(TNF-α)、丙二醛(MDA)、一氧化氮(NO)和过氧亚硝基阴离子(ONOO-)含量。结果:大鼠肝纤维化模型复制成功,模型组大鼠肺指数明显增加,肺脏发生水肿、炎症反应,肺匀浆TNF-α、MDA、NO和ONOO-含量明显增加;大黄素治疗组肺指数较模型组下降,肺组织病理性损伤明显减轻,肺组织TNF-α、MDA、NO和ONOO-含量明显降低。结论:大黄素对肝纤维化大鼠的肺损伤具有一定的保护作用。
大黄素;肝纤维化;肝肺综合征;肺损伤
肺脏由于其特殊的解剖位置,在维持机体正常功能中发挥重要作用。在疾病情况下,肺脏也成为极易受损的器官。在各种急、慢性肝病早期即可发生肝肺综合征(hepatopulmonary syndrome,HPS),并且具有发生早、发病隐匿的特点。在各种原因所致的肝硬化基础上,肝肺综合征的发生率高达5%~32%[1]。肝纤维化是各种病因所致慢性肝病的共同病理过程,也是向肝硬化发展的主要中间环节。对肝纤维化时肺组织的损伤及其严重程度鲜有报道。大黄素(emodin,EMD)是大黄等中药的主要有效单体成分,在治疗肝纤维化方面具有较好的临床应用价值,对其抗肝纤维化作用及机制的研究也已取得了显著成果,但临床尚无大黄素防治肝纤维化肺损伤的报道。本实验拟采用复合致病因素法复制大鼠肝纤维化模型,观察肺组织的病理变化,并进一步探讨大黄素对肝纤维化所致肺损伤是否具有保护作用及其可能的机制,以期为临床治疗提供新思路。
材料和方法
1 材料
1.1 主要试剂CCl4分析纯,购自天津市富宇精细化工有限公司;胆固醇购自天津市化学试剂公司; EMD(纯度99%)购自成都康邦生物科技有限公司,使用前用0.5%羧甲基纤维素钠配制成不同浓度的混悬液。丙二醛(malondialdehyde,MDA)测试盒、一氧化氮(nitric oxide,NO)测试盒和考马斯亮蓝蛋白测定试剂盒均购自南京建成生物工程研究所。
1.2 动物分组与模型制备清洁级成年雄性SD大鼠(购自北京军事科学院)20只,体重200~220 g。随机分为正常对照组、小剂量(20 mg/kg)EMD组、大剂量(40 mg/kg)EMD组和肝纤维化组(模型组)。模型组和EMD组以玉米面作为饲料(前2周为80%玉米面,20%猪油,0.5%胆固醇;后2周为单纯玉米面混入0.5%胆固醇),首次按6 mL/kg体重的剂量皮下注射40%CCl4,之后按3 mL/kg体重剂量注射,每隔3 d注射1次,共28 d;EMD组在模型组复制的同时给EMD液每天灌胃1次;正常对照组饲以正常饮食;正常对照组和模型组以生理盐水灌胃[2]。4周后取材,收集血液及肝肺标本待测相关指标。
2 方法
2.1 大鼠肝、肺指数计算肝指数(%)=肝脏重量(g)/体重(g)×100%,肺指数(%)=肺湿重(g)/体重(g)×100%。
2.2 血浆生化指标检测血浆内毒素(endotoxin,ET)、同型半胱氨酸(homocysteine,Hcy)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TB)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、Ⅳ型胶原蛋白(collagen typeⅣ,ColⅣ)、Ⅲ型前胶原蛋白(procollagen typeⅢ,PCⅢ)等反映肝功能和肝纤维化指标的检测由郑州金域检验中心完成。
2.3 肺组织匀浆指标检测采用超声波细胞粉碎机制备10%肺组织匀浆,照试剂盒说明书方法检测组织匀浆中MDA和NO水平,蛋白定量采用考马斯亮蓝法;放射免疫法检测肺组织肿瘤坏死因子α (tumor necrosis factor α,TNF-α)含量(北京英华生物技术研究所检测);ELISA法检测肺组织中过氧亚硝基阴离子(peroxynitrite,ONOO-)含量(上海源叶生物科技有限公司检测)。
2.4 病理学观察取同一部位肝叶及肺叶,常规石蜡包埋切片,行HE及van Gieson(VG)染色,光镜下观察肝肺病理变化及肝脏胶原纤维增生情况。采用BI-2000型医学图像分析系统计算肝组织纤维化指数(胶原纤维面积/图像总面积×100%),每张切片随机10个视野取其平均值进行统计。
2.5 肺泡腔及肺间隔巨噬细胞计数肺组织HE染色,切片随机挑选10个视野,400倍光学显微镜下计数肺泡腔及肺间隔内巨噬细胞数量,取其平均值进行统计。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 10.0统计软件进行单因素方差分析和组间LSD-t检验,以P<0.05为差异有统计学意义。
结果
1 一般情况
正常对照组大鼠活泼好动,皮毛柔顺有光泽,体重逐渐增加;模型组动物活动和摄食明显减少,精神不振,拱背蜷缩,背毛杂乱无光泽,身体较其它组消瘦;EMD组大鼠皮毛、饮食与模型组比较有所改善,大便色黄稀软,小便较黄,体重较模型组减轻。肝指数结果分别为:正常对照组(3.10±0.16)%,模型组(5.02±0.75)%,EMD 20 mg/kg组(3.91± 0.70)%,EMD 40 mg/kg组(3.42±0.57)%;模型组与其它3组比较差异均有统计学意义(P<0.05)。
2 各组大鼠血浆生化指标结果
2.1 血浆生化指标结果模型组大鼠血浆ET、Hcy、ALT、AST、TB、TC和TG含量均明显高于其它3组(P<0.05或P<0.01),提示在复合致病因素作用下大鼠有肠源性内毒素血症发生,肝细胞严重受损,肝内脂质聚集,物质代谢障碍,高同型半胱氨酸血症形成。模型组肝细胞严重受损,因此合成白蛋白(albumin,ALB)的能力较其它3组显著降低(P<0.05)。EMD 40 mg/kg组血清ALT和AST含量明显低于EMD 20 mg/kg组(P<0.05),提示EMD 40 mg/ kg组肝细胞损伤较EMD 20 mg/kg组为轻,见表1。
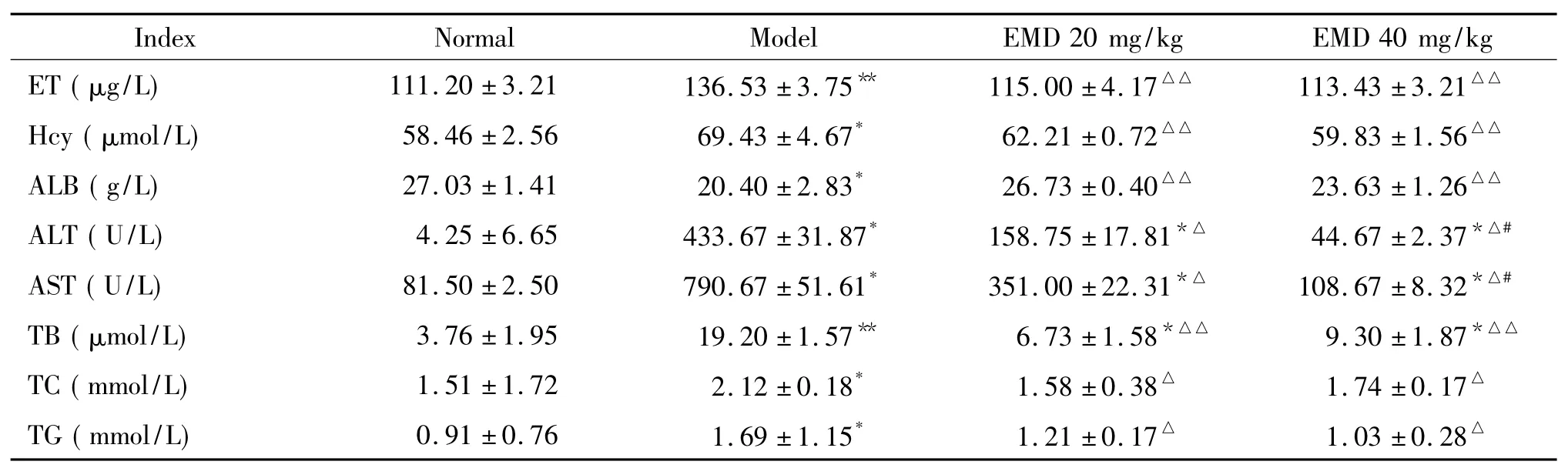
表1 各组大鼠血浆ET、Hcy及肝功6项检测结果Table 1.The changes of ET,Hcy and other biochemical parameters in each group(Mean±SD.n=5)
2.2 大鼠肝纤维化血清学检测结果HA、LN、ColⅣ和PCⅢ是反映肝纤维化水平较理想的血清学指标。与其它3组比较,模型组HA、LN、ColⅣ和PCⅢ含量均显著升高(P<0.05);EMD组各项指标的含量均低于模型组(P<0.05),EMD 40 mg/kg剂量组的4项指标值略低于EMD 20 mg/kg剂量组,但两组间差异无统计学意义,见表2。

表2 各组大鼠血清纤维化指标检测结果Table 2.The changes of HA,LN,ColⅣand PCⅢin each group(Mean±SD.n=5)
3 肝脏病理改变
正常对照组肝小叶结构正常,肝细胞以中央静脉为中心向四周呈放射状排列,仅见少量胶原纤维分布于汇管区和中央静脉周围;模型组肝索排列紊乱,肝细胞脂肪变性、坏死,伴有炎症细胞浸润,Kupffer细胞增生,肝小叶被胶原纤维分割,汇管区可见大量胶原纤维沉积;EMD 20 mg/kg组肝组织结构较模型组有一定改善,肝小叶中央区仅见轻度坏死,汇管区炎症细胞部分浸润,肝小叶部分被增生的纤维组织分割;EMD 40 mg/kg组肝小叶结构基本完整,肝细胞变性坏死明显减轻,纤维结缔组织明显减少,未见纤维间隔,见图1、2。VG染色统计纤维化指数值分别为:正常对照组(3.82±0.67)%,模型组(7.26±1.54)%,EMD 20 mg/kg组(5.11± 1.35)%,40 mg/kg组(4.71±0.94)%;模型组与其它3组比较差异均有统计学意义(P<0.05)。
4 肺脏病理改变
4.1 肺大体肉眼观察及肺指数正常组双肺呈粉红色,表面光滑,柔软有光泽;模型组双肺肿胀,充血明显,表面有出血点和坏死灶;EMD组双肺较对照组稍大,余同对照组。肺指数是反映肺组织有无水肿的客观指标,各组动物肺指数结果显示:正常对照组(0.36±0.05)%,模型组(0.79±0.14)%,EMD 20 mg/kg组(0.49±0.12)%,EMD 40 mg/kg组(0.47±0.27)%。模型组肺指数显著高于其它3组(P<0.05),表明肝纤维化大鼠有明显肺水肿;而EMD组无明显肺水肿,EMD两组间比较无显著差异。
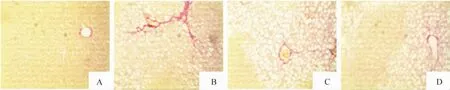
Figure 2.Changes of hepatic fibrosis(VG staining,×100).A:normal group;B:model group;C:EMD 20 mg/kg group;D:EMD 40 mg/kg group.图2 各组大鼠肝组织纤维化改变
4.2 肺脏组织光镜下观察肺组织HE染色结果显示,正常肺组织肺泡结构完整,间隔均匀,肺泡腔内未见明显炎症细胞及渗出物;模型组肺泡腔变窄,肺泡间隔明显增厚,腔内和间隔内有大量巨噬细胞和嗜中性粒细胞聚集;EMD 20 mg/kg组肺泡腔炎症细胞及渗出物明显减少,肺组织变化较模型组减轻; EMD 40 mg/kg组损伤最轻,肺组织结构均趋于正常,见图3。肺泡及间隔中巨噬细胞计数结果为:正常对照组5.60±0.34,模型组20.60±0.47,EMD 20 mg/kg组8.50±0.19,EMD 40 mg/kg组6.70± 1.07。模型组巨噬细胞数量显著多于其它3组(P<0.05),提示肺组织有明显炎症反应存在;EMD组大鼠无明显肺组织炎症反应,EMD 20 mg/kg组和EMD 40 mg/kg组间比较无显著差异。
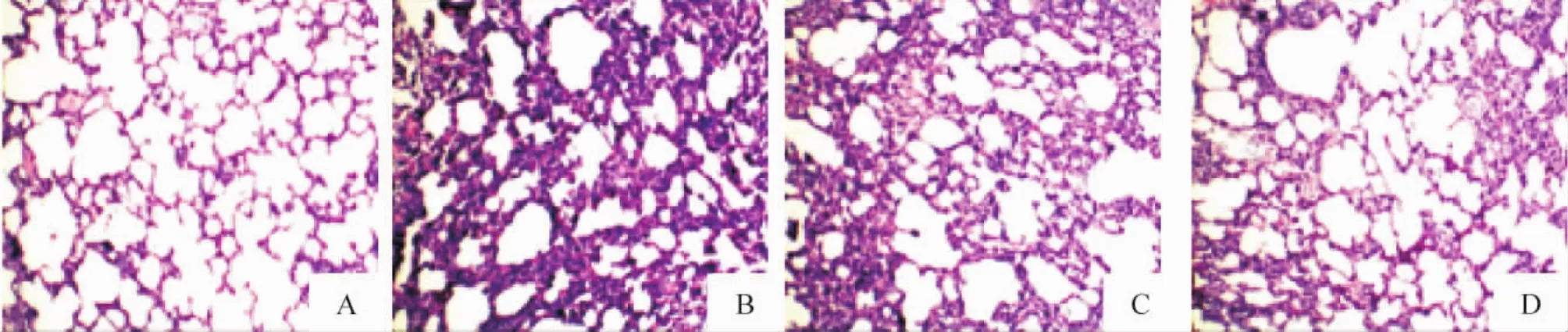
Figure 3.Pathological changes of pulmonary tissues(HE staining,×100).A:normal group;B:model group;C:EMD 20 mg/kg group;D:EMD 40 mg/kg group.图3 各组大鼠肺组织病理学改变
5 肺组织匀浆检测结果
模型组大鼠肺组织匀浆MDA、NO、TNF-α和ONOO-含量明显高于其它3组,差异显著(P<0.05);EMD组MDA、NO、TNF-α和ONOO-含量明显降低,EMD 20 mg/kg组和40 mg/kg组间比较无显著差异,见表3。
6 各指标间相关性分析
血浆内毒素水平与肺组织匀浆TNF-α含量呈显著正相关(P<0.01)。肺组织匀浆TNF-α含量与MDA、NO、ONOO-含量呈显著正相关(P<0.05),见表4。
讨论
本实验采用复合致病因素法复制肝纤维化动物模型,4周末对大鼠血清、肝脏匀浆检测及病理学观察,结果均证实肝纤维化模型复制成功。肺部组织学观察模型组大鼠肺间隔增宽,肺泡腔渗出物明显增多,腔及间质中巨噬细胞数量显著增加,测得肺系数增高,表明其已发生肺水肿;肺组织匀浆TNF-α、MDA、NO和ONOO-的含量明显增高,提示大鼠肝纤维化导致肺组织发生了病理性损伤,且以炎症反应为主。

表3 各组大鼠肺组织匀浆检测结果Table 3.Content of MDA,NO,TNF-α and ONOO-in each group(Mean±SD.n=5)

表4 各指标间相关性分析Table 4.Correlation analysis of the indexes in hepatic fibrosis rats
各种肝病往往伴发肠源性内毒素血症(intestinal endotoxemia,IETM)[3]。本实验模型组大鼠血浆内毒素含量明显增高,证实大鼠肝纤维化发病过程中有IETM形成。内毒素吸收入血增加,首先攻击Kupffer细胞致其过度活化,分泌大量促炎细胞因子如TNF-α等,不仅引起肝实质细胞的变性坏死,还可引起肝内异常免疫反应,促进纤维化的发生[4-5]。EMD处理组血浆内毒素水平明显降低,提示该组肝Kupffer细胞清除内毒素的作用有所增强,肠源性内毒素血症减轻。由于肺脏特殊的解剖位置,使其成为IETM的重要靶器官,循环中升高的内毒素作为最强的刺激物,刺激肺巨噬细胞产生和释放大量以TNF-α为主的细胞因子,引起肺脏的损伤,是肝硬化合并发生HPS的基本机制。本实验相关性分析显示,血浆ET水平与肺匀浆中TNF-α含量呈显著正相关。可以推测,肠源性内毒素和TNF-α同样是肝纤维化时肺组织病理变化的根本原因。大黄素处理组肺脏病变减轻,说明肝脏疾病恶化或减轻,都直接影响到肺脏,因此治疗肝脏病变是治疗肺病的根本。炎症引起的肝实质细胞损伤是纤维化形成的促发因素,EMD抗肝纤维化治疗作用中最主要的一点即抑制肝脏的炎症反应,减轻肝损伤。大黄素是Kupffer细胞中细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)和p38促分裂素原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)信号通路的有效抑制剂,可阻断LPS通过MAPK信号途径引起的肝Kupffer细胞活化,抑制内毒素引起的TNF-α分泌[6];EMD还能降低细胞内[Ca2+],下调钙调蛋白激酶活性,进而抑制与细胞因子有关的基因表达,减少炎症介质的产生,抑制过度炎症反应[7]。EMD可降低肠壁及肠毛细血管通透性,显著抑制肠道相关致病菌增殖和肠道内毒素的产生和吸收[8]。总之,EMD通过各种途径使肠源性内毒素血症减轻,使“泛滥”入血液循环的细菌、内毒素及TNF-α等细胞因子减少,间接保护了肺脏,使肺部病变有所缓解。
生理状态下,肺泡腔内仅有较少量的巨噬细胞,当肺部发生炎症或感染时内毒素吸引巨噬细胞聚集,进而活化、产生和释放大量的炎症因子。巨噬细胞在肺内的大量积聚可致过度炎症反应的发生,组织损伤进一步加重[9-10]。实验中我们观察到肝纤维化大鼠肺泡腔及间质中巨噬细胞数量明显增加,组织匀浆TNF-α含量增加。TNF-α不仅对肺组织有直接损伤作用,而且促使中性粒细胞聚集、黏附于血管内皮细胞,通过释放氧自由基和溶酶体酶导致肺血管内皮细胞损伤、增加毛细血管壁通透性[11];TNF-α还可以进一步诱导肺血管内巨噬细胞的聚集和浸润,使iNOS和eNOS表达增加,引起NO持续、大量释放[2]。过量的NO有强烈的舒血管效应,是引起肺血管扩张并进而导致低氧血症发生的重要介质。NO还可以和超氧阴离子发生快速非酶促化学反应,生成ONOO-。ONOO-可使脂质过氧化,导致细胞膜功能障碍和结构损伤,氧化肺泡表面活性物质,是较NO和超氧阴离子氧化性及细胞毒性更强的物质[2,12];TNF-α诱导产生的氧自由基可对肺间质透明质酸胶原氧化,改变间质的稳定性,加重肺损伤[13]。本实验同时检测到肺匀浆中脂质过氧化产物MDA含量升高,其也可诱导炎症反应进一步扩大,细胞损伤加重,肺水肿渗出严重。相关性检测显示,肺匀浆TNF-α与MDA、NO和ONOO-含量呈显著正相关,说明除肠源性内毒素对肺的直接损伤外,LPS作用后释放的最早炎症因子TNF-α可进一步诱导多种血管活性物质和炎症介质的释放,放大对肺组织的损伤效应。实验中大黄素处理组肺系数明显低于模型组,镜下观察肺泡腔及间隔中巨噬细胞数量明显减少,提示大黄素处理组肺毛细血管损伤程度减轻、炎症渗出减少,肺水肿有所缓解;且EMD处理组肺匀浆TNF-α、MDA、NO和ONOO-的含量明显降低,肺组织炎症减轻,这些结果均提示EMD很可能通过某些机制直接逆转肺脏的损伤:(1)抑制肺巨噬细胞受炎症刺激后TNF-α的释放;(2)强有力地抑制核转录因子κB的活化,减弱继发性炎症因子形成的“细胞因子级联反应”[14-15];(3)抑制肺组织炎症反应中iNOS的激活,减少NO的大量合成和释放[2]; (4)降低肺组织MDA含量、保护超氧化物歧化酶(super-oxide dismutase,SOD)活性,减轻肺内自由基对肺泡上皮细胞的损伤[2]。因此我们认为EMD也可通过在肺脏发挥直接的抗炎、清除氧自由基、抗氧化等作用来减轻肝纤维化时由肠源性内毒素所致的肺组织损伤。
综上所述,在肝纤维化过程中多种机制参与了肺脏的病理改变。EMD既可通过间接作用减少肝纤维化对肺脏的损伤,也可能通过直接作用使肺部病变有所缓解。本实验用不同剂量EMD比较对大鼠肝纤维化肺损伤的治疗效果,结果发现2种剂量无明显差异,说明EMD抗纤维化肺损伤的治疗剂量范围较大。对其治疗作用的深入研究,将为临床揭示肝肺综合征发病的新机制,寻求有效的非手术治疗途径提供新思路。
[1]Zhang J,Fallon MB.Hepatopulmonary syndrome:update on pathogenesis and clinical features[J].Nat Rev Gastroenterol Hepatol,2012,9(9):539-549.
[2]Zhang HY,Han DW,Zhao ZF,et al.Multiple pathogenic factor induced complications of cirrhosis in rats:a new model of hepatopulmonary syndrome with intestinal endotoxemia[J].World J Gastroenterol,2007,13(25):3500-3507.
[3]Han DW.Intestinal endotoxemia as a pathogenetic mechanism in liver failure[J].World J Gastroenterol,2002,8 (6):961-965.
[4]Riley TR,Taheri M,Schreibman IR.Does weight history affect fibrosis in the setting of chronic liver disease[J].J Gastrointestin Liver Dis,2009,18(3):299-302.
[5]Luedde T,Trautwein C.A molecular link between inflammation and fibrogenesis:the bacterial microflora influences hepatic fibrosis via Toll-like receptor 4-dependent modification of transforming growth factor-beta signaling in hepatic stellate cells[J].Hepatology,2008,47(3):1089-1091.
[6]郭江红,韩德五.内毒素诱发大鼠非酒精性脂肪性肝炎和胰岛素抵抗[J].中国病理生理杂志,2010,26 (5):1009-1011.
[7]Ding Y,Zhao L,Mei H,et al.Exploration of Emodin to treat alpha-naphthylisothiocyanate-induced cholestatic hepatitis via anti-inflammatory pathway[J].Eur J Pharmacol,2008,590(1-3):377-386.
[8]Kim JR,Oh DR,Cha MH,et al.Protective effect of polygoni cuspidati radix and emodin on Vibrio vulnificus cytotoxicity and infection[J].J Microbiol,2008,46(6): 737-743.
[9]田晓霞,贾建桃,冀菁荃,等.肝硬化大鼠肺脏的病理变化[J].长治医学院学报,2009,23(1):7-10.
[10]贾建桃,张慧英,田晓霞,等.葡萄糖调节蛋白78在复合致病因素诱导的大鼠肝肺综合征中的作用[J].中国病理生理杂志,2011,27(8):1580-1585.
[11]Dinis-Oliveira RJ,Remiao F,Duarte JA,et al.P-glycoprotein induction:an antidotal pathway for paraquat-induced lung toxicity[J].Free Radic Biol Med,2006,41 (8):1213-1224.
[12]Suzuki A,Kudoh S,Mori K,et al.Expression of nitric oxide and inducible nitric oxide synthase in acute renal allograft rejection in the rat[J].Int J Urol,2004,11(10): 837-844.
[13]Aiamieh HH,Candelario-Jalil E,Fernandez OS,et al.Ischaemic and pharmacological preconditionings protect liver via adenosine and redox status following hepatic ischaemia/reperfusion in rats[J].Clin Sci(Lond),2008,115(2):69-77.
[14]Li HL,Chen HL,Li H,et al.Regulatory effects of emodin on NF-κB activation and inflammatory cytokine expression in RAW264.7 macrophages[J].Int J Mol Med,2005,16(1):41-47.
[15]Guo JM,Xiao BX,Liu Q,et al.Anticancer effect of aloeemodin on cervical cancer cells involves G2/M arrest and induction of differentiation[J].Acta Pharmacol Sin,2007,28(12):1991-1995.
Protective effect of emodin on lung injury induced by hepatic fibrosis in rats
ZHANG Li-li1,ZHANG Hui-ying1,WANG Li-min2,LI Xu-jiong3,JIA Jian-tao1,LÜ Minli4,FAN Yi-min2,ZHAN Cui-ying3,LIU Ming-she5,ZHAO Zhong-fu5,HAN De-wu6,CHENG Ji7
(1Department of Pathophysiology,2Functional Integrative Laboratory,3Department of Physiology,5Institute of Hepatology,Changzhi Medical College,Changzhi 046000,China;4ICU of The Second Hospital,6Institute of Hepatology,Shanxi Medical University,Taiyuan 030001,China;7Research Center for Liver Disease,Keck School of Medicine,University of Southern California,Los Angeles,CA 90089,USA.E-mail:zhanghy2001@163.com)
AIM:To explore the protective effect of emodin on lung injury induced by hepatic fibrosis in rats.METHODS:The hepatic fibrosis rat model was established with multiple pathogenic factors(CCl4,ethanol,high fat,high cholesterol and low choline)and treated with different doses(20 mg/kg and 40 mg/kg)of emodin for 4 weeks.The hepatic index was measured.The biochemical indexes,endotoxin,homocysteine,albumin,aspartate aminotransferase,alanine aminotransferase,total bilirubin,total cholesterol and triglyceride,and hepatic fibrosis indexes,hyaluronic acid,laminin,collagen IV and procollagenⅢ,were detected.The histopathological changes of the liver were observed.The pulmonary index was determined.The histopathological changes of the lungs were observed.The levels of tumor necrosis factor α(TNF-α),malondialdehyde(MDA),nitric oxide(NO)and peroxynitrite(ONOO-)in the lung tissues were analyzed.RESULTS:The rat hepatic fibrosis model was successfully established.In model group,lung edema and inflammation occurred,and the pulmonary index and the levels of TNF-α,MDA,NO and ONOO-in the lung tissues were increased significantly.In emodin treatment groups,the pulmonary indexes were lower than that in model group.The pathological injury of the lung tissues was alleviated.The levels of TNF-α,MDA,NO and ONOO-in the lung tissues were decreased.CONCLUSION:Emodin has a protective effect on lung injury induced by hepatic fibrosis in rats.
Emodin;Liver fibrosis;Hepatopulmonary syndrome;Lung injury
R363
A
10.3969/j.issn.1000-4718.2014.02.017
1000-4718(2014)02-0291-06
2013-09-17
2013-12-10
国家自然科学基金(No.81070339);山西省国际科技合作计划(No.2010081068);山西医科大学细胞生理学省部共建教育部重点实验室主任基金资助项目(No.2010-09);山西省回国留学人员科研基金资助项目(No.211-091)
△通讯作者Tel:0355-3031235;E-mail:zhanghy2001@163.com

