硫化氢对缺氧诱导的大鼠皮层神经元损伤的保护作用*
魏楚蓉,刘路宽,田立兵,余艳贞,曾九江,白帅,毛慕华,文秀华,罗友根
(井冈山大学医学院神经退行性疾病与衰老研究中心,江西吉安 343000)
硫化氢对缺氧诱导的大鼠皮层神经元损伤的保护作用*
魏楚蓉,刘路宽,田立兵,余艳贞,曾九江,白帅,毛慕华,文秀华,罗友根△
(井冈山大学医学院神经退行性疾病与衰老研究中心,江西吉安 343000)
目的:探讨硫化氢(H2S)对缺氧诱导的皮层神经元损伤的影响及作用机制。方法:将SD大鼠皮层神经元在2%O2、5%CO2、93%N2、37℃培养箱培养24 h,建立细胞缺氧模型。以硫氢化钠(NaHS)作为H2S的供体,应用CCK-8分析细胞活性;采用荧光探针DCFH-DA检测神经元活性氧(ROS)含量;用Rh123染色测定线粒体膜电位(MMP);采用乳酸脱氢酶(LDH)试剂盒分析神经元LDH释放率,反映神经元的损伤情况。结果:(1)缺氧引起神经元ROS含量和LDH释放率升高,NaHS预处理可抑制缺氧所致神经元ROS含量和LDH释放率的升高; (2)缺氧降低神经元MMP和细胞活性,NaHS和活性氧清除剂NAC预处理均显著抑制缺氧所致神经元MMP和细胞活性的降低。结论:缺氧增加神经元ROS含量,降低神经元MMP和细胞活性,而H2S通过其抗氧化作用,减轻缺氧所致神经元的损伤。
缺氧;神经元损伤;硫化氢;活性氧类
神经元凋亡是缺氧性疾病的主要病理改变之一,已成为影响神经系统疾病死亡率和致残率的主要因素。研究表明自由基活动是缺氧诱导神经元损伤的一个重要机制[1-2]。低氧暴露,氧分压迅速降低,引起细胞内活性氧快速增多,脂质过氧化,导致细胞凋亡[3]。
内源性硫化氢(hydrogen sulfide,H2S)主要由半胱氨酸和同型半胱氨酸在胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)和胱硫醚β-合成酶(cystathionine β-synthase,CBS)作用下产生,在哺乳动物心血管、呼吸和神经系统中发挥着重要作用。近年来,研究发现H2S通过舒张血管[4]、调节神经突触传递及抗氧化作用[5-6]等多种途径,减少细胞损伤。而H2S在抑制缺氧诱导的神经细胞氧化应激反应中的作用机制还不够明确。硫氢化钠(sodium hydrosulfide,NaHS)在体内分解为Na+及HS-,后者与H+结合生成H2S,H2S和NaHS在体内形成动态平衡;因此,NaHS常被用来作为H2S的供体[7-8]。本研究采用原代培养皮层神经元,建立细胞缺氧模型;检测细胞活性、活性氧(reactive oxygen species,ROS)、线粒体膜电位(mitochondrial membrane potential,MMP)水平及乳酸脱氢酶(lactate dehydrogenase,LDH)释放率,探讨H2S对缺氧诱导神经元损伤的保护作用。
材料和方法
1 材料
NaHS、2',7'-二氢二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescin diacetate,DCFH-DA)、L-多聚赖氨酸和xestospongin C(Xesto C)购自Sigma;Fura-2/AM、0.25%胰酶、Neurobasal和B27购自Invitrogen;阿糖胞苷购自Roche;胎牛血清和马血清购自HyClone;LDH试剂盒购自南京建成生物工程研究所;CCK-8、Rh123和N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)购自碧云天生物技术研究所;激光共聚焦皿购自无锡耐思生物科技有限公司;SD大鼠购自中山大学实验动物中心。
2 方法
2.1 细胞培养SD大鼠怀孕至17~19 d颈椎脱臼处死,75%乙醇浸泡1~2 min,取出胎鼠,游离出全脑,分离皮层,剪碎后用0.25%的胰蛋白酶37℃消化10 min,加含10%胎牛血清的DMEM培养基终止消化。1 000×g离心8 min,弃上清,细胞用种板液(含10%胎牛血清、10%马血清、25 μmol/L L-谷氨酸和2 mmol/L L-谷氨酰胺的DMEM培养基)稀释成1×109/L的密度,接种于经0.04 g/L L-多聚赖氨酸包被的共聚焦皿。在37℃、5%CO2培养箱中培养24 h后吸出培养液,换用Neurobasal+B27培养基,培养2 d后加入5 μmol/L阿糖胞苷以抑制胶质细胞的生长,每2 d进行半量换液1次。细胞培养7 d后用于下列实验。
皮层神经元于2%O2、5%CO2、93%N2、37℃培养箱中培养复制缺氧模型。细胞缺氧前分别用50、100、200、300或600 μmol/L NaHS预处理30 min 和1 mmol/L NAC预处理60 min。
2.2 细胞活性检测将神经元以1×104/well接种于96孔板,培养7 d后进行细胞活性检测。各组细胞分别与CCK-8(每孔100 μL体积加10 μL CCK-8)孵育1.5 h,随后采用酶标仪在450 nm波长处测定各孔的吸光度(A)值。加相应量培养基和CCK-8溶液但没有细胞的孔作为空白对照。按公式:细胞活性(%)=(实验组A值-空白A值)/(对照组A值-空白A值)×100%,求出各组细胞活性。
2.3 神经元ROS测定DCFH-DA本身没有荧光,穿过膜进入细胞后,在胞内酶的作用下转变成DCFH。活性氧存在时,DCFH被氧化生成绿色荧光物质DCF,绿色荧光强度与细胞内活性氧水平呈正相关。因此,通过检测细胞DCF的荧光强度反映细胞内ROS含量。
神经元处理后,用含5 μmol/L DCFH-DA的Neurobasal+B27培养基于37℃避光孵育50 min,细胞用EBSS(6 800 NaCl,400 KCl,264 CaCl2·2H2O,200 MgCl2·7H2O,2 200 NaHCO3,140 NaH2PO4· H2O,及1 000葡萄糖,单位:mg/L;pH 7.2)清洗3次。DCF荧光值采用TCS SP5激光共聚焦系统(Leica)进行检测,随机选取3个视野进行成像,重复3次,DCF平均荧光强度采用LAS AF 5.2.1.6757软件进行分析。
2.4 神经元MMP测定Rh123是一种为线粒体所吸收的荧光染料,其吸收值随MMP的改变而呈现相应的变化,从而改变细胞的荧光强度。因此,可通过检测细胞Rh123的荧光强度反映细胞的MMP。神经元处理后,加入5 mg/L Rh123,避光于37℃孵育45 min,用激光共聚焦显微镜(激发波长488 nm,发射波长525 nm)随机选取3个视野拍照,重复3次,以平均荧光强度表示MMP。
2.5 神经元LDH活性测定实验方法参照试剂说明书。简而言之,收集培养液0.1 mL,加人1 mL含70%乳酸钠基质液和0.2 mg的辅酶I充分反应,在碱性条件下用2,4-二硝基苯肼显色,在440 nm读取吸光度。用同样的方法测定相应细胞裂解液中总的LDH,用培养液中LDH活性与相应细胞LDH总活性的比值来表示LDH释放率。
3 统计学处理
用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示,组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 硫化氢抑制缺氧诱导的神经元活性的下降
缺氧处理24 h,神经元活性降至对照组的(52.5±3.3)%(P<0.01),而NaHS(100、200、300和600 μmol/L)孵育神经元30 min后再行缺氧处理,细胞活性分别升至对照组的(63.5±4.0)%、(66.5± 7.4)%、(71.8±9.7)%和(73.6±8.4)%,见图1A。用不同浓度NaHS单独处理神经元,与对照组相比,细胞活性差异无统计学意义(P>0.05),见图1B。上述数据表明,硫化氢抑制缺氧诱导的神经元活性的降低。
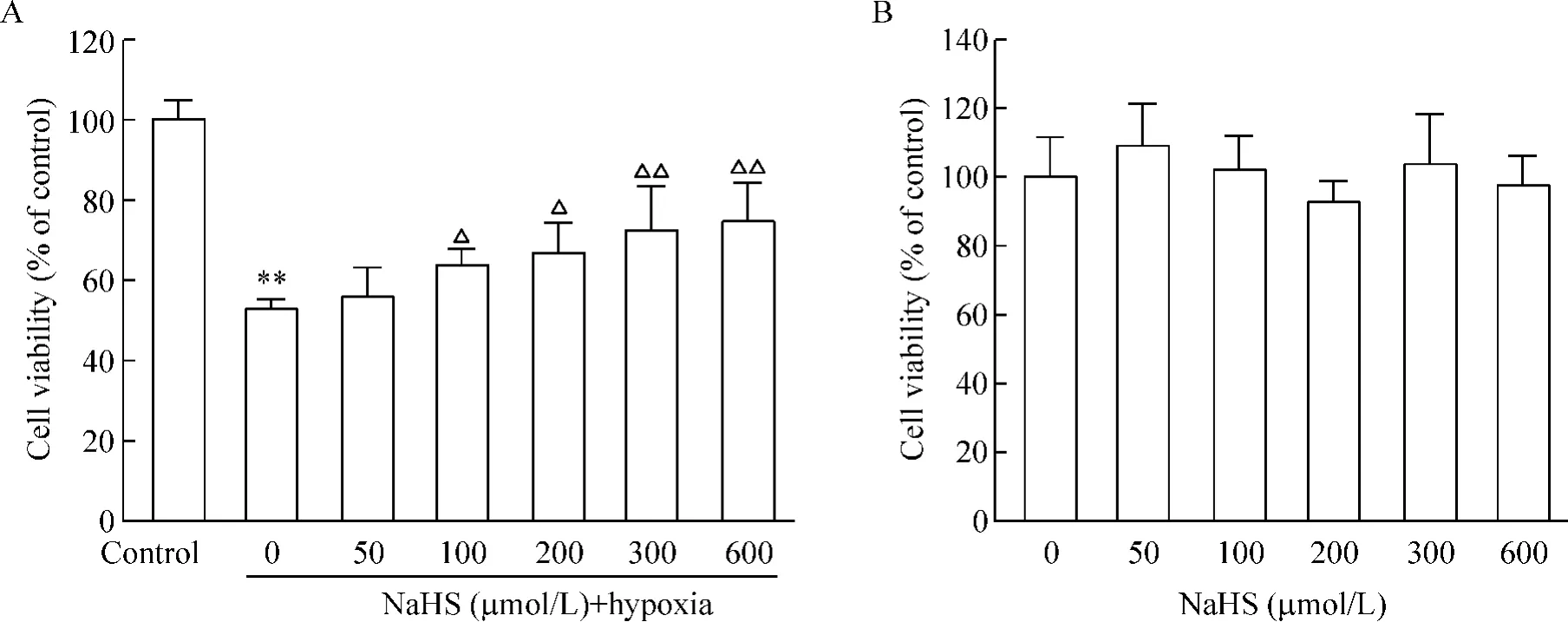
Figure 1.Inhibitory effect of H2S on the hypoxia-induced decrease in the viability of neurons.CCK-8 was employed to analysis the viability after cortical neurons were treated.A:the effect of H2S on the hypoxia-induced decrease in the viability of neurons; B:the effect of H2S on the viability of neurons.Mean±SD.n=4.**P<0.01 vs control;△P<0.05,△△P<0.01 vs 0 μmol/L NaHS+hypoxia.图1 H2S对缺氧诱导的神经元活性下降的抑制作用
2 硫化氢对缺氧诱导的神经元ROS含量变化的影响
如图2,缺氧24 h神经元DCF荧光值升高至48.1±12.5,为对照组(11.1±2.7)的4.4倍(P<0.01),而100 μmol/L和300 μmol/L NaHS预处理30 min后再缺氧处理,DCF荧光值分别降低至30.4±7.7和21.6±5.8,与缺氧组相比明显降低(P<0.01),但仍高于对照组(P<0.01)。单独使用100 μmol/L和300 μmol/L NaHS处理神经元,DCF荧光值分别是10.6±2.5和10.6±2.4,与对照组相比无显著差异(P>0.05)。上述结果表明H2S显著减少缺氧所致的神经元ROS含量的升高。
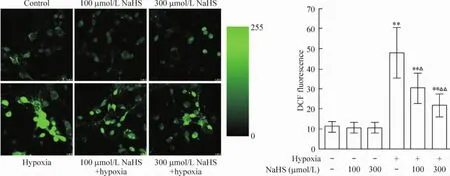
Figure 2.Effect of H2S on the hypoxia-induced variation of ROS content in neurons.The neurons were incubated with 5 μmol/L DCFH-DA for 50 min and then they were washed with EBSS.The fluorescent images were taken with a laser scanning confocal microscope and DCF fluorescent value was analyzed by LAS AF 5.2.1.6757 software.Mean±SD.n=3.**P<0.01 vs control(without treatment);△P<0.05;△△P<0.01 vs hypoxia alone.图2 H2S对缺氧诱导的神经元ROS含量变化的影响
3 硫化氢对缺氧诱导的神经元MMP变化的影响
MMP降低是细胞凋亡早期的重要特征之一。实验采用1 mmol/L NAC清除缺氧产生的ROS。如图3所示,缺氧组Rh123荧光值(10.6±2.1)显著低于对照组(22.1±3.4;P<0.01)。但用300 μmol/L NaHS或1 mmol/L NAC预处理后再行缺氧,Rh123荧光值分别回升到15.1±2.2和15.7±2.7,比缺氧组分别升高了(42.7±37.6)%和(49.0±35.6)%,但仍低于对照组(P<0.01)。单独用300 μmol/L NaHS或1 mmol/L NAC处理神经元,Rh123荧光值分别为22.9±3.9和23.0±4.7,与对照组相比无显著差异(P>0.05)。结合前面的结果提示,H2S通过清除活性氧从而抑制缺氧诱导的皮层神经元MMP的降低。

Figure 3.Effect of H2S on the hypoxia-induced change of MMP in neurons.The neurons were incubated with 5 mg/L Rh123 for 45 min at 37℃in the dark,and then three randomly selected fields were taken with a laser scanning confocal microscope.The fluorescence intensity was analyzed with LAS AF 5.2.1.6757 software.Mean±SD.n=3.**P<0.01 vs control(without treatment);△△P<0.01 vs hypoxia.图3 H2S对缺氧诱导的神经元MMP变化的影响
4 硫化氢对缺氧诱导的神经元LDH释放的影响
以缺氧组LDH释放率作为100%,将其它各组LDH释放率与之相比。如图4所示,缺氧组LDH释放率显著高于对照组(P<0.01),而300 μmol/L NaHS或1 mmol/L NAC预处理后再缺氧,LDH释放率分别降低至缺氧组的(66.1±8.0)%和(60.5± 10.6)%(P<0.01)。单纯使用NaHS或NAC处理神经元,LDH释放率与对照组相比无显著差异(P>0.05)。上述结果表明,H2S通过清除活性氧减少缺氧诱导的神经元LDH的释放。
讨论
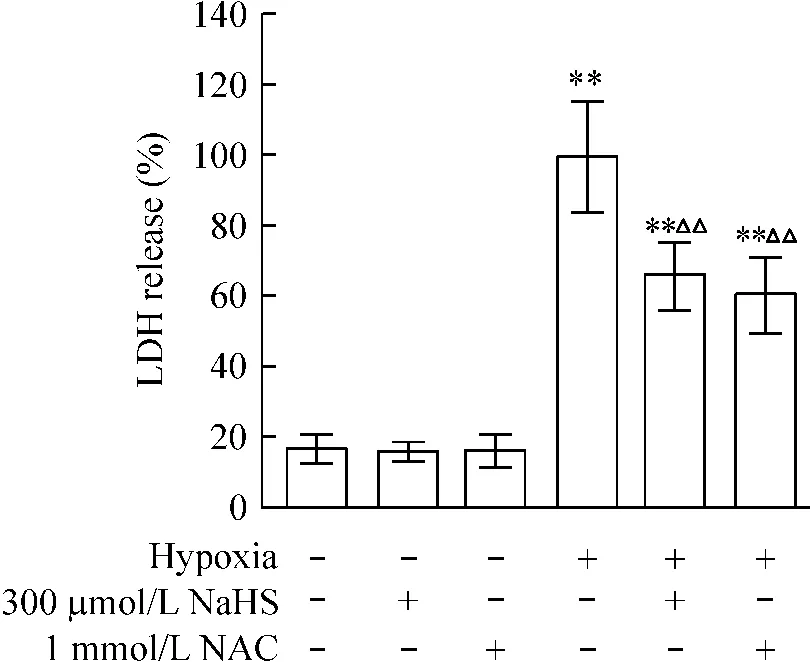
Figure 4.Effect of H2S on the hypoxia-induced LDH release in neurons.The commercial kit of LDH was used to analyze cell injury induced by hypoxia after neurons was treated.The LDH release rate was determined by LDH activity ratio between cell culture supernatant and cell lysate.Mean±SD.n=4.**P<0.01 vs control(without treatment);△△P<0.01 vs hypoxia alone.图4 H2S对缺氧诱导的神经元LDH释放的影响
ROS介导细胞氧化应激在细胞损伤早期阶段起着重要作用[9-10]。组织在缺氧环境下,能量代谢紊乱导致ROS产生增多;另一方面缺氧时抗氧化酶如过氧化物歧化酶、过氧化氢酶等的活性降低,ROS清除减少,随后对细胞造成氧化应激损伤[11]。ROS促进DNA、RNA、脂质及蛋白质的氧化损伤,导致细胞结构破坏、功能障碍,甚至凋亡[12-13]。本研究发现H2S抑制缺氧时皮层神经元的ROS增多,发挥抗氧化能力,提高神经元的活性。
线粒体是细胞内氧化磷酸化和ATP生成的主要场所,能量代谢的过程中伴随着ROS的产生[14]。因此,线粒体是细胞内ROS的主要来源地。同时线粒体又是氧化应激的主要靶点,对氧化应激损伤非常敏感[14-15]。过多ROS使线粒体膜通透性升高,细胞色素C释放,引起线粒体膜结构和功能受损。线粒体内膜损伤直接导致膜通透小孔开放,MMP降低,多种凋亡因子释放进入细胞质,这些是细胞凋亡启动的关键因素[16]。本实验结果显示,H2S通过清除ROS阻止缺氧诱导的MMP下降,神经元活性显著升高。
LDH释放率被作为细胞膜是否完整的重要标准[17]。缺氧诱导ROS增多,引起细胞膜损伤,细胞内的酶类(如LDH)释放到细胞外。因此,细胞培养基中LDH活性高低可以反映细胞损伤严重程度[18]。我们的实验表明,缺氧诱导LDH释放率升高,而H2S减少缺氧所致的LDH释放,提高神经元活性。ROS清除剂NAC有相似的效果。
综上所述,H2S的神经保护作用可能以线粒体为靶点,通过抑制缺氧诱导的ROS增多,维持MMP的稳定和减少LDH释放率,减轻缺氧诱导神经元的损伤。然而缺氧诱导神经元损伤是一个多因素参与的复杂过程,需要更进一步地探讨气体信号分子H2S的潜在作用,以期为临床治疗相关疾病提供确切的理论指导。
[1]Abramov AY,Scorziello A,Duchen MR.Three distinct mechanisms generate oxygen free radicals in neurons and contribute to cell death during anoxia and reoxygenation [J].J Neurosci,2007,27(5):1129-1138.
[2]Röhnert P,Schröder UH,Ziabreva I,et al.Insufficient endogenous redox buffer capacity may underlie neuronal vulnerability to cerebral ischemia and reperfusion[J].J Neurosci Res,2012,90(1):193-202.
[3]Xu W,Chi L,Row BW,et al.Increased oxidative stress is associated with chronic intermittent hypoxia-mediated brain cortical neuronal cell apoptosis in a mouse model of sleep apnea[J].Neuroscience,2004,126(2):313-323.
[4]Zhao W,Zhang J,Lu Y,et al.The vasorelaxant effect of H2S as a novel endogenous gaseous KATPchannel opener [J].EMBO J,2001,20(21):6008-6016.
[5]Tang XQ,Shen XT,Huang YE,et al.Hydrogen sulfide antagonizes homocysteine-induced neurotoxicity in PC12 cells[J].Neurosci Res,2010,68(3):241-249.
[6]Luo Y,Yang X,Zhao S,et al.Hydrogen sulfide prevents OGD/R-induced apoptosis via improving mitochondrial dysfunction and suppressing an ROS-mediated caspase-3 pathway in cortical neurons[J].Neurochem Int,2013,63(8):826-831.
[7]王兴民,季海锋,王万铁,等.硫化氢供体硫氢化钠对肺缺血-再灌注损伤细胞凋亡的影响[J].中国临床药理学与治疗学,2010,15(5):496-501.
[8]陈晓波,杜军保,耿彬,等.硫化氢对培养的大鼠主动脉平滑肌细胞增殖的抑制作用[J].中国病理生理杂志,2003,19(8):1009-1011.
[9]Stowe DF,Camara AK.Mitochondrial reactive oxygen species production in excitable cells:modulators of mitochondrial and cell function[J].Antioxid Redox Signal,2009,11(6):1373-1414.
[10]Kulkarni AC,Kuppusamy P,Parinandi N.Oxygen,the lead actor in the pathophysiologic drama:enactment of the trinity of normoxia,hypoxia,and hyperoxia in disease and therapy[J].Antioxid Redox Signal,2007,9(10):1717-1730.
[11]Xiao L,Lan A,Mo L,et al.Hydrogen sulfide protects PC12 cells against reactive oxygen species and extracellular signal-regulated kinase 1/2-mediated downregulation of glutamate transporter-1 expression induced by chemical hypoxia[J].Int J Mol Med,2012,30(5):1126-1132.
[12]Cui H,Kong Y,Zhang H.Oxidative stress,mitochondrial dysfunction,and aging[J].J Signal Transduct,2012,2012:646354.
[13]尤寿江,石际俊,张艳林,等.ROS介导的自噬及其在相关疾病中的作用[J].中国病理生理杂志,2011,27(1): 187-190,195.
[14]Kudin AP,Bimpong-Buta NY,Vielhaber S,et al.Characterization of superoxide-producing sites in isolated brain mitochondria[J].J Biol Chem,2004,279(6):4127-4135.
[15]刘朝巍,张涛,杨卓.氧化应激损伤线粒体参与癫痫病理过程[J].中国病理生理杂志,2008,24(1):198-200.
[16]Halestrap AP,Clarke SJ,Javadov SA.Mitochondrial permeability transition pore opening during myocardial reperfusion:a target for cardioprotection[J].Cardiovasc Res,2004,61(3):372-385.
[17]Shih CL,Chi SI,Chiu TH,et al.Ethanol effects on nitric oxide production in cerebral pial cultures[J].Alcohol Clin Exp Res,2001,25(4):612-618.
[18]Duan J,Yu Y,Li Y,et al.Toxic effect of silica nanoparticles on endothelial cells through DNA damage response via Chk1-dependent G2/M checkpoint[J].PLoS One,2013,8(4):e62087.
Protective effect of hydrogen sulfide on hypoxia-induced injury of rat cortical neurons
WEI Chu-rong,LIU Lu-kuan,TIAN Li-bing,YU Yan-zhen,ZENG Jiu-jiang,BAI Shuai,MAO Mu-hua,WEN Xiu-hua,LUO You-gen
(Research Center of Neurodegenerative Diseases and Aging,Medical College of Jinggangshan University,Ji’an 343000,China.E-mail:lyougen@163.com)
AIM:To explore the role of hydrogen sulfide(H2S)in cortial neuronal injury induced by hypoxia.METHODS:The SD rat cortical neurons were cultured in hypoxic conditions(2%O2,5%CO2and 93%N2at 37°C) to establish the hypoxic model.Sodium hydrosulfide(NaHS)was used as the donor of H2S and neuronal viability was detected by CCK-8 assay.Neuronal content of reactive oxygen species(ROS)was determined by DCFH-DA method,and mitochondrial membrane potential(MMP)was detected using Rh123 staining.Lactate dehydrogenase(LDH)release rate was measured by a commercial kit to reflect the degree of neuronal injury.RESULTS:Hypoxic treatment increased ROS content and the release rate of LDH in the neurons.However,NaHS pretreatment significantly inhibited the hypoxia-induced increases in ROS content and LDH release.Hypoxia decreased MMP and cell viability.Pretreatment with NaHS and N-acetyl-L-cysteine(NAC),a ROS scavenger,significantly inhibited the decreases in MMP and viability of the neurons.CONCLUSION:Hypoxia induces ROS generation in the neurons,thereby decreases MMP and neuronal viability.H2S significantly attenuates hypoxia-induced neuronal injury by its antioxygenation.
Hypoxia;Neuronal injury;Hydrogen sulfide;Reactive oxygen species
Q421
A
10.3969/j.issn.1000-4718.2014.02.002
1000-4718(2014)02-0203-05
2013-11-11
2013-12-08
国家自然科学基金资助项目(No.31360238);江西省自然科学基金资助项目(No.20132BAB205020);井冈山大学2013年度国家级大学生创新创业训练计划资助项目(No.2013001);吉安市科技支撑资助项目[No.(2012)32号10];井冈
山大学自然科学科研项目(No.JZ1210)
△通讯作者Tel:0796-8117893;E-mail:lyougen@163.com

