沉默NANOG表达对人肝癌细胞HepG2中cyclin D1表达及细胞增殖的影响*
周嘉嘉,陈汝福,邓小耿,周雨,周泉波,张杰,伍耀豪,曾乐祥,邱荣林
(中山大学孙逸仙纪念医院外科,广东广州 510120)
沉默NANOG表达对人肝癌细胞HepG2中cyclin D1表达及细胞增殖的影响*
周嘉嘉,陈汝福△,邓小耿,周雨,周泉波,张杰,伍耀豪,曾乐祥,邱荣林
(中山大学孙逸仙纪念医院外科,广东广州 510120)
目的:探讨RNA干扰沉默NANOG表达后对肝癌细胞HepG2中细胞周期素D1(cyclin D1)表达及细胞增殖的影响。方法:将以NANOG基因为靶点的NANOG-siRNA瞬时转染肝癌细胞HepG2,real-time PCR和Western boltting检测NANOG、cyclin D1 mRNA和蛋白的表达,CCK-8和平板克隆形成实验检测细胞增殖能力,流式细胞术检测细胞周期情况。结果:与mock组比较,转染NANOG-siRNA后,肝癌细胞HepG2中NANOG、cyclin D1 mRNA和蛋白水平均下调(P<0.05),细胞增殖能力下降(P<0.05),进入G0/G1期的细胞比例增多(P<0.05)。结论:沉默NANOG表达可引起肝癌细胞HepG2中cyclin D1的表达下降,导致细胞增殖能力下降。
肝肿瘤;NANOG蛋白;细胞增殖;细胞周期蛋白D1
肝细胞癌(hepatocellular carcinoma,HCC)是临床上最常见的恶性肿瘤之一,据统计全世界每年新发肝癌患者约60万,居恶性肿瘤的第5位。目前我国发病人数约占全球的半数以上,占全球肝癌病人的55%,严重威胁国人的健康和生命。NANOG是近年来发现的一个维持胚胎干细胞(embryonic stem cells,ESCs)自我更新和多向分化潜能的重要转录因子,是干细胞具有发育成各种类型细胞能力的“总开关”,被认为是全能性或多能性干细胞的标志物[1-3]。研究发现NANOG在乳腺癌、前列腺癌、结肠癌等异常表达,提示NANOG也可能是某些肿瘤的标志之一[4-5]。细胞周期素D1(cyclin D1)作为重要的细胞周期调节因子之一,其过度表达是多种人类原发性肿瘤的特征,对肿瘤的诊断和预后判断具有重要意义[6]。Cyclin D1蛋白表达增加主要见于一些原发性恶性肿瘤,例如乳腺癌、肝细胞癌[6-7]。本研究通过RNA干扰(RNA interference,RNAi)技术沉默肝癌细胞HepG2中NANOG的表达,探讨其对肝癌细胞cyclin D1表达以及肝癌细胞增殖活性的影响。
材料和方法
1 材料
人肝癌细胞株HepG2由本实验室保存,RPMI-1640培养基及胰蛋白酶购自Gibco;脂质体2000(LipofectamineTM2000)购自Invitrogen;NANOG和cyclin D1兔抗人单克隆抗体购自CST;总RNA提取试剂Trizol购自Invitrogen;real-time PCR试剂盒购自TaKaRa;CCK-8试剂购自日本同仁化学研究所。
2 方法
2.1 细胞培养及转染HepG2细胞培养于含10%胎牛血清的RPMI-1640培养基中,置于37℃、5% CO2和相对湿度95%的恒温培养箱中培养,1~2 d换液。取对数生长期HepG2细胞,接种于6孔培养板中,培养24 h后待细胞融合达85%左右时进行细胞转染。转染前2 h更换不含血清的新鲜培养基。设计siRNA干扰序列靶点:GFP 5’-ACT ACC TGT TCC ATG GCC A-3’;NANOG 5’-CCA GAC CTG GAA CAA TTC A-3’;由广州锐博生物公司合成。实验分组:以无血清培养基培养+脂质体2000处理组(以下简称mock组);脂质体2000转染GFP-siRNA组(以下简称siGFP组);脂质体2000转染NANOG-siRNA组(以下简称siNANOG组)。按脂质体2000转染试剂盒说明书进行细胞转染,24~48 h后收集细胞进行后续实验。如接种在96孔板中,按说明书相应地调整细胞数及转染试剂量。
2.2 Real-time PCR检测NANOG mRNA表达细胞转染24 h后,Trizol法提取各组细胞总RNA,紫外分光光度计检测RNA浓度及纯度。按real-time PCR试剂盒操作说明书合成cDNA。NANOG(109 bp)上游引物5’-CAG AAG GCC TCA GCA CCT AC-3’,下游引物5’-TGG CAC CCA GCA CAA TGA A-3’;βactin(186 bp)上游引物5’-ATT GTT CCA GGT CTG GTT GC-3’,下游引物5’-CTA AGT CAT AGT CCG CCT AGA AGC A-3’。PCR反应条件:95℃20 s,95 ℃10 s,60℃30 s,70℃10 s,35个循环。所有标本均重复检测3次,计算出Ct值,采用2-ΔΔCt法进行计算分析。
2.3 Western blotting测定NANOG和cyclin D1蛋白的表达细胞转染48 h后,按说明书提取总蛋白,BCA法测定蛋白浓度。配制10%SDS-PAGE凝胶,各上样孔加入25 μg蛋白样品,电泳后转印至硝酸纤维素膜(PVDF)膜上。PVDF膜以50 g/L脱脂奶粉封闭2 h。分别加入NANOG和cyclin D1兔抗人单克隆Ⅰ抗(1∶1 000)于4℃孵育过夜。经TBST漂洗3次后,加入辣根过氧化物酶标记的羊抗兔Ⅱ抗(1∶5 000),室温孵育1 h,TBST漂洗3次,ECL化学发光法试剂盒显影、曝光。经Bio-Rad公司图形分析软件Quantity One对图片进行分析并测定灰度值。
2.4 CCK-8法检测细胞增殖情况取对数生长期HepG2细胞,接种于96孔板,培养24 h,转染siRNA。细胞转染后12 h、24 h、36 h、48 h、60 h和72 h,更换为不含血清的新鲜培养基,并加入10 μL CCK-8试剂。置于37℃孵育2 h,用酶标仪测定450 nm的吸光度,每个时点每组设5个复孔。
2.5 平板克隆形成实验细胞转染24 h后,将细胞用胰酶消化后吹散成单细胞悬液,取500个细胞接种于培养皿中,每组设3个重复孔。于37℃、5% CO2和相对湿度95%的恒温培养箱中培养7d。用多聚甲醛固定,1%结晶紫染色。显微镜下计算克隆形成数(含有10个细胞以上的集落为1个克隆),克隆形成率(%)=克隆形成数/接种细胞数×100%。
2.6 流式细胞术测定细胞周期细胞转染48 h后,收集细胞,用PBS制备成单细胞悬液,用75%乙醇4℃固定过夜,固定后细胞经PBS洗涤2次。避光条件下加入PI染液,室温孵育30 min,上流式细胞仪分析样品,测定细胞周期。
3 统计学处理
数据用均数±标准差(mean±SD)表示,用SPSS 13.0统计软件进行分析,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 RNAi对NANOG表达的影响
Real-time PCR检测显示,siNANOG组NANOG mRNA表达水平均较mock组明显下降,比值为0.340±0.055,差异有统计学意义(P<0.05); siGFP组与mock组相比NANOG mRNA表达水平无明显差异,比值为0.980±0.038(P>0.05),见图1。Western blotting结果显示,siNANOG组NANOG蛋白表达水平较mock组明显下降,灰度比值为0.430±0.077,差异有统计学意义(P<0.05);siGFP组与mock组的NANOG蛋白表达水平则无明显差异,灰度比值为0.960±0.047(P>0.05),见图2。

Figure 1.NANOG mRNA expression in HepG2 cells.Mean± SD.n=3.*P<0.05 vs mock.图1 HepG2细胞中NANOG mRNA的表达

Figure 2.NANOG protein expression in HepG2 cells.Mean± SD.n=3.*P<0.05 vs mock.图2 HepG2细胞中NANOG蛋白的表达
2 NANOG对细胞生长曲线的影响
CCK-8实验结果显示,siNANOG组细胞在48~72 h吸光度值显著低于mock组,差异有统计学意义(P<0.05);siGFP组与mock组相比无显著差异(P>0.05),见图3。
3 NANOG对细胞克隆形成的影响
各组克隆形成率:siNANOG组为(7.4±3.8)%,siGFP组为(16.8±2.5)%,mock组为(17.3± 2.2)%。siNANOG组细胞克隆形成率低于mock组,差异有统计学意义(P<0.05);siGFP组与mock组细胞克隆形成率无明显差异(P>0.05),见图4。

Figure 3.Proliferation curves of HepG2 cells.Mean±SD.n= 5.*P<0.05 vs mock.图3 HepG2细胞增殖曲线

Figure 4.Flat plate colony formation assay of HepG2 cells.Mean±SD.n=3.*P<0.05 vs mock.图4 HepG2细胞的克隆形成率
4 NANOG对细胞周期的影响
流式细胞术结果显示,与mock组细胞G0/G1期(57.8±5.05)%相比,siNANOG组细胞G0/G1期百分比升高,为(74.6±8.21)%,S+G2/M期细胞数相应下降,差异有统计学意义(P<0.05)。siGFP组与mock组细胞G0/G1期百分比无明显差异(P>0.05),见图5。
5 NANOG对cyclin D1蛋白表达的影响
Real-time PCR检测显示,采用siRNA抑制NANOG表达后siNANOG组细胞cyclin D1 mRNA表达水平均较mock组明显下降,比值为0.390± 0.067,差异有统计学意义(P<0.05);siGFP组与mock组相比,cyclin D1 mRNA表达水平则无明显差异,比值为0.950±0.054(P>0.05),见图6。Western blotting结果显示,siNANOG组的cyclin D1蛋白表达水平较mock组明显下降,灰度比值为0.400±0.075,差异有统计学意义(P<0.05);siGFP组与mock组的cyclin D1蛋白表达水平则无明显差异,灰度比值为0.920±0.063(P>0.05),见图7。这表明RNAi沉默NANOG表达后降低HepG2细胞中cyclin D1 mRNA和蛋白的表达。
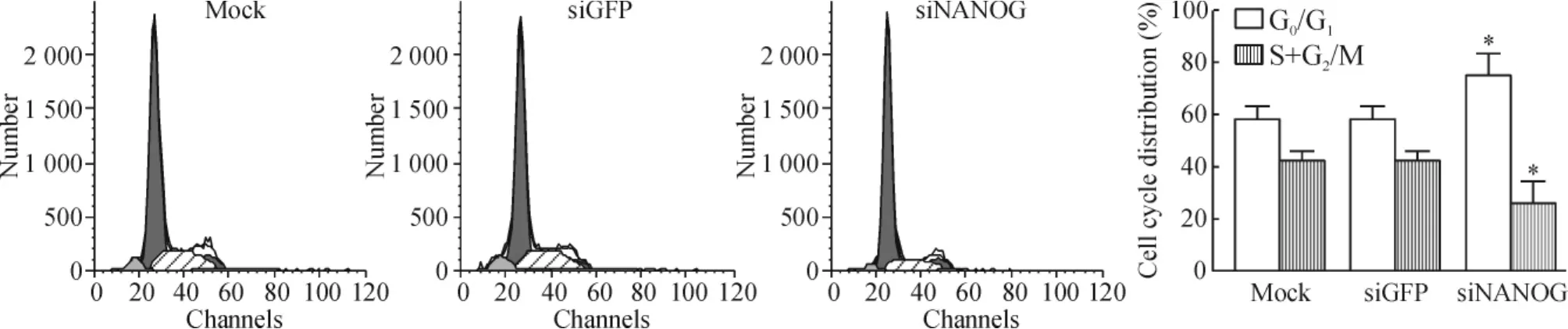
Figure 5.Cell cycle assay of HepG2 cells.Mean±SD.n=3.*P<0.05 vs mock.图5 HepG2细胞的细胞周期情况

Figure 6.Cyclin D1 mRNA expression in HepG2 cells.Mean± SD.n=3.*P<0.05 vs mock.图6 HepG2细胞中cyclin D1 mRNA的表达

Figure 7.Cyclin D1 protein expression in HepG2 cells.Mean ±SD.n=3.*P<0.05 vs mock.图7 HepG2细胞中cyclin D1蛋白的表达
讨论
2003年Chambers和Mitsui几乎同时报道了一种在囊胚内细胞群、原始生殖细胞及胚胎干细胞系表达的新转录因子,命名为NANOG,意即“生命绿洲”和“永不枯竭”[1-2]。在ESCs中,NANOG可特异性结合下游靶基因启动子区域ATTA结合元件,发挥转录调节作用,维持ESCs自我更新和多向分化潜能[3,8]。最初以为NANOG只在胚胎干细胞、胚胎生殖细胞以及胚胎癌细胞等多能性细胞中表达,在正常成体组织中不表达。近年研究发现NANOG在精原细胞瘤、乳腺癌、前列腺癌和视网膜母细胞瘤等异常表达[4-5,9-10]。实验证实,将NANOG基因转入造血干细胞后,引起了γδT细胞恶性肿瘤的发生,研究者认为NANOG是一种癌基因,可导致恶性转化[11]。外源表达NANOG能促进NIH3T3细胞增殖,使细胞生长速度加快[12]。研究还发现,NANOG还与肿瘤进展有关:下调NANOG表达可阻止肿瘤恶性进展,在某些情况下,改变了细胞分化[4]。本研究结果显示,以未处理的mock组作为对照,肝癌细胞HepG2在转染NANOG-siRNA后,NANOG mRNA和蛋白表达水平均显著下降;细胞生长曲线及克隆形成实验显示,下调NANOG表达后HepG2细胞增殖能力减弱,增殖速度下降,而转染GFP-siRNA 的HepG2细胞和mock组之间没有明显差异,表明下调NANOG表达可抑制肝癌细胞HepG2的细胞增殖。
细胞周期是细胞生命活动的基本过程,主要分为4个时期G1期、S期、G2和M期,遵循G1-S-G2-M演变规律,其中G1/S和G2/M为2个重要的检查点,而前者尤为重要。细胞一旦从G1跨入S则不再依靠外来信息刺激而自动完成分裂过程[13]。在G1/S期,cyclin D1是G1期进展的限速控制因素,在调控细胞增殖及细胞周期进程中有重要意义[6]。软件分析发现cyclin D1基因启动子区域存在2个以上ATTA结合元件,这为NANOG直接调控cyclin D1基因的转录和表达提供了可能。本研究结果显示,转染NANOG-siRNA后,cyclin D1 mRNA和蛋白表达水平均显著下降,转染GFP-siRNA的细胞和mock组之间则没有明显差异,表明下调NANOG表达可以降低肝癌细胞HepG2中cyclin D1蛋白的表达水平,NANOG可能是通过特异性结合cyclin D1基因启动子区域ATTA结合元件而发挥转录调控活性的。流式细胞术结果显示,转染NANOG-siRNA后,进入G0/G1期的细胞较mock组明显增多,转染GFP-siRNA的细胞与mock组之间则没有明显差异,表明下调NANOG表达可以调节细胞周期的进程,而下调NANOG表达对细胞增殖及细胞周期的影响主要是通过阻滞细胞周期于G0/G1期实现的,这一功能的实现可能与下调NOANG表达后对cyclin D1的抑制作用有关。
综上所述,通过RNAi技术沉默NANOG表达,可引起人肝癌细胞HepG2中cyclin D1表达的下降,细胞增殖能力的减弱以及细胞周期的改变。NANOG可能是通过作用于cyclin D1基因启动子区域的ATTA结合元件而调节cyclin D1的转录活性,进而下降cyclin D1的表达水平。Cyclin D1可能参与了NANOG对细胞增殖及细胞周期的调控作用。
[1]Chambers I,Colby D,Robertson M,et al.Functional expression cloning of Nanog,a pluripotency sustaining factor in embryonic stem cells[J].Cell,2003,113 (5):643-655.
[2]Mitsui K,Tokuzawa Y,Itoh H,et al.The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J].Cell,2003,113(5): 631-642.
[3]Silva J,Nichols J,Theunissen TW,et al.Nanog is the gateway to the pluripotent ground state[J].Cell,2009,138(4):722-737.
[4]Jeter CR,Badeaux M,Choy G,et al.Functional evidence that the self-renewal gene NANOG regulates human tumor development[J].Stem Cells,2009,27(5):993-1005.
[5]Gu G,Yuan J,Wills M,et al.Prostate cancer cells with stem cell characteristics reconstitute the original human tumor in vivo[J].Cancer Res,2007,67(10):4807-4815.
[6]Musgrove EA,Caldon CE,Barraclough J,et al.Cyclin D as a therapeutic target in cancer[J].Nat Rev Cancer,2011,11(8):558-572.
[7]刘娟,殷飞,姚树坤,等.细胞周期素D1、视网膜母细胞瘤样蛋白2及微小染色体维持蛋白7在肝细胞癌中的表达及对预后的意义[J].中国病理生理杂志,2011,27(2):304-309.
[8]Boyer LA,Lee TI,Cole MF,et al.Core transcriptional regulatory circuitry in human embryonic stem cells[J].Cell,2005,122(6):947-956.
[9]Ezeh UI,Turek PJ,Reijo RA,et al.Human embryonic stem cell genes OCT4,NANOG,STELLAR,and GDF3 are expressed in both seminoma and breast carcinoma [J].Cancer,2005,104(10):2255-2265.
[10]Seigel GM,Hackam AS,Ganguly A,et al.Human embryonic and neuronal stem cell markers in retinoblastoma [J].Mol Vis,2007,13:823-832.
[11]Tanaka Y,Era T,Nishikawa S,et al.Forced expression of Nanog in hematopoietic stem cells results in a γδT-cell disorder[J].Blood,2007,110(1):107-115.
[12]Zhang J,Wang X,Chen B,et al.Expression of Nanog gene promotes NIH3T3 cell proliferation[J].Biochem Biophys Res Commun,2005,338(2):1098-1102.
[13]Fry AM,O'Regan L,Sabir SR,et al.Cell cycle regulation by the NEK family of protein kinases[J].J Cell Sci,2012,125(Pt 19):4423-4433.
Effect of NANOG silencing on cyclin D1 expression and proliferation in human hepatoma HepG2 cells
ZHOU Jia-jia,CHEN Ru-fu,DENG Xiao-geng,ZHOU Yu,ZHOU Quan-bo,ZHANG Jie,WU Yao-hao,ZENG Le-xiang,QIU Rong-lin
(Department of Surgery,Sun Yat-sen Memorial Hospital,Sun Yat-sen University,Guangzhou 510120,China.E-mail: chenrf63@163.com)
AIM:To investigate the effect of NANOG silencing on cyclin D1 expression and proliferation in human hepatoma HepG2 cells.METHODS:Transient transfection of NANOG targeting siRNA into HepG2 cells was performed.The expression of NANOG and cyclin D1 at mRNA and protein levels was detected by real-time PCR and Western blotting.Cell proliferation was examined by CCK-8 assay and colony formation assay,and cell cycle was tested by flow cytometry.RESULTS:After transfection with NANOG-targeting siRNA,the inhibition of NANOG expression was observed.Compared with mock group,the mRNA and protein expression levels of NANOG and cyclin D1 were decreased(P<0.05).In addition,knockdown of NANOG expression inhibited the cell proliferation and increased the proportion of G0/ G1-phase cells(P<0.05).CONCLUSION:Silencing of NANOG expression in HepG2 cells causes down-regulation of cyclin D1 expression and decreases the cell proliferation ability.
Liver neoplasms;NANOG protein;Cell proliferation;Cyclin D1
R735.7
A
10.3969/j.issn.1000-4718.2014.02.009
1000-4718(2014)02-0245-05
2013-09-15
2013-12-02
国家自然科学基金资助项目(No.30872485;No.81000889)
△通讯作者Tel:020-81332020;E-mail:chenrf63@163.com

