rhTGF-β1对SD大鼠MSCs骨向分化的影响及机制研究*
尹素娟, 张荣华, 朱晓峰, 王攀攀, 杨 丽△
(暨南大学1药学院,2附属第一医院,广东 广州 510632)
rhTGF-β1对SD大鼠MSCs骨向分化的影响及机制研究*
尹素娟1, 张荣华1, 朱晓峰2, 王攀攀2, 杨 丽1△
(暨南大学1药学院,2附属第一医院,广东 广州 510632)
目的:通过观察重组人转化生长因子β1(rhTGF-β1)对大鼠骨髓间充质干细胞(MSCs)增殖和骨向分化能力的影响,以及对骨形态发生蛋白2(BMP-2)、Smad4及核心结合因子α1(Cbfa1)的作用,阐释其对MSCs骨向分化影响以及可能的作用机制。方法:用全骨髓贴壁法分离、纯化SD大鼠MSCs;用MTT法检测0、5、10、20、40、80和100 μg/L rhTGF-β1对MSCs增殖活性的影响;以碱性磷酸酶(ALP)活性及ALP染色阳性率确定rhTGF-β1的最佳促MSCs骨向分化浓度,并以该浓度对MSCs骨向分化进行干预。按是否添加经典成骨诱导液将实验分为:正常组、经典组、rhTGF-β1组和rhTGF-β1+经典组。通过检测ALP、I型胶原、骨钙素表达和钙化结节的数目,评价各组骨向分化能力;通过检测BMP-2、Smad4和Cbfa1 mRNA的表达,评价各组促MSCs骨向分化的可能作用机制。结果:rhTGF-β1最佳促MSCs增殖浓度为10 μg/L,最佳促MSCs骨向分化浓度为5 μg/L。经典组、rhTGF-β1组和rhTGF-β1+经典组均能促进MSCs骨向分化,刺激BMP-2分泌,并上调Smad4和Cbfa1 mRNA的表达,且rhTGF-β1对MSCs成骨分化的早期、中期效果好,而rhTGF-β1+经典组对MSCs成骨分化的晚期效果更为明显。结论:经典组、rhTGF-β1组和rhTGF-β1+经典组均有促MSCs骨向分化的作用,其机制可能是促进BMP-2的分泌,通过TGF-β超家族/Smads信号通路调控骨向分化。
骨髓间充质干细胞;成骨分化;转化生长因子
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是在骨髓中发现的一种起源于中胚层,具有自我复制和多向分化潜能的非造血干细胞。影响MSCs骨向分化的细胞因子主要包括:转化生长因子β(transforming growth factor β,TGF-β)、骨形态发生蛋白(bone morphogenetic proteins,BMPs)、碱性成纤维细胞生长因子、血管内皮细胞生长因子、肿瘤坏死因子、胰岛素样生长因子等,其中以TGF-β和BMPs报道较多。本实验通过观察重组人转化生长因子β1(recombinant human tansforming growth factor β1,rhTGF-β1)的促 MSCs骨向分化能力,及观察其在促MSCs骨向分化过程中对BMP-2、Smad4和核心结合因子α1(core binding factor α1,Cbfa1)表达的影响,阐释其可能的作用机制。
材料和方法
1 材料
1.1 动物 清洁级3月龄SD雌性大鼠5只,体重(230±10)g,由中山大学实验动物中心提供(合格证号为粤监证字2005A010)。
1.2 实验药物及试剂 rhTGF-β1(Cell Science公司分装),L-DMEM培养基(Gibco),地塞米松、β-甘油磷酸钠和维生素 C(Sigma),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(南京建成生物工程研究所),大鼠I型胶原(type I collagen,Col I)ELISA试剂盒(美国ADL诊断实验室),骨钙素(bone Gla protein,BGP)放射免疫分析药盒(解放军总医院科技开发中心放免所),Rat BMP-2 ELISA试剂盒(R&D),TaKaRa SYBR® ExScriptTMRT PCR Kit(Perfect Real Time)试剂盒(大连宝生物工程有限公司)。
2 方法
2.1 rhTGF-β1的制备 使用低糖无血清培养基将rhTGF-β1分别溶解至终浓度为1 mg/L,0.22 μm微孔过滤器过滤除菌,无菌条件下分装,-20℃保存备用。
2.2 经典成骨诱导液的配制 取10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μmol/L维生素C、10%胎牛血清,无菌条件下用高糖DMEM定容至100 mL,充分混匀,4℃保存。
2.3 MSCs的分离、培养及传代 采用全骨髓贴壁法分离大鼠MSCs,接种24 h后首次半量换液,之后每3 d换液1次。待细胞达到80% ~90%融合后,以1∶2比例传代,并建立大鼠MSCs稳定分离培养体系与鉴定[1]。
2.4 rhTGF-β1促MSCs增殖最佳浓度的确定 采用MTT法,取第3代MSCs以1×104cells/well接种于96孔板,设置空白组(既无细胞也无药物)、对照组(有细胞但未加药物),rhTGF-β1组6个浓度组,共8个组,每组6个复孔。待细胞接种24 h后,换入无血清培养基,24 h细胞周期同步化后,分别添加无血清培养基及rhTGF-β1,使其终浓度为0、5、10、20、40、80和100 μg/L,每孔终体积200 μL。培养板置于37℃、5%CO2培养箱中继续培养。72 h后,每孔加入5 g/L的MTT 20 μL/well,置37℃、5%CO2培养箱中孵育4 h后,弃去上清液,加DMSO 150 μL/well,微孔振荡器振荡10 min使甲臜充分溶解,酶标仪测吸光度(A)值,波长490 nm。
2.5 rhTGF-β1促MSCs骨向分化最佳浓度的确定第3代MSCs以5×107cells/L的密度接种于24孔板,设置空白组(既无细胞也无药物)、对照组(有细胞但未加药物)和rhTGF-β1组6个浓度组,共8个组,每组5个复孔。待细胞接种24 h后,换入无血清培养基,24 h细胞周期同步化后,再加入药物及完全培养基,使药物终浓度分别为0、5、10、20、40、80和100 μg/L,每孔终体积1 mL。培养板置于37℃、5% CO2培养箱中继续培养。每3 d换液1次,连续干预14 d。第14天取细胞上清液,检测其ALP含量;并将每孔进行ALP染色,光镜下随机取10个非重叠视野,高倍镜下记数ALP阳性细胞和总细胞数,计算阳性染色率。综合上述2种方法检测的ALP进行统计学分析,以确定rhTGF-β1最佳的促MSCs骨向分化浓度。
2.6 实验分组 本实验分为4个组,分别如下:空白组(N group):含10%FBS的L-DMEM完全培养液;经典组(C group):含10%FBS的L-DMEM完全培养液+经典成骨诱导剂;rhTGF-β1组(T group):含10%FBS的L-DMEM培养液+5 μg/L rhTGF-β1; rhTGF-β1+经典组(T+C group):含10%FBS的L-DMEM完全培养液+经典成骨诱导剂+5 μg/L rhTGF-β1。
2.7 指标检测
2.7.1 ALP活性 第3代MSCs以5×107cells/L接种于24孔板,共6组,每组6个复孔。待细胞接种24 h后,换入无血清培养基,待细胞周期同步化24 h后加药,每3~4 d换液1次,连续干预14 d。干预期间分别取3、7、10和14 d细胞上清液,-20℃保存,标本收集齐后按照ALP试剂盒说明检测ALP活性。
2.7.2 Col I和BGP释放量 按上述分别取7、14和21 d细胞上清液,-20℃保存,样本收集齐后,按Rat Col I ELISA试剂盒和BGP放射免疫分析药盒说明操作进行检测。
2.7.3 体外钙化能力 第3代MSCs以1×108cells/L接种于预先置有小盖玻片的6孔板中,共6组,每组3个复孔。处理同上,每孔终体积2.5 mL。每3 d换液1次,连续干预21 d。第21天将每组细胞弃培养液,PBS清洗后,95%乙醇固定30 min,再用0.1%茜素红染色30 min,清水冲洗。低倍镜(× 40)下进行钙化结节计数,每孔细胞随机计数10个视野的钙化结节数。
2.7.4 BMP-2释放量 分别取第3代MSCs各组诱导的细胞上清液,其中rhTGF-β1加药量为5 μg/L,加药3 d后取上清液,于7、14和21 d取细胞上清液,-20℃保存,样本收集齐后,分别按照Rat BMP-2 ELISA试剂盒说明进行检测。
2.7.5 对Smad4和Cbfa1 mRNA表达 采用荧光定量PCR技术检测诱导后各组细胞Smad4和Cbfa1 mRNA的表达:取第3代MSCs以1×108cells/L接种于6孔板,每组6个复孔,共6组。待细胞接种24 h后,换入无血清培养基,待细胞周期同步化24 h后加药,每3 d换液加药1次,连续干预7 d后采用Trizol法提取各组总RNA,按逆转录试剂盒说明程序进行反转录。引物设计和合成:根据GenBank注册的大鼠 β-actin、Smad4和 Cbfa1基因序列,利用软件Premier 5.0设计上述基因的荧光定量PCR引物,由上海英骏生物技术有限公司合成,设计引物序列(表1)。按照SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)说明,RT-PCR反应体系为:cDNA模板2.5 μL,ddH2O 8.0 μL,SYBR Green PCR Mix 12.5 μL,上游引物(10 mmol/L)0.5 μL,下游引物(10 mmol/L)0.5 μL,总体系为25.0 μL。反应条件为:95℃ 5 s,59℃ 30 s,30个循环,同时做55~95℃溶解曲线。
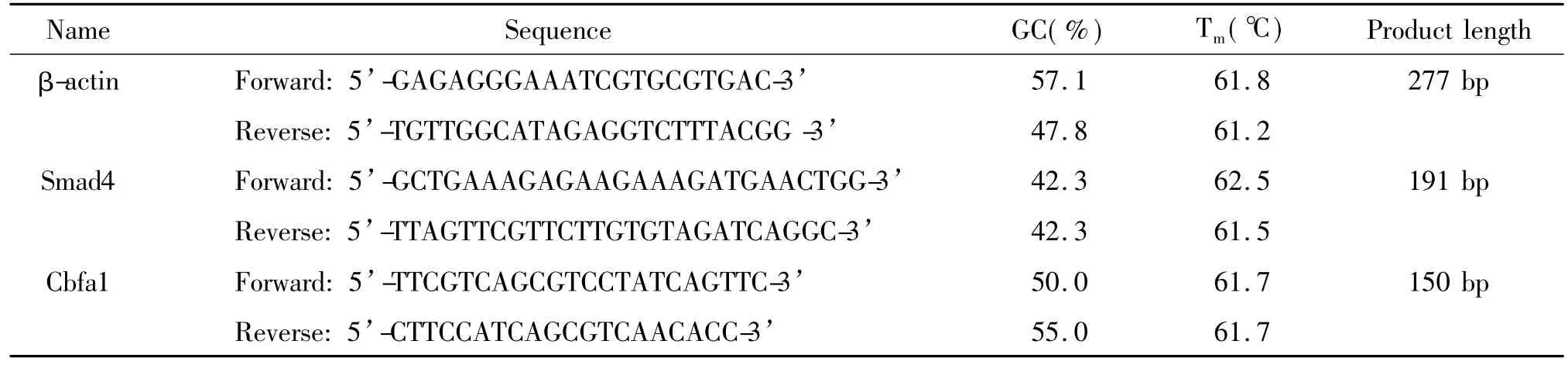
表1 β-actin、Smad4和Cbfa1引物序列Table 1.The primer sequences of β-actin,Smad4 and Cbfa1
3 统计学处理
采用SPSS 13.0统计软件处理,组间比较运用单因素方差分析,数据以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结果
1 rhTGF-β1促MSCs增殖的最佳浓度
不同浓度rhTGF-β1对大鼠MSCs增殖结果表明,10 μg/L rhTGF-β1A值高于对照组(P<0.05),其余各组与对照组比较无显著差异(P>0.05),见图1。

Figure 1.Effect of different concentrations of rhTGF-β1on the proliferation of MSCs.Mean±SD.n=8.*P<0.05 vs 0 μg/L.图1 不同浓度rhTGF-β1对大鼠MSCs增殖的影响
2 rhTGF-β1促MSCs骨向分化最佳浓度
2.1 ALP活性 ALP活性结果显示,5 μg/L rhTGF-β1组ALP活性高于对照组及其它浓度组(P<0.01),而其它浓度组与对照组比较无显著差异(P>0.05),同时,其它浓度组与5 μg/L rhTGF-β1比较,其ALP活性显著下降(P<0.01),说明7个浓度梯度中5 μg/L rhTGF-β1促MSCs分泌ALP能力最强,见图2。
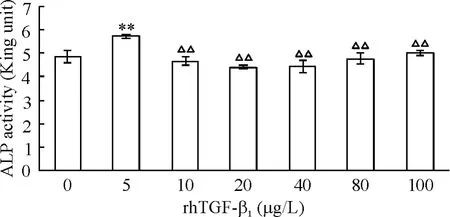
Figure 2.Effect of different concentrations of rhTGF-β1on ALP activity in MSCs.Mean±SD.n=8.**P<0.01 vs 0 μg/L;△△P<0.01 vs 5 μg/L.图2 不同浓度rhTGF-β1对ALP活性的影响
2.2 ALP染色 ALP染色阳性率的结果显示,各浓度rhTGF-β1均能提高ALP染色阳性率,其中以5 μg/L rhTGF-β1ALP染色阳性率最高(P<0.01),说明7个浓度梯度中5 μg/L rhTGF-β1促ALP阳性表达的能力最强,见图3。
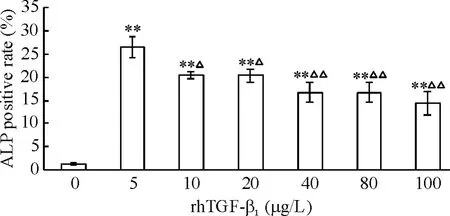
Figure 3.Effect on different concentrations of rhTGF-β1on the positive staining of ALP in MSCs.Mean±SD.n=8.**P<0.01 vs 0 μg/L;△P<0.05,△△P<0.01 vs 5 μg/L.图3 不同浓度rhTGF-β1对ALP染色阳性率的影响
3 rhTGF-β1对骨向分化指标的影响
3.1 ALP活性 ALP活性结果显示,3 d时C组、T组和T+C组的ALP值均显著高于N组(P<0.01); 7 d时T组的ALP活性高于N组(P<0.05);10 d时C组、T组和T+C组的ALP活性高于N组(P<0.05),其中T组最为明显(P<0.01);14 d时T组和T+C组的ALP活性高于N组(P<0.05),说明rhTGF-β1具有很好的促ALP分泌的功效,见表2。

表2 rhTGF-β1对ALP活性的影响Table 2.Effect of rhTGF-β1on activity of ALP(King unit.Mean±SD.n=6)
3.2 Col I水平 提取细胞培养上清液检测Col I含量,结果显示,7 d和14 d时C组和T组的Col I水平均高于N组,其中T组Col I水平高于N组和T+C组(P<0.01),但与C组比无显著差异;21 d时T组的Col I水平显著低于C组(P<0.01),说明rhTGF-β1对Col I的影响在早、中期具有很好的促进作用,见表3。
3.3 BGP水平 提取细胞上清液,检测BGP含量,结果显示,7 d时C组、T组和T+C组的BGP水平均显著高于N组(P<0.05);14 d时C组和T+C组的BGP水平均显著高于N组(P<0.05);21 d时C组和T组的BGP水平显著高于N组(P<0.05),见表4。

表3 rhTGF-β1对各组Col I表达量的影响Table 3.Effect of rhTGF-β1on ColⅠ expression(mg/L.Mean ±SD.n=4)
3.4 体外钙化能力 各组钙化结节图见图4。第21天检测各组钙化结节数结果显示,C组和T+C组钙化结节数目均高于N组(P<0.05),且T组钙化化结节数显著低于C组(P<0.05),见表5。
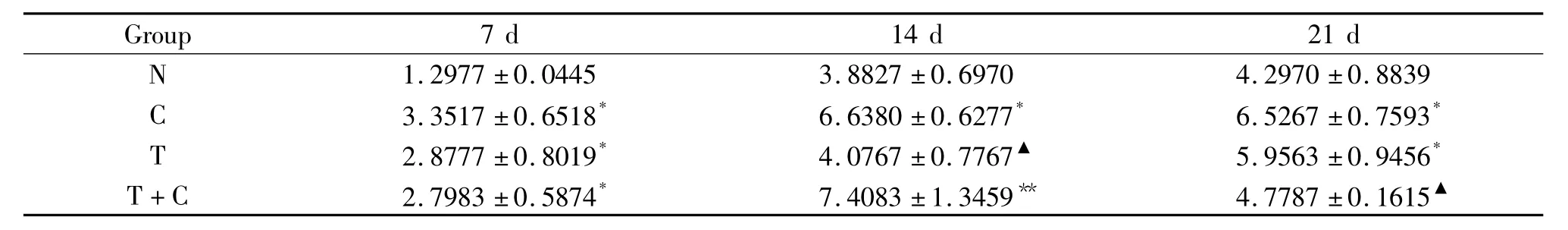
表4 rhTGF-β1对BGP释放量的影响Table 4.Effect of rhTGF-β1on BGP release(μg/L.Mean±SD.n=6)

Figure 4.Effect of rhTGF-β1on calcium nodes in MSCs of rats.A:N group(×200);B:C group(×100);C:T group(×100); D:T+C group(×100).图4 rhTGF-β1对大鼠MSCs钙化结节的影响
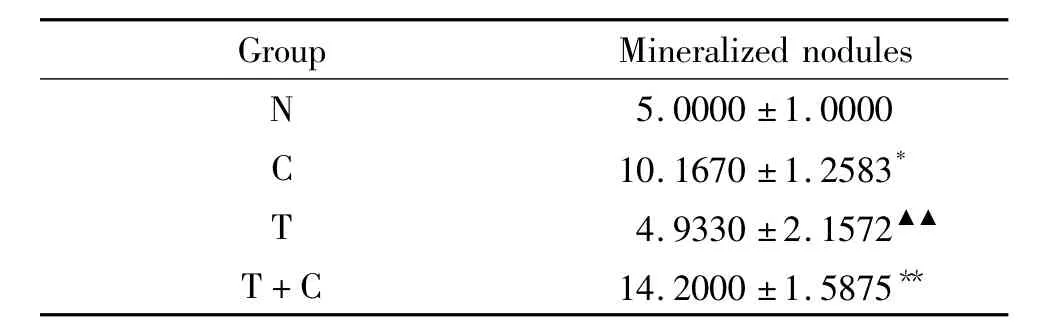
表5 rhTGF-β1对钙化结节数目的影响Table 5.Effect of rhTGF-β1on calcium nodes(Mean±SD.n=30)
4 rhTGF-β1对BMP-2释放的影响
BMP-2释放结果显示,7 d时C组、T组及T+C组的BMP-2水平均显著高于N组(P<0.01),其中T组和T+C组显著低于C组(P<0.01);14 d时C组、T组及T+C组的BMP-2水平显著高于N组(P<0.05);21 d时T组及C组的BMP-2水平显著高于N组(P<0.05),见表6。
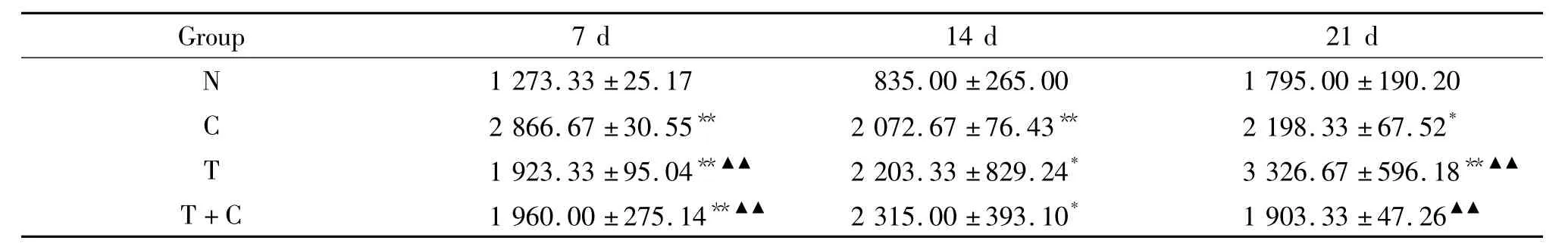
表6 rhTGF-β1诱导BMP-2的表达量Table 6.Effect of rhTGF-β1on BMP-2 expression(ng/L.Mean±SD.n=6)
*P<0.05,**P<0.01 vs N;▲▲P<0.01 vs C.
5 rhTGF-β1对Smad4和Cbfa1 mRNA表达的影响
5.1 rhTGF-β1对Smad4 mRNA表达的影响 第7天检测Smad4 mRNA表达的结果显示,C组、T组和T+C组的 Smad4 mRNA均显著高于 N组(P<0.05),其它组之间比较无显著差异(P>0.05),见图5。
5.2 rhTGF-β1对Cbfa1 mRNA表达的影响 第7天时Cbfa1 mRNA表达结果显示,C组、T组和T+C组的Cbfa1 mRNA的表达均显著高于N组(P<0.05),各诱导组之间比较无显示差异(P>0.05),见图6。
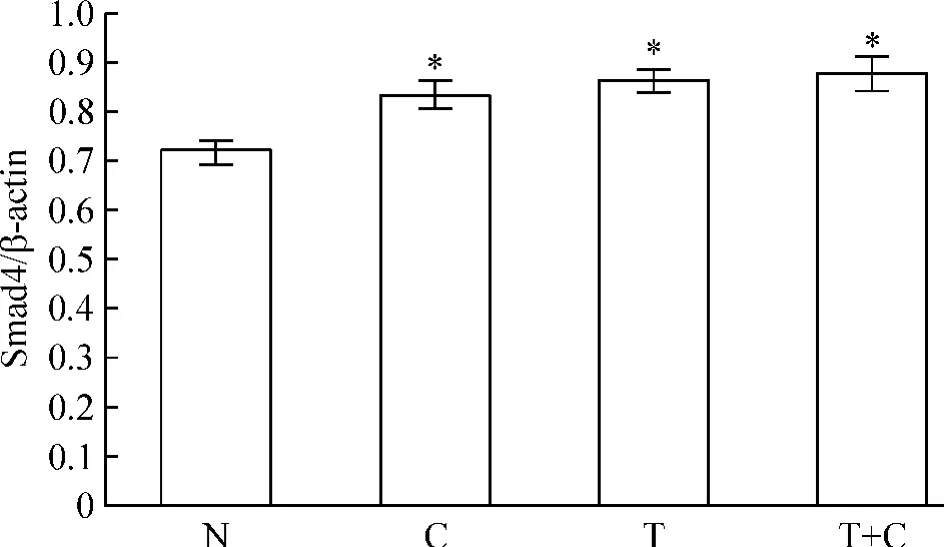
Figure 5.The expression of Smad4 mRNA in different groups.Mean±SD.n=4.*P<0.05 vs N.图5 各组Smad4 mRNA的表达
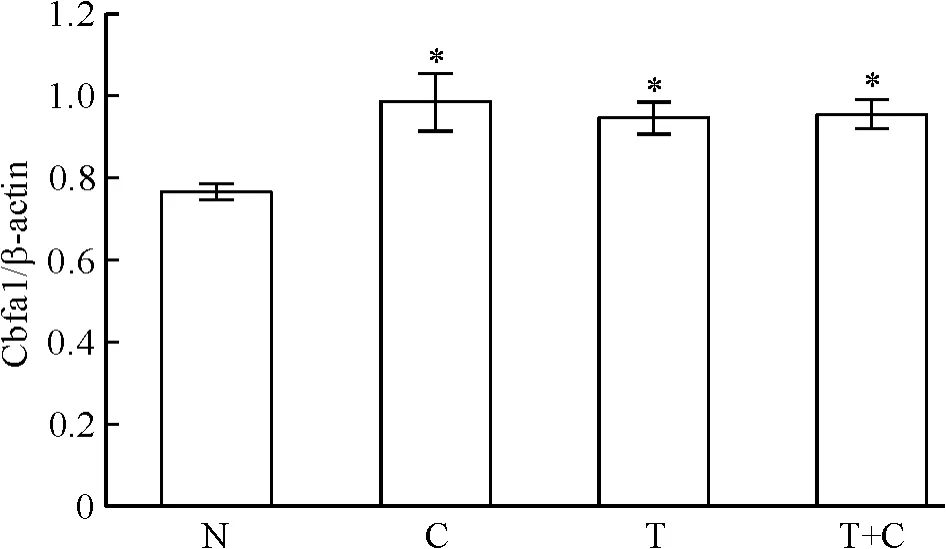
Figure 6.The expression of Cbfa1 mRNA in different groups.Mean±SD.n=4.*P<0.05 vs N.图6 各组Cbfa1 mRNA的表达
讨论
1 rhTGF-β1对MSCs骨向分化能力的影响
BMPs是TGF-β超家族中强有力的生长因子[2],其中BMP-2是目前已知的对骨形成作用很强的生长因子之一,是细胞外的骨基质成分,具有特殊生物学活性[3],主要通过增加ALP活性、BGP和胶原蛋白合成及分泌而发挥多种细胞促分化作用[4-5],体外研究表明,通过上调BMP-2可以促进BMSCs的成骨分化[6]。体内研究表明[7],BMP-2表达在去势大鼠局部显著降低,致使骨髓中许多可被BMP-2诱导成骨的基质干细胞的增殖分裂明显减少,骨小梁稀薄,认为体内BMP-2含量的减少是其重要病理过程之一。同时,BMP-2能促进MSCs骨向分化,在临床上已经作为提高骨愈合的辅助治疗[8-9]。研究表明,通过上调TGF-β1的表达,可以促进rBMSCs向成骨细胞分化[10]。本实验通过ALP活性和ALP染色对rhTGF-β1最佳促MSCs骨向分化浓度显示,5 μg/L rhTGF-β1具有最佳的促MSCs骨向分化作用,并以此浓度作为MSCs进行骨向分化干预浓度。
实验采用目前最为常用的成骨诱导培养液(含10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μmol/L维生素C、10%胎牛血清)为阳性对照。其中,地塞米松可提高ALP的表达,调节成骨细胞分泌胰岛素样生长因子,促进细胞外基质胶原的合成。β-甘油磷酸钠能提供磷酸根离子,作为ALP作用的底物,诱导和激活ALP,产生磷酸根离子,促进有机磷向无机磷转化,加速钙盐沉积;维生素C能够促进胶原合成和基质钙化,调节ALP活性及非胶原基质蛋白的合成。
rhTGF-β1对MSCs骨向分化能力研究显示,成骨诱导剂能促进ALP、Col I、BGP的表达和钙化结节的生成;rhTGF-β1在增加ALP和促Col I分泌方面效果显著,其中ALP活性高于成骨诱导剂,但在促进BGP分泌和钙化结节生成方面作用不明显;而rhTGF-β1+成骨诱导剂增加ALP活性、促Col I分泌能力虽不如rhTGF-β1,但其14 d促BGP分泌与钙化结节形成明显高于rhTGF-β1,说明rhTGF-β1具有很好的促MSCs骨向分化能力,尤其是早期、中期效果明显,而与成骨诱导剂联合使用后,对MSCs骨向分化的晚期效果更为显著,可能是rhTGF-β1与成骨诱导剂发生了一定相互作用。同时,成骨诱导剂、rhTGF-β1、rhTGF-β1+成骨诱导剂均能促进BMP-2的表达,说明rhTGF-β1具有很好的促进MSCs骨向分化能力。
2 rhTGF-β1对Smad4和Cbfa1 mRNA表达的影响
Smads分子是TGF-β超家族细胞因子在细胞内转导信息的通道,Smad4作为Smads的公共递质,作用在Smad家族成员中十分重要。Cbfa1是成骨细胞(osteoblasts,OB)分化和骨形成的关键调控因子,它作为Smad蛋白通路的下游因子,在OB分化过程中,通过调控OB特异性细胞外基质蛋白基因的表达和OB周期参与OB的分化过程,它是骨形成过程中最早和最具特异性的标志。在核内,Smad异聚体复合物在其它DNA结合蛋白的参与下作用于特异性靶基因,再转导至下游的Cbfal等转录调节因子,并进一步激活成骨基因的表达,调节 OB分化标志如ALP、BGP等的表达[11]。本实验研究结果显示,干预各组中Smad4和Cbfa1 mRNA的表达均高于空白组(P<0.05),各诱导组之间比较无显著差异(P>0.05),说明各诱导组可能通过上调Smad4,从而通过TGF-β超家族/Smad4信号通路,进一步促进Cbfal mRNA的表达,启动成骨基因,促进骨向分化指标ALP、BGP等的表达。
rhTGF-β1具有很好的促MSCs骨向分化能力,尤其是早期、中期效果明显,而与成骨诱导剂联合使用后,对MSCs骨向分化的晚期效果更为显著,可能是rhTGF-β1与成骨诱导剂产生了一定相互作用。同时,通过上调TGF-β超家族/Smads信号转导通路中Smad4以及Cbfa1 mRNA水平,对骨向分化起到了启动和促进作用。
[1]杨 丽,张荣华,谢厚杰,等.建立大鼠骨髓间充质干细胞稳定分离培养体系与鉴定[J].中国组织工程研究与临床康复,2009,13(6):1064-1068.
[2]Hogan BL.Bone morphogenetic proteins:multifunctional regulators of vertebrate development[J].Genes Dev,1996,10(13):1580-1594.
[3]Khan SN,Bostrom MP,Lane JM.Bone growth factors[J].Orthop Clin North Am,2000,31(3):375-388.
[4]Spinella-Jaegle S,Roman-Roman S,Faucheu C,et al.Opposite effects of bone morphogenetic protein-2 and transforming growth factor-β1on osteoblast differentiation[J].Bone,2001,29(4):323-330.
[5]Guicheux J,Lemonnier J,Ghayor C,et al.Activation of p38 mitogen-activated protein kinase and c-Jun-NH2-terminal kinase by BMP-2 and their implication in the stimulation of osteoblastic cell differentiation[J].J Bone Miner Res,2003,18(11):2060-2068.
[6]王 瑒,李 正,王小娜,等.雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞[J].中国病理生理杂志,2012,28(3):404-408.
[7] 张 勇,马 平,刘 健,等.去势大鼠骨中BMP-2、BMP-7基因表达[J].第四军医大学学报,2000,21 (1):125-126.
[8]Rutherford RB,Nussenbaum B,Krebsbach PH.Bone morphogenetic protein 7 ex vivo gene therapy[J].Drug News Perspect,2003,16(1):5-10.
[9]Marcacci M,Kon E,Moukhachev V,et al.Stem cells associated with macroporous bioceramics for long bone repair:6-to 7-year outcome of a pilot clinical study[J].Tissue Engineering,2007,13(5):947-955.
[10]王小娜,李 正,王 瑒,等.TGF-β1在雷奈酸锶促进大鼠骨髓间充质干细胞向成骨细胞分化中的作用[J].中国病理生理杂志,2011,27(12):2357-2361.
[11]徐小良,戴克戎,汤亭亭.Smads及其相关转录因子与骨形态发生蛋白诱导成骨的信号转导[J].中国修复重建外科杂志,2003,17(5): 359-362.
Effects of rhTGF-β1on proliferation and osteogenic differentiation of MSCs in SD rats
YIN Su-juan1,ZHANG Rong-hua1,ZHU Xiao-feng2,WANG Pan-pan2,YANG Li
(1College of pharmacy,2The First Affiliated Hospital,Jinan University,Guangzhou 510632,China.E-mail:doctormonkey @126.com)
AIM:To investigate the effects of recombinant human transforming growth factor β1(rhTGF-β1) on the ability of proliferation and osteogenic differentiation of rat bone marrow mesenchymal stem cells(MSCs),as well as its effects on the expression of bone morphogenetic protein 2(BMP-2),Smad4 and core binding factor α1(Cbfa1).METHODS:SD rat MSCs were isolated and purified by the differential time adherent method.MTT assay was used to confirm the optimal concentration of rhTGF-β1for the proliferation of MSCs.The optimal concentration for differentiation of MSCs into osteoblast was also determined by observing the activity and positive staining of alkaline phosphatase.According to the different induction conditions,MSCs were divided into 4 groups:control group,classic group,rhTGF-β1group,and rhTGF-β1+classic group.Alkaline phosphatase,type I collagen,bone Gla protein and calcium nodes were detected to evaluate the osteogenic differentiation.BMP-2 was detected by ELISA and the mRNA expression of Smad4 and Cbfa1 was analyzed by real-time quantitative PCR.RESULTS:The optimal concentrations of rhTGF-β1for the proliferation of MSCs and for the osteogenic differentiation of MSCs were 10 and 5 μg/L,respectively.The MSCs in classical group and rhTGF-β1group were promoted to osteogenic differentiation,and the mRNA expression of BMP-2,Smad4 and Cbfa1 was increased.rhTGF-β1induced osteogenic differentiation of MSCs in the early and middle terms.However,in rhTGF-β1+ classic group,the osteogenic differentiation of MSCs was more obvious in the late term.CONCLUSION:The inductionconditions of classical group,rhTGF-β1group and rhTGF-β1+classical group promote the differentiation of MSCs by increasing BMP-2 secretion and starting the TGF-β superfamily/Smads signaling pathway to regulate the differentiation of MSCs.
Bone marrow mesenchymal stem cells;Osteogenic differentiation;Transforming growth factors
R363
A
10.3969/j.issn.1000-4718.2014.03.014
1000-4718(2014)03-0460-07
2013-12-04
2014-01-07
国家自然科学基金资助项目(No.81173619);暨南大学科研培育与创新基金青年基金资助项目(No.21611323)
△通讯作者Tel:020-38374505;E-mail:doctormonkey@126.com

