老年冠心病与免疫炎症反应相关因素分析
李雪松
老年冠心病与免疫炎症反应相关因素分析
李雪松
(北京市昌平区医院内科,北京102200)
目的 本研究通过对老年冠心病(CHD)患者免疫炎症反应相关指标进行检测,以探讨免疫炎症反应与CHD的关系。方法 筛选本医院2008年7月至2012年9月的老年CHD患者108例,对照组为健康老年人68例。对T淋巴细胞CD3+及其亚群CD4+、CD8+、CD4+/CD8+和可溶性白细胞介素-2受体(sIL-2R)水平进行检测,测定IgG、IgA、IgM免疫球蛋白含量和补体C3和C4的水平,检测抗氧化修饰低密度脂蛋白(ox-LDL)抗体,并对超敏C反应蛋白(hs-CRP)和肿瘤坏死因子-α(TNF-α)两炎症因子水平进行检测。结果 老年CHD组活化T淋巴细胞及其亚群的活化比例均低于健康对照组(P<0.01);老年CHD组免疫球蛋白的含量显著高于健康对照组(P<0.01);老年CHD组补体C3和C4、ox-LDL抗体及sIL-2R水平均高于健康对照组(P<0.01);CHD组hs-CRP、TNF-α水平显著高于健康对照组(P<0.01)。结论 老年CHD患者存在细胞和体液免疫功能亢进,自身抗体增加,并处于高炎症状态,因此,免疫炎症指标可作为老年CHD的临床监测指标。
老年冠心病;免疫功能;免疫炎症反应
动脉粥样硬化是在高胆固醇血症条件下发生的炎症疾病,当前研究表明致动脉粥样硬化的脂蛋白粒子,如低密度脂蛋白和载脂蛋白B-封闭脂蛋白可跨过内皮细胞并聚集在内皮膜,可被氧化或酶促反应修饰,尽管脂蛋白修饰的确切机制仍有争议,但可以确定这些修饰后的脂蛋白引发了先天免疫反应,从而在动脉壁上产生炎症反应,先天性免疫是机体防御病原入侵和修饰的宿主腺体的第一防线,适应性免疫在病原入侵后数天产生,主要依靠同源细胞的表达,而先天性免疫反应则立即发生,先天性免疫主要有4个部分组成,可溶性介质如补体和自然抗体、上皮细胞、细胞吞噬作用及PRRs,近年相关研究表明,免疫损伤是As发生发展的主要机制之一,其作用也越来越受到研究者的重视,然而,其在As发生、发展及恶化直至斑块破裂的过程中的作用机理是复杂的[1]。As的病理过程发生在血管壁,病原微生物感染及免疫反应是As发生的初始环节,其特征为具有慢性炎症反应,是对各种原因所产生的损害的纤维增生反应,这一结论的正确性得到了临床、病理和基础方面的相关研究的证实[2]。在免疫反应中,补体系统、某些炎症、细胞和淋巴因子及细胞免疫和体液免疫等均与炎症过程有关,而且这一过程伴随As的始终[3]。越来越多的研究也表明,免疫炎症反应是导致As发生、发展及斑块不稳定性的重要因素[4],因而,As发生机制的焦点也已转向细胞、体液和自体免疫及补体系统等免疫反应的作用[5]。基于此,本研究通过对老年冠心病(CHD)患者免疫炎症反应相关指标进行检测,以探讨免疫炎症反应与CHD的关系,为免疫炎症指标用于诊断和评判老年CHD等临床应用方面提供可靠依据。
1 研究对象
1.1 病例诊断标准
CHD西医诊断标准依据第6版《内科学》[6]和《国际心脏病学会和协会及世界卫生组织临床命名标准化联合专题组报告—缺血性心脏病的命名及诊断标准》[7]。
1.2 病例纳入与排除标准
凡符合1.1所述标准且年龄在60-79岁之间的老年CHD患者;心电图检查有明显心肌缺血:经冠状动脉造影证实,或T波倒置,或两个肢体导联或相邻胸导联S-T段压低≥0.05mv,或运动试验阳性者纳入临床研究范围。
合并重度高血压及心律失常、重度心肺功能不全的患者、全身免疫性疾病、脑血管病或外周血管病、感染、恶性肿瘤、终末期疾病、严重肝肾功能不全、服用影响免疫功能的药物及病例研究资料不全的患者不在本研究范围。
1.3 一般资料
本研究纳入病例来自本院门诊及住院患者。病例采集时间自2008年7月至2012年9月。筛选符合本研究纳入病例标准的老年CHD患者108例为观察组,健康对照组为经全面检查后的健康老年人员68例,且其性别比例、年龄、体重指数(BMI)和吸烟史与观察组之间无显著性差异(P>0.05)。
表1 108例老年CHD患者的基本资料
2 观察指标及方法
老年CHD观察组和健康对照组均进行常规空腹采血,按照各指标的不同检测要求保存标本。
2.1 细胞免疫指标
采用美国贝克曼库尔特公司生产的MoFlo XDP型流式细胞仪,法国赛诺泰生物科技有限公司生产的单克隆抗体CD3-FITC、CD4-FITC和CD8-FITC,CD3+、CD4+、CD8+、CD4+/CD8+的测定采用直接荧光免疫标记法;ELISA法测定sIL-2R:sIL-2R测量试剂盒(F01270,上海研谨生物科技有限公司),酶标仪(SpectraMax M5,Molecular Devices),操作严格按照试剂盒说明书进行。
2.2 体液免疫指标
用速率散射免疫法测定IgG、IgA、IgM、C3、C4:全自动特种蛋白分析仪(普朗医疗器械公司,PA8800),N抗血清人免疫球蛋白A、M及G试剂、N抗血清人补体因子C3、C4试剂(德灵诊断产品有限公司)。
2.3 自体免疫指标
ELISA法测定抗ox-LDL抗体:酶标仪(同2.1),上海信然生物技术有限公生产抗ox-LDL抗体ELISA检测试剂盒,操作严格按照试剂盒说明书进行。
2.4 炎症因子指标
免疫比浊法测定血清hs-CRP浓度:全自动特种蛋白分析仪(同2.2)及英国RANDOX Laboratories有限公司生产的hs-CRP免疫比浊法试剂盒;放射免疫法测定血清TNF-α浓度:微机多探头γ计数仪(BH1-FT603G,北京核仪器厂),TNF-α放免测量试剂盒购于上海酶联生物科技有限公司。操作严格按照试剂盒说明书进行。
3 统计方法
数据采用SPSS 14.0统计分析软件处理,计量资料数据用(_x±s)表示,两样本比较采用t检验,统计检验值P<0.05被认为所检验的差别有统计学意义。
4 结果
4.1 细胞免疫指标比较
老年CHD观察组和健康对照组T淋巴细胞及其亚群活化比例和sIL-2R水平见表2。前者活化T淋巴细胞CD3+比例显著高于后者(P<0.01);前者活化T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+比例也显著高于后者(P<0.01);前者sIL-2R水平显著高于后者(P<0.01)。因此,说明老年CHD患者的细胞免疫功能亢进。
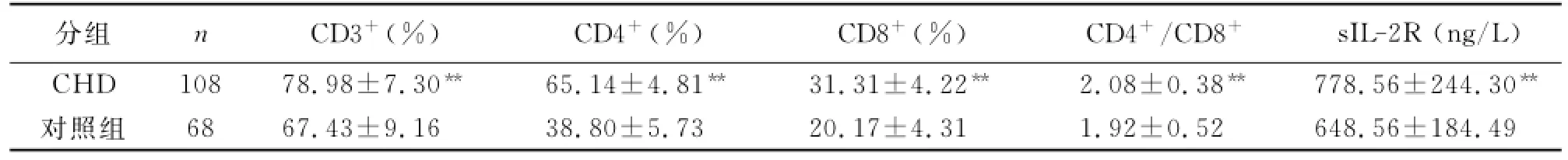
表2 两组细胞免疫指标水平比较(_x±s)
4.2 体液免疫指标比较
老年CHD观察组与健康对照组免疫球蛋白IgG、IgA、IgM含量和补体C3、C4水平的比较见表3。前者各免疫球蛋白含量和补体C3、C4水平均显著高于后者(P<0.01),因此,说明老年CHD患者的体液免疫功能亢进。

表3 两组免疫球蛋白IgG、IgA、IgM含量和补体C3、C4水平(_x±s)
4.3 自体免疫指标比较
老年CHD观察组与健康对照组抗ox-LDL抗体水平的比较见表4。前者抗ox-LDL抗体水平显著高于后者(P<0.05)。因此,说明老年CHD患者存在自身抗体水平升高。

表4 两组自体免疫指标水平比较(_x±s)
4.4 炎症因子hs-CRP、TNF-α水平比较
老年CHD观察组与健康对照组hs-CRP、TNF-α的水平见表5。前者hs-CRP、TNF-α水平均显著高于后者(P<0.01)。因此,说明老年CHD患者存在或处于高炎症状态。

表5 两组hs-CRP、TNF-α水平(_x±s)
5 讨论
巨噬细胞和淋巴细胞浸润是动脉粥样硬化(As)的基本病理改变之一。在人类As的不同时期均有发生,虽有少许的B淋巴细胞,但以T淋巴细胞为主[8]。T淋巴细胞在As中的所起的作用尚不明确,但T细胞免疫反应的最终是促使As发生的。As斑块中的T淋巴细胞主要为CD4+,疾病早期T淋巴细胞含量比晚期要少,呈散在分布。本研究中可以看出老年CHD患者T淋巴细胞增加显著,且部分被激活,而活化状态下的T淋巴细胞激活巨噬细胞并促进炎症的发生有赖于自身分泌细胞因子及表面抗原和受体的表达,从而促使As进行性发展。mIL-2R与sIL-2R竞争性结合IL-2,sIL-2R可使活化T细胞周围的IL-2中和,受IL-2/IL-2R调节的生物学反应被封闭,T细胞的增殖也就受到抑制,基于其在心血管疾病发生和发展中的重要性,对阐明老年CHD发病的相关免疫机理具有重要的参考价值。
研究表明,在As斑块中存在大量的巨噬细胞,其在免疫反应和炎症中起重要作用。另外,外源性抗原经巨噬细胞处理并将其片段和主要组织相容性复合物呈递于T淋巴细胞,然后诱发T淋巴细胞激活、细胞毒性作用、细胞因子分泌、B细胞抗体产生,抗原由巨噬细胞处理时,还能高表达清道夫受体,吞噬ox-LDL,As斑块上一种主要的自身抗原就是ox-LDL,能促使机体对修饰后的产物发生反应[9]。通过将分离克隆人体As斑块内的T细胞并鉴定发现,25%的CD4+T细胞可对ox-LDL进行识别,因此ox-LDL是As细胞免疫反应中主要的自身抗原。分析As斑块中的免疫球蛋白的抗体发现As斑块中的IgG含有抗ox-LDL的抗体[10]。因此,在As斑块内中ox-LDL作为自身抗原,可诱发体液和细胞免疫反应。
补体系统系由多样的血浆蛋白成分组成,是体液免疫的一部分,活化补体系统可导致级联反应产生,从而产生不同种类的促炎因子,其在As的发病过程中也发挥着重要作用,研究显示,活化补体可能是As斑块沉积并导致病变的纽带[11]。
As的实质是一种炎症增生的慢性疾病,其标志物CRP与As关系密切,不但能够参与As疾病各阶段的发生,而且还能促进As的进一步发展。由于巨噬细胞产生活性氧自由基可受到CRP的影响,因而CRP亦能够促进ox-LDL的产生,巨噬细胞通过清道夫受体识别ox-LDL,吞噬后转化为泡沫细胞,泡沫细胞是AS斑块中一含脂类细胞,而巨噬细胞源泡沫细胞又是斑块中泡沫细胞的主要成分,大量研究显示,ox-LDL对巨噬泡沫细胞的形成具有重要作用。CRP可络合产生多种复合物,诸如CRP和C多糖络合及CRP与磷脂络合所产生的络合物可激活补体,再经补体系统间接清除外来细胞或分子,不但能够杀死或清除病原微生物,还可增强机体细胞尤其是白细胞的吞噬作用等,从而达到清除各种病原微的目的。TNF-α是一种主要由巨噬细胞和单核细胞分泌产生的细胞因子炎性介质,并能够参与正常炎症及免疫反应,在炎症反应中的可增加内皮细胞粘附分子表达,增加血小板活化因子的合成,从而促进血小板活化。
综上,通过对括细胞、体液和自体免疫、补体系统及炎症因子在内的免疫应答反应在As中的机制进行系统、全面地探讨,从中不难发现本研究中老年CHD患者存在着免疫功能紊乱,因此,免疫炎症指标可作为老年CHD的临床监测指标。
[1]杨水祥,陈利平,孙海云.现代自身免疫病学[M].北京:人民卫生出版社,1995:396.
[2]Shah P.K.Plaqe disraption and thrombosis:potential role of inflammaton and infection[J].Cardiol Clin,1999,17:270.
[3]Libby P.Inflammation in atherosclerosis[J].Nature,2002,420:868.
[4]Hansson G.K.Immune Mechamisms in Atherosclerosis[J].Arterioscler Thromb Vasc Biol,2001,21:1876.
[5]Hansson G.K,Lihhv P,Schonhcck U,et al.Innate and adaptive immunity in the pathogenesis of athcrosclcrosis[J].Circ Res,2002,91:281.
[6]陈灏珠.动脉粥样硬化和冠状动脉粥样硬化性心脏病 [M].内科学,北京:人民卫生出版社,2004:272-273.
[7]缺血性心脏病的命名及诊断标准—国际心脏病学会和协会及世界卫生组织临床命名标准化联合专题组的报告 [J].中华内科杂志,1981,20:254.
[8]Benjamin Erickson MD,Kirk Sperber MD,William H.Frishman,et al.Toll-Like Receptors New Therapeutic Targets for the Treatment of Atherosclerosis,Acute Coronary Syndromes,and Myocardial Failure[J].Cardiology in Review,2008,16(6):273.
[9]Christoph J Binder,Mi-Kyung Chang,Peter X Shaw,et al.Innate and acquired immunity in atherosclerosis[J].Natur Medicine,2002,8(11):1218.
[10]Kathryn J.Moore,Mason W.Freeman.Targeting innate immunity for CV benefit[J].Drug Discovery Today:Therapeutic Strategies,2008,5(1):15.
[11]董为人,田雪梅,安靓等.补体活化在动脉粥样硬化形成中的意义[J].国外医学免疫学分册,1999,22(1):52.
R541.4
A
李雪松(1971-),男,北京人,大学专科,主治医师,主要从事心血管病的预防与研究。
2013-02-26)
1007-4287(2014)02-0239-04

