一种光化学损伤诱导的三叉神经痛大鼠模型的建立
崔 悦,赵 佳,王 晔,孙丹丹,张 莹,刘 洋,赵小亮,牛晓红,张美玉,王丹巧,高天乐,徐晓军
(1.吉林大学基础医学院,吉林长春 130021;2.中国中医科学院医学实验中心,北京 100700;3.卡罗林斯卡医学院,斯德哥尔摩瑞典 14186)
三叉神经痛(trigeminal neuralgia,TN)是指在三叉神经分布区域内出现的反复发作、短暂、剧烈的疼痛[1]。因其不断增长的发病率和缺乏有效的治疗方法,成为临床治疗的难题。由于TN的病因复杂,发病机制尚不明确,临床前动物实验与临床实际情况差距较大,需进一步研究和探索,因此,建立与临床症状、病理、生化机制及药物反应吻合性较好的动物模型至关重要。近年来,国内外常用三叉神经末梢、神经干、神经根、神经节、神经核等慢性损伤的方法制造TN动物模型,其中慢性缩窄环模型[2]因较好地模拟了TN血管压迫学说,被广泛应用于基础性研究。
本实验参考瑞典卡罗林斯卡医学院 Hao等[3]和Dominguez等[4]的方法,采用赤藓红 B静脉注射加激光照射,以模拟三叉神经微循环障碍、神经纤维脱髓鞘的病理机制,制作光化学损伤诱导的TN(photochemically-induced trigeminal neuralgia,PITN)大鼠模型。观察其神经支配颜面部位的机械痛阈变化,检测其外周神经系统三叉神经节内Tac1mRNA表达量及中枢神经系统脑纹状体细胞外液中Glu浓度(前者为编码致痛的P物质前体的基因[5-7],后者为兴奋性氨基酸、重要的疼痛相关递质[8]),并观察临床常用镇痛药物加巴喷丁对其的影响,为PITN大鼠模型的建立及应用提供依据。
1 材料与方法
1.1 实验动物由北京维通利华实验动物技术有限公司提供SD大鼠,♂,体质量180-250 g,动物许可证编号为SCXK(京)2006-0009。
1.2 药品、试剂与仪器Glu、乙酸钠、Erythrosin B(赤藓红B)、硼酸、庚烷硫酸钠购于Sigma公司。邻苯二甲醛(OPA)购于Aldrich公司。甲醇购于 Fisher Chemicals公司。EDTA、KH2PO4为北京化工厂生产。加巴喷丁胶囊(gabapentin capsules)购于江苏恒瑞医药股份有限公司,批号为12031291No.107。SYBR®Premix Ex TaqTMⅡ试剂盒购于日本TaKaRa公司,RNA提取试剂盒、cDNA合成试剂盒及引物均由北京旷博生物技术有限责任公司提供。
大鼠脑立体定位仪、颅钻购于深圳瑞沃德公司。51000-20C Von Frey hairs疼痛测试包购于美国Danmic公司。氩离子激光器系统的主要部分D-35037 SA11118972氩离子激光发生器为德国Sacher Lasertechnik集团生产。微透析系统由美国Instech公司出品的五通转环清醒活动装置、瑞典CMA公司生产的透析膜长度为4 mm的 CMA/12探针及套管、CMA/470低温样品自动收集器、CMA/402微量泵组成。高效液相色谱(HPLC)系统由Aglient1200、G1321A化学工作站、荧光检测器组成。荧光定量PCR设备7900HT购于美国ABI公司。
1.3 PITN大鼠模型的建立、实验分组及行为学测评大鼠适应性饲养后,用Von Frey hairs对其三叉神经支配的面部触须垫进行每日连续5次的刺激,直到大鼠对以上刺激反应平静。筛选出连续3 d痛阈值≥26 g的动物57只,随机分为假手术对照组(n=6)和 TN手术组(n=51)。腹腔注射10%水合氯醛(350 mg·kg-1)麻醉,手术组在动物触须垫上方眶下孔位置横向剪开长度约1 cm的切口,钝性分离局部肌肉,暴露出深部的眶下神经(三叉神经上颌支的终支),将神经束挑出,并于右侧颈静脉插入导管,注入赤藓红B 0.3 m l(32.5 mg·kg-1,溶解于 0.9%的生理盐水),立即将大鼠置于功率344 mW,波长458-514 nm的氩离子激光器下,使光斑准确照射暴露的眶下神经13 min(由于赤藓红B在体内的半衰期短,需每5 min经静脉补充注射0.4 m l,直至照射结束)。缝合颜面部及颈部伤口,常规注射庆大霉素预防感染。假手术对照组大鼠暴露、剥离眶下神经后即缝合。术后d 7开始用质量单位由小至大的Von Frey hairs对动物术侧触须垫部位进行刺激,评价方法参照1999年Juhana等[9]的标准,将大鼠安置于鼠笼中,待其适应周围环境后对其进行测评,连续刺激5次,每次时间间隔≥1 s,将连续测评5次中出现3次搔抓、躲避、攻击行为中的一项或一项以上阳性反应的最小值视为三叉神经支配的颜面区域机械痛阈值。连续3 d测得痛阈值≤4 g的动物视为造模成功。术后d 10,随机抽取模型动物12只,分为模型组(与假手术对照组相同,投与等量生理盐水)和加巴喷丁组(100 mg·kg-1),每组6只,记录投药前(0 min)、投药后30、60 min的机械痛阈值。另取成模大鼠10只,每3 d测量机械痛阈值,观察至术后d 60。
1.4 三叉神经节内Tac1m RNA的检测3组实验动物于给药1 h后,麻醉下,取出患侧三叉神经节并迅速放入液氮保存。
将上述组织复温后按照QuantoBio RNA提取试剂盒要求进行Total RNA的提取,测量Total RNA的浓度及260/280,符合标准后用QuantoBio cDNA合成试剂盒进行cDNA的合 成。Tac1上 游 引 物 序 列 为 5′-GGGCATGGTCAGATCTCTCACAA-3′,下 游 引 物 序 列 为 5′-TTATTTTACCGCTCACTGCTCGC-3′,扩增片段长度为191,以 cDNA为模板,β-actin为内参,反应体系:2×qPCR Mix 10μl,Primer-F(10 nmol·L-1)及 Primer-R(10 nmol·L-1)各 2μl,模板cDNA 10μg,以去离子水补足20μl体系。40循环反应参数:95℃孵育5 min,95℃孵育15 s,58℃孵育45 s,反应结束后,软件自动分析荧光信号并将其转换为各目的基因的起始拷贝数和Ct值,同时检测内参基因β-actin表达以控制样本间mRNA质量的变异。相对定量方法:根据扩增曲线设定循环阈值(cycle threshold,CT),以 ΔCT(目的基因CT值 -内参基因CT值)比较各组间Tac1基因表达差异。ΔCT值与目的基因起始拷贝数呈负相关。
1.5 纹状体细胞外液的取样及G lu的检测给药测评结束后,大鼠在麻醉下,于右侧纹状体(A:+0.2 mm,L:+3.0 mm,V:-7.5 mm)埋植并固定微透析探针套管,次日在清醒状态下插入微透析探针,并安置于清醒自由活动装置中,进行活体脑内微透析采样。高效液相-柱前OPA衍生-荧光法检测样品中 Glu水平[10]。
1.6 统计学处理计量资料用±s表示,应用统计软件SPSS 17.0对数据进行统计学处理,两样本比较采用t检验;同一时间点多组间的比较采用多元方差分析。
2 结果
2.1 光化学诱导的TN模型大鼠的行为学改变与假手术对照组比较,模型组大鼠术后表现为迅速抓咬刺激物、后退、蜷缩身体靠向笼壁、连续搔抓受刺激部位。于术后d 7模型组51只大鼠均出现了不同程度的三叉神经支配的颜面部机械阈值下降,持续3 d小于4 g的大鼠为32只,模型成功率为63%。成模大鼠手术后d 7、8、9连续3 d测量均值与术前对照,痛阈值由26降低为(1.60±1.74)g(P<0.01,n=32),假手术对照组由26 g降低为(25.39±1.06)g(n=6),无明显差异,见Fig 1。加巴喷丁投药后30、60 min可以有效缓解疼痛,明显提高机械痛域值,见Fig 2。另外用于模型稳定性观察的10只动物在术后d 7-60内机械阈值稳定在(0.71±1.24)g(n=10)。未见疼痛恢复迹象,见 Fig 3。
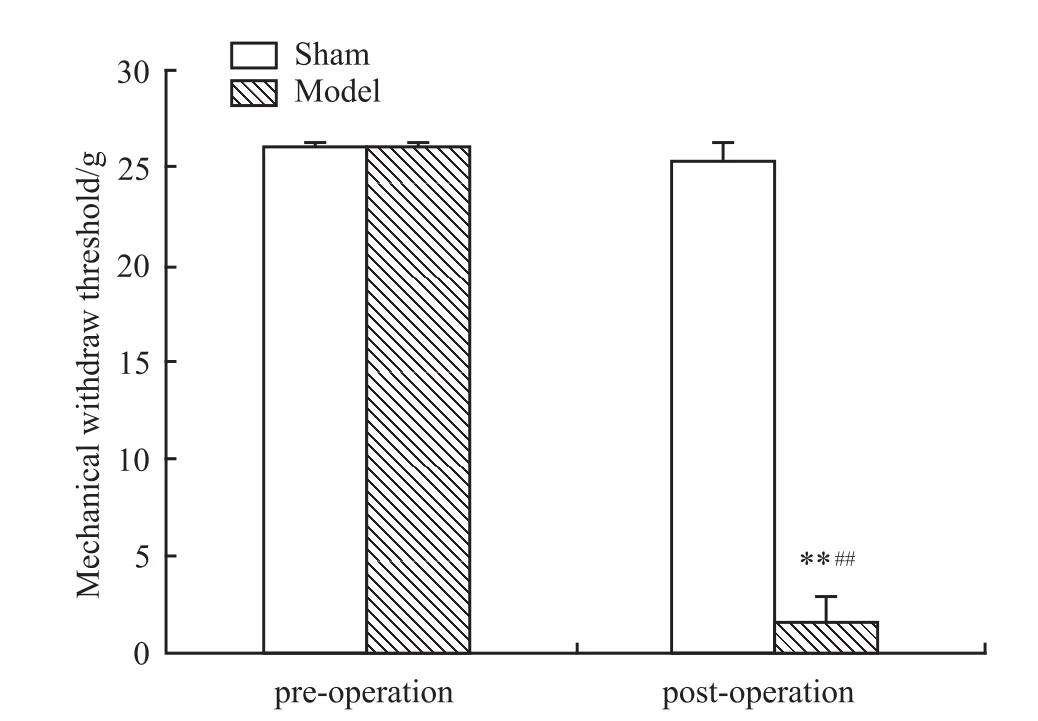
Fig 1 Changes ofmechanicalwithdraw threshold of PITN rats(sham:n=6;model:n=32)
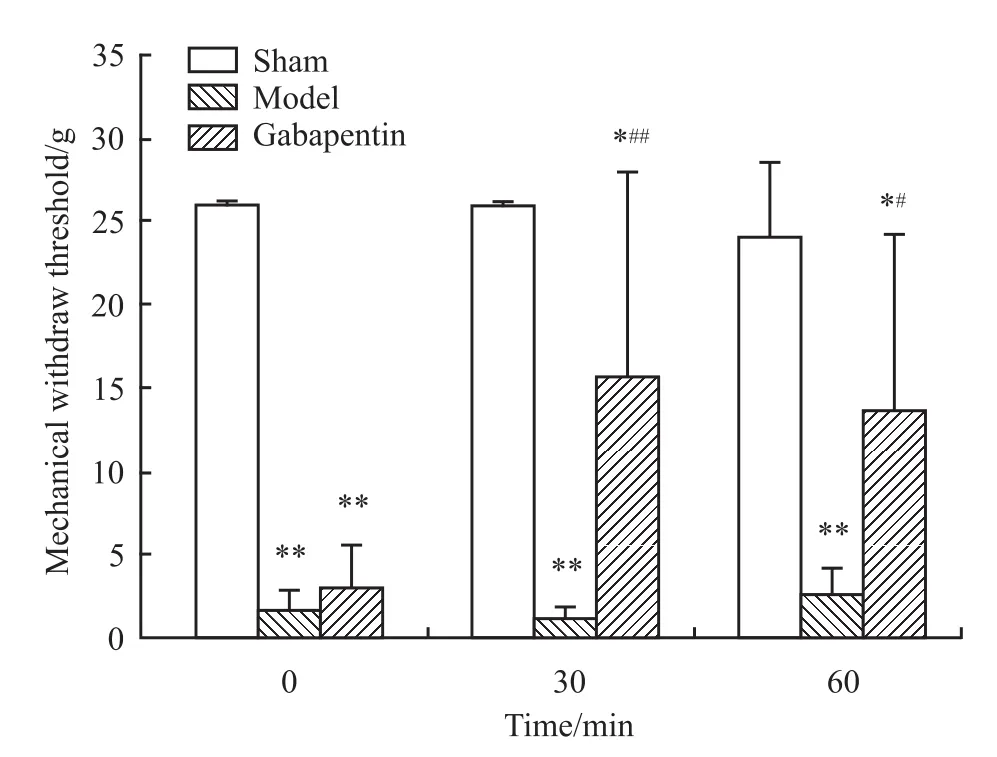
Fig 2 Effect of gabapentin on mechanicalwithdraw threshold of PITN rats(±s,n=6)
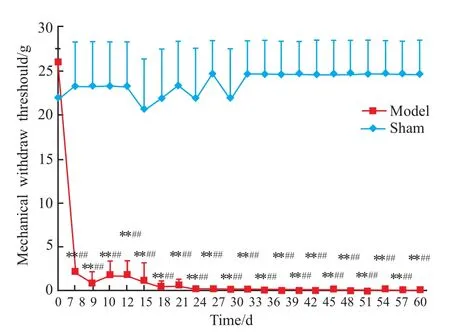
Fig 3 Dynam icmonitoring ofmechanical withdraw threshold of PITN rats(sham:n=8;model:n=10)
2.2 TN模型大鼠三叉神经节中Tac1基因mRNA表达量的变化实时荧光定量PCR技术检测三叉神经节内Tac1 mRNA表达量结果显示:模型组与假手术对照组相比其表达量明显上调(P<0.05),加巴喷丁抑制了造模引起的表达量上调,具有统计学意义(P<0.05),见Tab 1。
2.3 TN模型大鼠纹状体细胞外液中G lu水平的变化与假手术对照组相比,模型组纹状体细胞外液中与疼痛密切相关的兴奋性氨基酸Glu的含量明显升高(P<0.05),加巴喷丁对升高的Glu浓度显示了抑制作用,给药后60 min脑内Glu含量迅速降低(P<0.05),见Tab 1。
Tab 1 Tac1 mRNA expression in trigem inal ganglia and the G lu concentration in the striatum of TN rats(±s,n=6)

Tab 1 Tac1 mRNA expression in trigem inal ganglia and the G lu concentration in the striatum of TN rats(±s,n=6)
*P<0.05 vs sham;#P<0.05 vs model
Group Tac1 mRNA(ΔCT) Glu/μmol·L-1 Sham 2.78±0.58 3.02±5.68 Model 1.92±0.34* 56.28±55.99*Gabapentin 2.58±0.2# 17.01±22.84#
3 讨论
原发性TN的发病机制至今尚不明确,能够被广泛接受并形成共识的是三叉神经脱髓鞘。髓鞘脱失的神经纤维与邻近无髓鞘神经纤维之间发生“短路”,轻微的触觉即可因“短路”将神经冲动快速传输至中枢神经系统,中枢的传出冲动也可经“短路”转变为传入神经冲动,如此反复累积叠加可迅速达到阈值,爆发TN的痛觉过敏或痛觉超敏[11]。
引起脱髓鞘主要原因是三叉神经感觉根在入脑桥区受到血管的压迫及神经内微循环障碍、髓鞘营养代谢紊乱。有学者在电镜下观察到Schwann细胞水肿、变性坏死及线粒体空化/坏死/崩解的现象[12],支持脱髓鞘由神经纤维缺血、缺氧引起的观点。关于微循环障碍致神经纤维脱髓鞘的病理过程,多数认为首先是慢性缺血,然后是血-神经屏障改变,最后导致神经脱髓鞘。在这一过程中,神经内的巨噬细胞、肥大细胞、血管内皮细胞介导的细胞免疫反应以及P物质(SP)、Glu、降钙素基因相关肽、β-内啡肽、血管活性肠多肽等神经肽类物质均有参与,并发挥着重要作用。
目前,国内外常用的TN动物模型有慢性缩窄环模型[13]、三叉神经根埋植模型[14]、牙髓灌注模型[15]、暴露三叉神经节模型、暴露三叉神经根模型[16]等;也有人将青霉素等注射至大鼠的蛛网膜下腔[17],或直接注射于大鼠三叉神经脊束核[18]等,观察动物的行为及丘脑、皮层的电生理指标等变化。上述模型主要是在三叉神经周围或中枢施加刺激以模拟TN的部分病理机制和症状。但是手术方法复杂不易掌握、破坏脑组织过多引起共济失调、或大量出血致死;或术后动物存活率不高、状态不佳,影响行为学的观察等是其存在的缺点。即使被广泛应用的慢性缩窄环模型也存在一定问题:神经结扎的松紧程度没有客观定量,易随操作者的力度而变化,导致个体间脱髓鞘病变程度的差异,且结扎所用铬线可能带来神经毒性等,均会间接影响实验的结果。
本实验参考瑞典卡罗林斯卡医学院的造模方法,采用定量的赤藓红B静脉注射加一定波长和功率的激光照射方法诱发TN。上述学者的前期研究已经证实:赤藓红B作为一种光敏剂,静脉注射后迅速分布于全身毛细血管,因其代谢迅速,半衰期只有5 min,不易引起机体损伤,但在激光照射下则发生光化学反应,其结果会导致照射局部血管内皮细胞水肿、损伤,引起血小板活化、聚集,同纤维蛋白一起形成血栓,局部组织发生微循环障碍、缺血性坏死,进而引起神经纤维脱髓鞘的病理改变[19]。Kupers等[20]用光化学损伤诱发大鼠坐骨神经微循环障碍,观察到神经纤维发生脱髓鞘改变。三叉神经内血供丰富,光化学损伤诱导了局部微循环障碍、髓鞘营养代谢紊乱、导致TN的基础病变-神经脱髓鞘病变,引起慢性神经病理性疼痛症状。另有研究显示,三叉神经节内有丰富的SP阳性神经元,其中枢突达三叉神经感觉核,脱髓鞘发生后,突触前膜去极化,Ca2+内流,囊泡膜与突触前膜融合释放SP,经突触后膜NK1受体,介导疼痛信息的传递,并由此产生正反馈作用形成链式反应,结果使突触前膜释放更多的神经肽及神经递质,进一步增强其兴奋性[21-22]。SP引起的异常冲动可快速诱发脑部中枢神经系统兴奋性增强,释放大量兴奋性氨基酸Glu,与突触后膜上的促离子型受体结合,增加对Na+、K+的通透性,继而引起细胞内Ca2+浓度升高、相关蛋白激酶激活、NO等伤害性信息传递介质生成和c-fos基因表达等一系列级联反应[8],进一步加快兴奋性信息传递,产生神经病理性疼痛。本课题组的前期研究显示:坐骨神经部分损伤[23]和切口痛[24]模型大鼠随着机械痛敏和冷痛敏的产生,其纹状体细胞外液Glu、脊髓和脑脊液中SP含量明显增加。上述研究均提示,SP、Glu参与了TN等神经源性疼痛时痛觉过敏或痛觉超敏的产生和维持。
本实验系统观察了光化学损伤三叉神经后,大鼠相应部位7~60 d疼痛行为学的动态变化:其疼痛敏感程度与临床TN符合,成模时间仅为1周,成功率可达63%,模型稳定,在观察的2个月内未见恢复迹象,模型重复性较好、个体差异小、动物成活率在90%以上,且对临床有效药物加巴喷丁反应敏感。由于该方法导致的神经损伤和疼痛行为学改变的程度可随光敏剂用量和激光照射时间调节,会更加灵活、方便使用。
该模型在病因、病理机制和发病过程上较好地模拟了TN微循环障碍和神经纤维脱髓鞘改变,符合TN等神经源性疼痛中相关调质/递质的变化规律:外周神经系统(三叉神经节)内编码SP前体的基因Tac1mRNA表达量随疼痛的产生和维持而上调,中枢神经系统(脑纹状体细胞外液)中重要的疼痛相关递质Glu浓度随疼痛的产生和维持而升高。临床有效镇痛药物加巴喷丁对该模型发挥了明显的镇痛作用,表明该模型与TN的临床治疗效果有较好的吻合性。尽管本模型也存在一定的缺点与限制:实验所必需的氩激光发射器价格较昂贵、占用实验室空间较大;多次静脉注射及分离神经而较少伤害周围组织及血管,需要操作精准、实验技术熟练等,但可以说对于TN的基础研究和药物筛选是可选择的较好模型。此外,该方法也为缺血性神经纤维脱髓鞘引起的其它外周神经性疾病(如缺血性视盘病、血栓闭塞性脉管炎、福尔克曼氏挛缩、胫前综合征等)动物模型的制作提供了参考。
参考文献:
[1]王 福,张奎启,裘 罡.三叉神经痛的病因和发病机制学研究的进展[J].大连医科大学学报,2004,26(4):307-10.
[1]Wang F,Zhang K Q,Qiu G.Progress about pathogenesis of trigeminal neuralgia[J].JDalian Med Univ,2004,26(4):307-10.
[2]Strittmatter M,Grauer M,Isenberg E,et al.Cerebrospinal fluid neuropeptides and monoaminergic transmitters in patients with trigeminal neuralgia[J].JHeadache,1997,37(4):211-6.
[3]Hao JX,Stohr T,Selve N,et al.Lacosamide;a new anti-epileptic,alleviates neuropathic pain-like behaviors in ratmodels of spinal cord or trigeminal nerve injury[J].Eur J Pharmacol,2006,553(1-3):135-40.
[4]Dominguez C A,Kouya P F,Wu W P,et al.Sex differences in the development of localized and spreadmechanical hypersensitivity in rats after injury to the infraorbital or sciatic nerves to creat a model for neuropathic pain[J].Gend Med,2009,2:225-34.
[5]吴饶平,熊 伟,高 云.三叉神经痛的分子发病机制的研究进展[J].中国药理学通报,2011,27(11):1487-90.
[5]Wu R P,Xiong W,Gao Y.Progresson molecular pathogenesis of trigeminal neuralgia[J].Chin Pharmacol Bull,2011,27(11):1487-90.
[6]Sun R Q,Tu Y J,Lawand N B,et al.Calcitoningene-related peptide receptoractivation produces PKA-and PKC-dependentmechanical hyperalgesia and central sensitization[J].J Neurophysiol,2004,92(5):2859-66.
[7]赵云富,姜晓忠,刘 渊,等.神经肽与三叉神经痛发病关系的临床研究[J].实用口腔医学杂志,2002,18(1):71-4.
[7]Zhao Y F,Jiang X Z,Liu Y,et al.Clinical investigation of neuropeptides in patientswith trigeminal neuralgia[J].JPract Stomatol,2002,18(1):71-4.
[8]黄云巧,杨建明,陈国强.谷氨酸与慢性疼痛[J].昆明医学院学报,2007,28(2B):117-21.
[8]Huang Y Q,Yang JM,Chen G Q.Glutamate and chronic Pain[J].JKunming Med Coll,2007,28(2B):117-21.
[9]Juhana J,Heikkila,Guilbaud G.Phamacological studies on a rat model of trigeminal neuropathic pain:baclofen,but not carbamazepine,morphine or tricyclic antidepressants,attenuate the allodynia-like behaviour[J].Pain,1999,79(2-3):281-90.
[10]王 晔,王丹巧,崔 悦,等.CQM对三叉神经痛模型大鼠镇痛效应及其对脑内兴奋性氨基酸递质的影响[J].中国中药杂志,2013,38(20):3354-9.
[10]Wang Y,Wang D Q,Cui Y,etal.The effectsof CQM on analgesia and exciting amino acid neurotransmitters in the brains of IoN injury ratmodels[J].China JChin Mater Med,2013,38(20):3354-9.
[11]Love S,Coakham H B.Trigeminal neuralgia:pathology and pathogenesis[J].Brain,2001,124(12):2349-55.
[12]Brien JP,Mackinnon SE,MacLean A R,etal.Amodel of chronic nerve compression in the rat[J].Ann Plastysurg,1987,19(5):430-5.
[13]Strittmatter M,Grauer M,Isenberg E,et al.Cerebrospinal fluid neuropeptides and monoaminergic transmitters in patients with trigeminal neuralgia[J].JHeadache,1997,37(4):211-6.
[14]Imamura Y,Kawamoto H,Nakanishi O.Characterization of heathyperalgesia in an experimental trigeminal neuropathy in rats[J].Exp Brain Res,1996,116(1):97-103.
[15]Burchiel K J.Abnormal impulse generation in focally demyelinated trigeminal roots[J].Neurosurg,1980,53(5):674-83.
[16]Foong FW,Satoh M,Takagi H.A newly devised reliablemethod for evaluating analgesic potencies of drugs on trigeminal pain[J].Pharmacological Methods,1982,7(4):271-8.
[17]Sakas D E,Whittaker K,Abbasi K H,etal.Experimentalmicroneuro-surgery of the trigeminal nerve:surgical technique for ganglionectomy and rhizotomy in the cat[J].Neurosci Methods,1996,65(2):137-41.
[18]王惠岚,罗道枢,陈 江.大鼠三叉神经痛模型的建立[J].福建医科大学学报,2006,40(5):520-2.
[18]Wang H L,Luo D S,Chen J.Establishment of trigeminal neuralgia ratmodel[J].JFujian Med Univ,2006,40(5):520-2.
[19]Yu W,Kauppila T,Hultenby K.Photochemically-induced ischemic injury of the rat sciatic nerve:a light-and electronmicroscopic study[J].JPeripher Nerv Syst,2000,5(4):209-17.
[20]Kupers R,Yu W,Persson JK,et al.Photochemically-induced ischemia of the rat sciat ic nerve produces a dose-dependent and highly reproducible mechanical,heat and cold allodynia,and si gns of spontaneous pain[J].Pain,1998,76(1-2):45-59.
[21]Castellani M L,Galzio R J,Felaco P,et al.VEGF,substance P and strees,new aspects:a revisited study[J].J Biol Regul Homeost Agents,2010,24(3):229-37.
[22]Seino H,Seo K,Maeda T,Someya G.Behavioural and histological observation of sensory impairment caused by tight ligation of the trigeminal nerve inmice[J].JNeurosciMethods,2009,181(1):67-72.
[23]李 鹏,张美玉,王丹巧,等.青藤碱对SSNI模型大鼠镇痛效应及脑内兴奋性氨基酸递质的影响[J].中国药理学通报,2012,28(10):1364-9.
[23]Li P,Zhang M Y,Wang D Q,et al.Effects of sinomenine on analgesia and exciting amino acid neurotransmitters in brain of SSNI ratmodel[J].Chin Pharmacol Bull,2012,28(10):1364-9.
[24]赵小亮,刘 洋,王 晔,等.青藤碱对切口痛模型大鼠的镇痛效应及其中枢神经系统中P物质含量的影响[J].标记免疫分析与临床,2013,20(6):422-6.
[24]Zhao X L,Liu Y,Wang Y,et al.Effects of sinomenine on analgesia and contentsof substance P in central nervous system of incisional pain ratmodel[J].Label Immun Clin Med,2013,20(6):422-6.

