环氧酶-2在骨形态蛋白9诱导间充质干细胞骨向分化中的作用研究
黄 军,刘映孜,袁霜雪,伍秋香,王东旭,周岐新,何百成
(1.重庆医科大学药理学教研室,2.重庆市生物化学与分子药理学重点实验室,重庆 400016)
间充质干细胞(mesenchymal stem cell,MSCs)具有定向分化为成骨细胞、软骨细胞、脂肪细胞及肌细胞的能力。MSCs是再生领域中一种理想的种子细胞,在临床治疗骨缺损及骨不连接等疾病中有巨大的潜能[1]。近年来研究表明,环氧酶-2(cycloxygenase-2,COX-2)在骨折愈合和MSCs成骨分化中具有重要作用[2]。非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)作为环氧酶抑制剂,临床上常用于骨折或创伤手术后缓解疼痛。但NSAIDs能抑制前列腺素生成,致骨折愈合延迟及骨不连接发生[3-4]。骨形态蛋白(bone morphogenetic proteins,BMPs)是转化生长因子 β(transforming growth factor-β,TGF-β)超家族成员之一,对胚胎时期骨发育和成年骨缺损的修复起重要作用,同时也参与机体某些疾病的发生发展过程[5]。
Bonemorphogenetic protein 9(BMP9)是目前发现的BMPs成员中,诱导MSCs成骨分化能力最强的因子[6],但BMP9诱导MSCs成骨分化的具体机制及影响因子还不十分清楚。本研究主要探讨COX-2在BMP9诱导MSCs成骨分化过程中的作用,以及COX-2影响BMP9诱导MSCs成骨分化的可能机制。研究结果对于进一步深入研究 BMP9诱导MSCs成骨分化的机制,促进组织骨工程的发展具有重要意义,并且能为临床合理用药提供理论基础和实验依据。
1 材料与方法
1.1 细胞培养及试剂间充质干细胞C3H10T1/2购自American Type Culture Collection公司。采用DMEM培养基(高糖)(含10%胎牛血清、青霉素100 kU·L-1和链霉素 100 mg·L-1)培养细胞,培养条件为5%的CO2及37℃。NS-398(选择性COX-2抑制剂)购自Sigma-Aldrich公司。碱性磷酸酶(alkaline phosphatase,ALP)化学发光检测试剂盒购自BD Clontech公司。所用抗体均购自Santa Cruz Biotechnology公司。Lipofectamine购自Invitrogen公司。
1.2 重组腺病毒的构建本实验所用重组腺病毒均采用 Ad-Easy系统构建[7]。构建方法如下:用PCR从EST克隆中扩增目的基因的编码序列,并克隆到穿梭质粒。最后将穿梭质粒线性化并与含腺病毒骨架序列的质粒进行重组,将重组正确的质粒线性化并转染到HEK-293细胞(human embryonic kidney-293)进行病毒包装,得到目的基因编码序列的重组腺病毒。即GFP重组腺病毒(Ad-GFP)、BMP9重组腺病毒(Ad-BMP9)和COX-2沉默siRNA片段重组腺病毒(Ad-simCOX-2)。Ad-GFP作为空载重组腺病毒对照。
1.3 RT-PCR实验将指数生长的细胞种于T25培养瓶中,待细胞贴壁后按实验分组加入相应处理因素,于相应时间点提取总RNA。提取总RNA前24 h,将完全培养基换为含1%胎牛血清的完全培养基。采用异硫氰酸胍-酚-氯仿法提取总RNA。通过RT反应获得cDNA,并将cDNA作为模板通过定量PCR或普通PCR检测目的基因表达情况。每组实验重复3次。实验所用PCR引物如下:GAPDH,上游5′-ACCCAGAAGACTGTGG ATGG-3′,下游5′-CACATTGGGGGTAGGAACAC-3′;COX-2,上 游5′-AGAAGGAAATGGCTGCAGAA-3′,下游 5′-GCT CGGCTTCCAGTATTGAG-3′;Smad6,上游 5′-GTG TTGCAACCCCTACCACT-3′,下游 5′-GACATGCTGGCATCTGAGAA-3′;Smad7,上游 5′-GCATCTTCTGTCCCTGCTTC-3′,下 游 5′-CCGGTCTTCCTTTCCTTTTC-3′。
1.4 免疫细胞化学染色将指数生长的细胞种于24孔板,待细胞贴壁后按实验分组加入相应处理因素,并于相应时间点进行免疫细胞化学染色。操作过程如下:弃培养基,用 PBS(4℃)清洗 1次;用10%甲醛固定细胞,吸去固定液后用PBS(4℃)清洗2次;用1%NP-40和10%山羊血清封闭30 min,然后加入相应的一抗,以羊源的IgG作为阴性对照,孵育1 h;弃一抗,用PBS清洗3次,每次5 min。然后加入相应的二抗,孵育30 min。弃二抗,用PBS清洗3次,每次5 min。最后用DAB显色。每组实验重复3次。
1.5 Western blot实验将指数生长的细胞种于6孔板中,待细胞贴壁后按实验分组加入相应处理因素,于相应时间点提取总蛋白,并采用BCA法测定总蛋白浓度。用10%聚丙烯酰胺凝胶进行电泳,按常规方法进行Western blot操作。最后采用ECL化学发光法显色,用凝胶成像仪成像。每组实验重复3次。
1.6 碱性磷酸酶(alkaline phosphatase,ALP)活性测定将指数生长的细胞种于24孔板,待细胞贴壁后按实验分组加入相应处理因素,分别于d 5、7、9测定ALP活性。具体方法参照文献[6,8],并适当改进:先吸去培养基,每孔加入100μl裂解液,裂解5 min,收集裂解液并离心弃沉淀。反应体系组成为15μl缓冲液、5μl裂解液和5μl反应底物。室温下孵育25 min,然后用Promega萤光素酶分光光度计测定ALP活性。另用BCA法测定蛋白浓度,用以校正ALP活性。每组实验重复3次。
1.7 体内异位成骨实验将C3H10T1/2细胞用相应的重组腺病毒载体感染,24 h后收集细胞并计数。将细胞离心后,用PBS重新混悬,调整细胞浓度(1010·L-1)。将细胞种植于裸鼠背部右侧皮下(5×106/注射位点),每组5只裸鼠。接种细胞5周后,处死裸鼠并收集标本,将标本脱钙后进行石蜡包埋、切片、HE染色。
1.8 萤光素酶报告质粒实验将指数生长的细胞种于T25培养瓶中,待细胞贴壁后,用Lipofectamine转染 BMPR-Smad报告质粒(p12xSBE-Luc,Smad binding elements,SBE)2μg,4 h后换液,加入正常完全培养基。16 h后,将细胞消化重新种于24孔板,待细胞贴壁后按实验分组加入相应处理因素。24 h后裂解细胞,收集裂解液并离心弃沉定。按试剂盒的操作说明测定荧光素酶活性。采用BCA法测定蛋白浓度,用以校正萤光素酶活性。每组实验重复3次。
1.9 统计学分析用Microsoft Excel进行统计分析,数据用±s表示,组间比较t检验。
2 结果
2.1 BMP9在 C3H10T1/2细胞中诱导 COX-2表达
定量PCR结果显示,C3H10T1/2细胞用BMP9处理后,COX-2表达明显增加,72 h增加最明显(Fig 1A);Western blot和细胞免疫组化染色显示同样的结果(Fig 1B,C)。提示COX-2作为BMP9的重要靶基因之一,在BMP9诱导MSCs成骨分化的过程中可能具有重要作用。
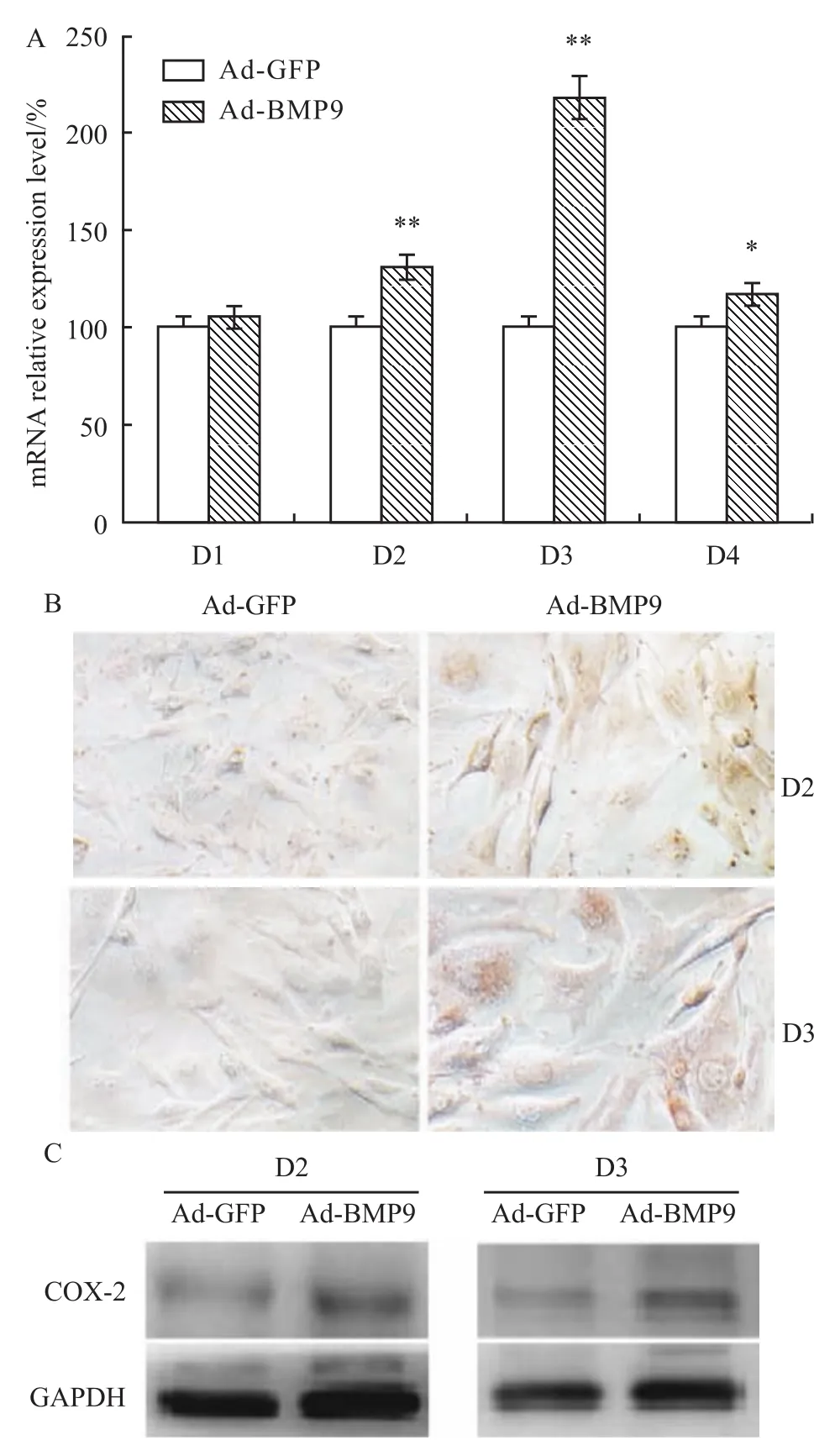
Fig 1 Effect of BMP9 on expression of COX-2 in C3H10T1/2 cells
2.2 抑制COX-2酶活性或沉默COX-2表达均对BMP9诱导C3H10T1/2细胞ALP活性增加具有抑制作用实验结果显示,COX-2选择性抑制剂NS-398能明显抑制 BMP9诱导 C3H10T1/2细胞的 ALP活性增加,并具有浓度依赖性(Fig 2A);沉默COX-2表达同样能明显抑制 BMP9诱导 C3H10T1/2细胞ALP活性增加 (Fig 2B)。提示COX-2在BMP9诱导C3H10T1/2细胞ALP活性增加中具有调节作用。
2.3 沉默 COX-2抑制 BMP9在 C3H10T1/2细胞中诱导Runx2、Dlx-5表达实验结果显示,用BMP9感染C3H10T1/2细胞后,成骨分化重要转录调节因子Runx2和DLX-5表达较对照组(用Ad-GFP处理)明显增加。沉默COX-2本身对Runx2和DLX-5没有明显影响,但在BMP9合并COX-2沉默表达组中Runx2和DLX-5表达水平较BMP9处理组明显降低(Fig 3 A,B)。提示COX-2可能对BMP9诱导C3H10T1/2细胞表达Runx2和Dlx-5具有一定的调节作用。
2.4 沉默 COX-2抑制 BMP9诱导 C3H10T1/2细胞的异位成骨能力实验结果显示,单独GFP处理组或COX-2沉默表达组均无异位成骨发生,BMP9处理组与BMP9合并COX-2沉默表达组均有异位成骨发生;但是BMP9合并COX-2沉默表达组异位成骨的质量(Fig 4)明显低于单用BMP9处理组。提示COX-2对BMP9诱导C3H10T1/2细胞异位成骨的过程可能具有重要调控作用。
2.5 沉默 COX-2表达抑制 BMP9在 C3H10T1/2细胞诱导BMP/Smads信号通路活化实验结果显示,BMP9处理组BMPR-Smad报告质粒荧光素酶的活性明显高于GFP对照组(P<0.01);BMP9合并COX-2沉默表达组中萤光素酶的活性明显低于单用BMP9组(P<0.01,Fig 5A)。Smad1/5/8磷酸化水平呈现相同的变化趋势(Fig 5B)。BMP9处理组Smad6和Smad7表达水平明显高于GFP对照组,而BMP9合并COX-2沉默表达组中Smad6和Smad7的表达水平则明显低于BMP9处理组(Fig 5C)。以上结果提示,COX-2在BMP9诱导MSCs成骨分化中的作用可能涉及对BMPs/Smads信号转导活性的调节。
3 讨论

Fig 2 Effect of NS-398 or COX-2 knockdown on BMP9 induced ALP activities in C3H10T1/2 cells
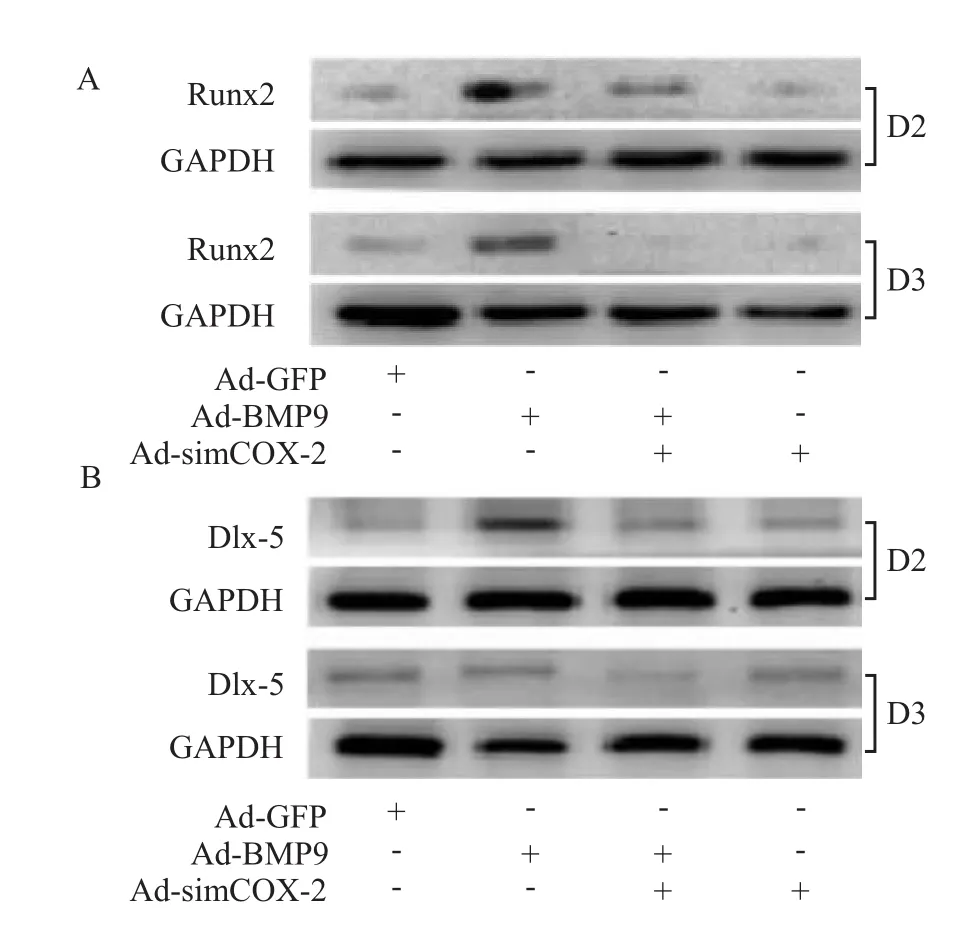
Fig 3 Effect of COX-2 knockdown on protein level of Runx2 and Dlx-5 induced by BMP9 in C3H10T1/2 cells
骨缺损及骨不连接是临床常见的骨科疾病,组织工程骨是治疗骨缺损及骨不连接的理想材料。间充质干细胞(MSCs)具有多向分化潜能,是组织骨工程中的理想种子细胞,如何促进MSCs有效成骨分化是该领域目前的研究热点之一[9]。研究表明[10-11],COX-2在骨折修复及愈合中具有重要作用,COX-2抑制剂能延迟骨折愈合并能导致骨不连接。BMP9是目前已知的诱导MSCs成骨分化能力最强的因子之一,但COX-2对BMP9诱导干细胞成骨分化的影响尚不清楚。C3H10T1/2细胞是公认的MSCs,具有多向分化潜能。因此本研究利用C3H10T1/2细胞分析BMP9诱导MSCs成骨分化与COX-2的关系。结果发现,BMP9在MSCs中可诱导COX-2表达,并且COX-2可通过调节BMPs/Smads信号转导,影响BMP9诱导的MSCs成骨分化。
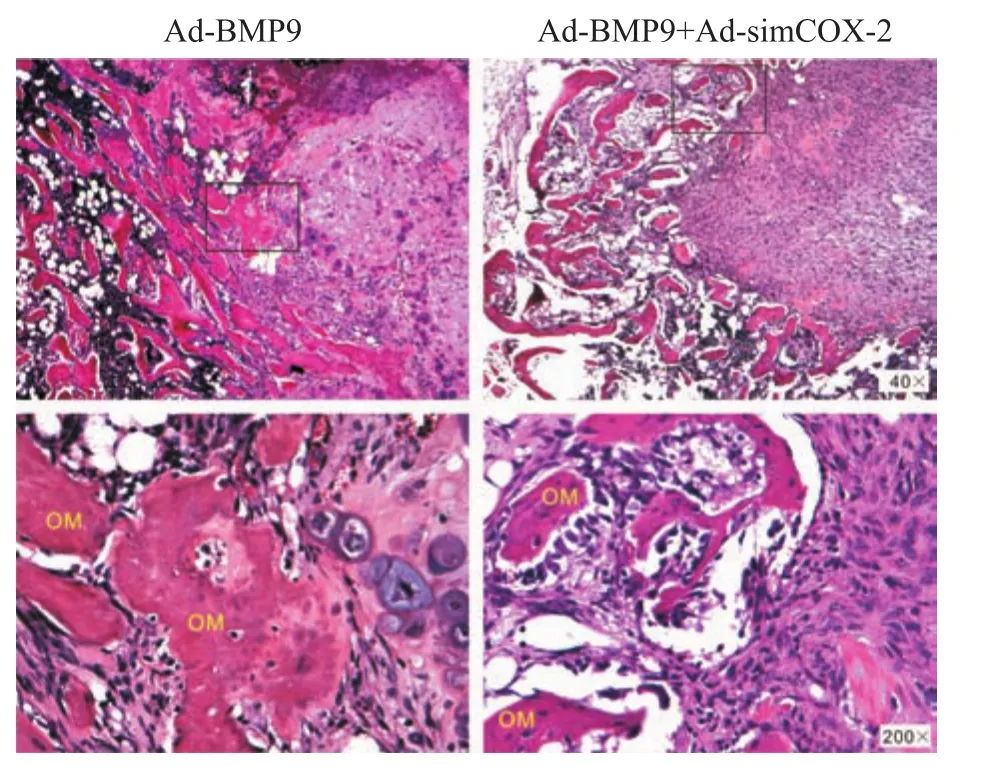
Fig 4 Effect COX-2 knockdown on ectopic bone formation induced by BMP9 in C3H10T1/2 cells
BMPs属于TGF-β超家族成员之一,目前已分离和鉴定了20余种。BMPs被认为是与干细胞成骨分化相关的因子,但随着研究的不断深入,现认为BMPs具有多种生物学功能。BMPs不但在胚胎时期对骨组织的发育和成年骨缺损修复中具有重要作用,而且与机体某些疾病发生有关[12]。BMPs通过BMPs-Smad信号通路发挥相应的生物学作用。成骨性BMPs与相应的受体(BMPⅠ型和Ⅱ型受体)结合后,引起下游成骨性 Smads磷酸化(Smad1/5/8),继而与Smad4形成复合物并转位入核,调节相应的靶基因表达,如 Runx2、Osterix和 Dlx-5等[13-14]。He等[6]系统分析了BMP2至BMP15共14种 BMPs对MSCs成骨分化的影响,发现除传统的BMP2和BMP7外,BMP4、BMP6和 BMP9也能诱导 MSCs成骨分化,并且BMP9诱导MSCs成骨分化的能力明显强于其他 BMPs成员。因此,研究 BMP9诱导MSCs成骨分化的机制及其影响因素具有重要临床意义。
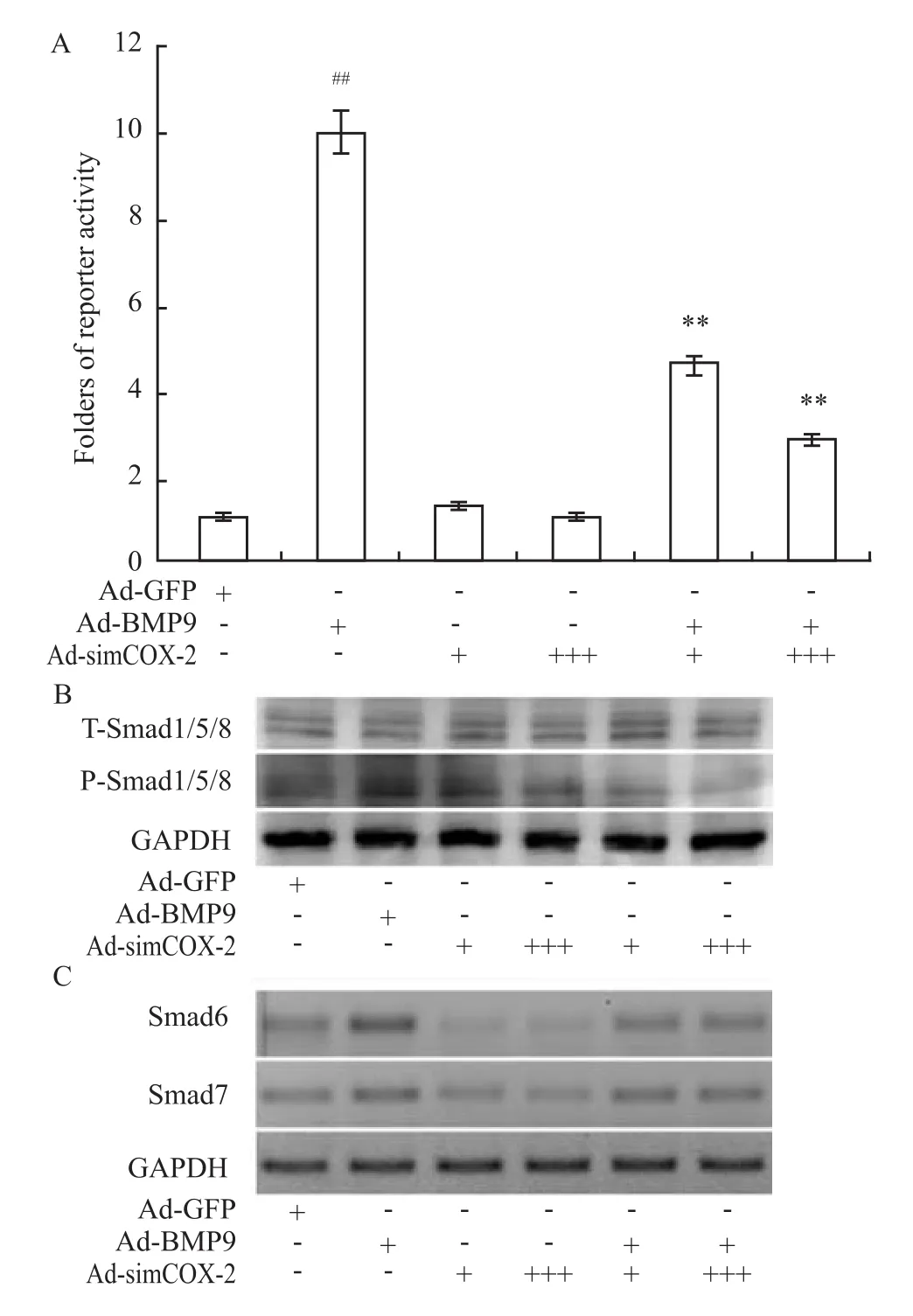
Fig 5 Effect of COX-2 knockdown on BMPs/Smads signal transduction induced by BMP9 in C3H10T1/2 cells
环氧酶(cyclooxygenase)是合成前列腺素的限速酶,目前已发现3种异构体,即环氧酶-1(cyclooxygenase-1,COX-1)、环氧酶-2(cyclooxygenase-2,COX-2)和环氧酶-3(cyclooxygenase-3,COX-3)。COX-2选择性抑制剂,因不良反应较少而广泛应用于临床,包括骨科疾病的术后镇痛。研究表明:COX-1在正常骨组织及受损骨组织中均有表达,但COX-2只在骨折后修复的早期表达增加;COX-1(-/-)小鼠的骨折愈合过程正常,COX-2(-/-)小鼠的骨折愈合不但明显延迟,并且COX-2(-/-)小鼠来源的骨髓间充质干细胞成骨分化也明显受到抑制[15]。Spiro等[16]证实,COX-2抑制剂对 BMP7促进骨折修复和诱导MSCs异位成骨均具有抑制作用。课题组前期研究表明,美洛昔康对BMP9诱导的MSCs成骨分化具有抑制作用[17]。提示COX-2在BMP9诱导MSCs成骨分化过程中可能具有重要作用,但BMP9与COX-2的关系及COX-2在BMP9诱导MSCs成骨分化的调节机制还不清楚。
通常认为前列腺素对骨代谢具有重要作用,其中前列腺素E2(PGE2)最重要;PGE2主要与EP2和EP4受体结合并激活PKA,通过cAMP途径发挥对骨代谢的调节作用[18-19]。我们的实验结果显示,BMP9在MSCs中明显诱导COX-2表达,并且COX-2选择性抑制剂或沉默COX-2表达对BMP9诱导的干细胞成骨分化均具有明显抑制作用。沉默COX-2表达不但明显降低BMPR-Smad报告质粒的萤光素酶活性,抑制Smad1/5/8的磷酸化,而且也明显降低BMP9诱导抑制性 Smads(Smad6/7)表达。提示COX-2对BMP9诱导BMPs/Smads信号通路活化具有重要调节作用。但是,目前还不清楚COX-2对BMP9诱导MSCs成骨分化的影响与EP受体/PKA/cAMP途径的关系,以及COX-2是否还能通过其他途径调节BMP9诱导MSCs成骨分化。
本研究证实BMP9在MSCs中能够诱导COX-2表达,并且COX-2在BMP9诱导的干细胞成骨分化过程中具有重要调节作用;这种作用可能与COX-2调节BMPs/Smads信号转导有关;研究结果对于进一步深入研究BMP9诱导MSCs成骨分化的机制,促进组织骨工程的发展,以及指导临床合理使用COX-2抑制剂具有重要意义。
参考文献:
[1]Luu H H,Song W X,Luo X J,et al.Distinct roles of bonemorphogenetic proteins in osteogenic differentiation of mesenchymal stem cells[J].JOrthopaedic Res,2007,25(5):665-77.
[2]Zhang X,Schwarz EM,Young D A,etal.Cyclooxygenase-2 regulatesmesenchymal cell differentiation into the osteoblast lineage and is critically involved in bone repair[J].JClin Invest,2002,109(11):1405-15.
[3]Vuolteenaho K,Moilanen T,Moilanen E.Non-steroidal anti-inflammatory drugs,cyclooxygenase-2 and the bone healing process[J].Basic Clin Pharmacol Toxicol,2008,102(1):10-4.
[4]Leonelli SM,Goldberg B A,Safanda J,et al.Effects of a cyclooxygenase-2 inhibitor(rofecoxib)on bone healing[J].Am J Orthop(Belle Mead NJ),2006,35(2):79-84.
[5]Hong CC,Yu PB.Applicationsof smallmolecule BMP inhibitors in physiology and disease[J].Cytokine Growth Factor Rev,2009,20(5-6):409-18.
[6]Kang Q,Sun M H,Cheng H,et al.Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery[J].Gene Ther,2004,11(17):1312-20.
[7]Luo JY,Deng Z L,Luo X J,et al.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].Nat Protoc,2007,2(5):1236-47.
[8]Rosalki SB,Foo A Y,Burlina A,etal.Multicenter evaluation of Iso ALP test kit formeasurement of bone alkaline phosphatase activity in serum and plasma[J].Clin Chem,1993,39(4):648-52.
[9]Fakhry M,Hamade E,Badran B,etal.Molecularmechanisms of mesenchymal stem cell differentiation towards osteoblasts[J].World JStem Cells,2013,5(4):136-48.
[10]Vuolteenaho K,Moilanen T,Moilanen E.Non-steroidal anti-inflammatory drugs,cyclooxygen ase-2 and the bone healing process[J].Basic Clin Pharmacol Toxicol,2008,102(1):10-4.
[11]Leonelli SM,Goldberg B A,Safanda J,et al.Effects of cyclooxygen ase-2 inhibitor(rofecoxib)on bone healing[J].Am JOrthop(Belle Mead NJ),2006,35(2):79-84.
[12]Hong CC,Yu PB.Applications of smallmolecule BMP inhibitors in physiology and disease[J].Cytokine Growth Factor Rev,2009,20(5-6):409-18.
[13]Chen L,Jiang W,Huang JY,et al.Insulin-like growth factor 2(IGF-2)potentiates BMP-9-induced osteogenic differentiation and bone formation[J].J Bone Miner Res,2010,25(11):2447-59.
[14]张 燕,文 巍,罗进勇.骨形态发生蛋白9定向诱导多潜能干细胞成骨分化[J].生物化学与生物物理进展,2009,36(10):1291-8.
[14]Zhang Y,WenW,Luo JY.BMP9 Inducesosteogenic differentiation ofmultipotent stem cell[J].Prog Biochem Biophys,2009,36(10):1291-8.
[15]Zhang X,Schwarz EM,Young D A,etal.Cyclooxygenase-2 regulatesmesenchymal cell differentiation into the osteoblast lineage and is critically involved in bone repair[J].JClin Invest,2002,109(11):1405-15.
[16]Spiro A S,Timo Beil F,Baranowsky A,et al.BMP-7-induced ectopic bone formation and fracture healing is impaired by systemic NSAID application in C57BL/6-mice[J].JOrthop Res,2010,28(6):785-91.
[17]周龙洋,牟钰钦,杨秋珺,等.美洛昔康对骨形态蛋白9诱导间充质干细胞骨向分化的抑制作用[J].中国药理学与毒理学杂志,2012,26(3):321-6.
[17]Zhou L Y,Mou Y Q,Yang Q J,et al.The inhibitory effect of meloxicam on bonemorphogenetic protein 9 induced osteogenic differentiation in mesenchymal stem cells[J].Chin J Pharamcol Toxicol,2012,26(3):321-6.
[18]Katherine A,Blackwell,Lawrence G.Raisz,Carol C.Pilbeam prostaglandins in bone:Bad cop,good cop[J]?Trends Endocrinol Met,2010,21(5):294-301.
[19]Zaman G,Sunters A,Galea G L,etal.Loading-related regulation of transcription factor EGR2/Krox-20 in bone cells is ERK1/2 protein-mediated and prostaglandin,Wnt signaling pathway-,and insulin-like growth factor-Iaxis-dependent[J].JBiol Chem,2012,287(6):3946-62.

