cAMP反应元件结合蛋白在LPS致肺微血管内皮细胞损伤过程中的作用
徐秀娟,孙耕耘,尤青海,张 丹
(安徽医科大学第一附属医院呼吸内科,安徽合肥 230022)
肺微血管内皮细胞(pulmonarymicrovascular endothelial cells,PMVEC)是肺微循环屏障的重要组成部分,当发生急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)时,PMVEC通透性增加、肺间质及肺泡水肿是ARDS发生的病理生理基础,因此,研究 PMVEC损伤的调控机制对寻找ARDS的防治措施具有重大意义。多种炎症介质错综复杂的相互作用是ARDS发病的重要环节,其本质是失控性全身炎症反应在肺部的体现,多种炎症介质贯穿该过程,炎症介质作为第一信使激活细胞内的众多信号转导通路,将信号携致细胞核内,活化特定的核转录因子调控相应基因的转录,从而促进或抑制炎症反应。
CREB是一种重要的核转录因子,能被CREB活化后转录的靶基因超过5 000种,它们参与细胞物质代谢[1]、免疫反应[2]、炎症反应[3-4]等过程。但CREB是否在LPS诱导的RPMVEC炎症损伤中起作用及其中的机制尚不清楚。为此,本实验通过LPS建立大鼠肺微血管内皮细胞(rat pulmonary microvascular endothelial cell,RPMVEC)单层损伤模型,观察LPS对CREB及其磷酸化的作用,并探讨CREB磷酸化对RPMVEC单层通透性的影响。
1 材料与方法
1.1 材料
1.1.1 试剂 Dulbecco改良Eagle高糖培养基干粉(DMEM)及胎牛血清(美国Gibco公司);兔抗鼠p-CREB(Ser133)多克隆抗体、兔抗鼠CREB多克隆抗体(美国CST公司);HRP标记的羊抗兔IgG抗体(武汉博士德生物工程有限公司);ECL底物发光试剂盒(美国 Pierce公司);白蛋白(美国 Sigma公司);V5681(美国 Promega公司);Transwell小室(美国Corning公司);RIPA裂解液(北京索莱宝科技有限公司);余实验试剂为国产分析纯。
1.1.2 实验动物 健康♂、体质量100~120 g、SPF级SD大鼠购自安徽省实验动物中心[合格证号:SCXK(皖)2011-002]。
1.2 方法
1.2.1 实验分组和处理 (1)量效组:0.1、1、10、100 mg·L-1LPS分别刺激 RPMVEC 30 min后,检测p-CREB及CREB,设正常组对照;(2)时效组:10 mg·L-1LPS分别刺激 RPMVEC 10、30、60、120 min,检测 p-CREB及CREB,设正常组对照;10 mg·L-1LPS分别刺激 RPMVEC 1、3、6、12、24 h,检测CREB及GAPDH,设正常组对照;(3)PKA通路组:10μmol·L-1V5681与RPMVEC预孵育0.5h后,再加入10 mg·L-1LPS继续孵育,30 min后检测 p-CREB及CREB,3 h后检测通透系数,设正常对照组、V5681组和LPS单独刺激组。
1.2.2 RPMVEC分离培养与鉴定 参照本实验室建立的实验方法进行,RPMVEC鉴定结合显微镜下呈典型的“铺路石样”排列的形态学特征、Ⅷ因子相关抗原和FITC标记的异植物凝集素结合试验阳性[5]。
1.2.3 Western blot检测 RIPA裂解液裂解RPMVEC后,12 000 r·min-1、4℃离心 10 min,留取上清。参照BCA浓度测定试剂盒将上清蛋白调至2 g·L-1。12%分离胶和5%积层胶进行蛋白电泳(上样量均为20μl),蛋白转至硝酸纤维素膜上,PBS-T溶液封闭,兔抗鼠CREB(稀释浓度为1∶800)、p-CREB多克隆抗体(稀释浓度为1∶1 000)4℃孵育过夜,HRP标记的羊抗兔IgG溶液(稀释浓度为1∶10 000)室温孵育1 h,ECL法显影,扫描仪扫描存盘,结果用Bio-Rad Quantity One软件分析。
1.2.4 PMVEC单层通透性的检测 参考文献[6]略改进伊文思蓝-白蛋白法,倒置显微镜判断 Transwell上 RPMVEC单层融合后,PBS充分漂洗含RPMVEC单层的Transwell小室3次,上室中加入终浓度为0.67 g·L-1伊文思蓝-白蛋白液100μl,下室中加入4%白蛋白液600μl,置于37℃、5%CO2孵箱孵育1 h,分别从下室提取样品,全自动酶标仪检测620 nm波长处OD值。根据标准曲线得出上、下室伊文思蓝-白蛋白浓度,按公式计算RPMEVC的通透系数。通透系数(cm/s)=([A]/t)×(1/A)×(V/[L])。其中[A]是下室伊文思蓝 -白蛋白浓度,t(s)是时间间隔,A(cm2)是 Transwell表面积,V(m3)是下室溶液体积,[L]是上室伊文思蓝-白蛋白浓度。
1.2.5 统计学处理 数据以±s表示,SPSS 16.0统计学软件进行数据分析,多组变量间比较采用单因素方差分析。
2 结果
2.1 LPS刺激对RPM VEC中CREB磷酸化水平的影响随着 LPS孵育浓度的增加(0、0.1、1、10、100 mg·L-1),CREB中 Ser133位点磷酸化水平逐渐增加,各组间比较差异均具有统计学意义(P<0.05),见 Fig 1A;10 mg·L-1LPS作用于 RPMVEC 10 min后,CREB中Ser133位点磷酸化水平明显升高,30min达高峰,随后开始下降,120min仍高于基础水平,各组间差异具有统计学意义(P<0.05),见Fig 1B。

Fig 1 Effect of LPS on phosphorytation ceuels of CREB in RPMVEC(±s,n=6)
2.2 不同时相的 LPS刺激对 RPMVEC表达CREB的影响10 mg·L-1LPS与RPMVEC共孵育后,CREB表达量于1 h开始升高,3 h达峰值,随后逐渐下降,至孵育24 h表达水平仍高于正常对照组,各组间差异均具有统计学意义(P<0.05),见Fig 2。
2.3 V5681对LPS诱导RPMVEC中CREB磷酸化水平的影响与正常对照组相比,10 mg·L-1LPS刺激RPMVEC使CREB中Ser133位点磷酸化水平明显升高(P<0.05);加入PKA特异性通路抑制剂V5681预孵育后,LPS诱导的CREB中Ser133位点磷酸化水平明显降低,差异具有统计学意义(P<0.05),见Fig 3,可见PKA通路介导了LPS诱导的RPMVEC中CREB磷酸化过程。
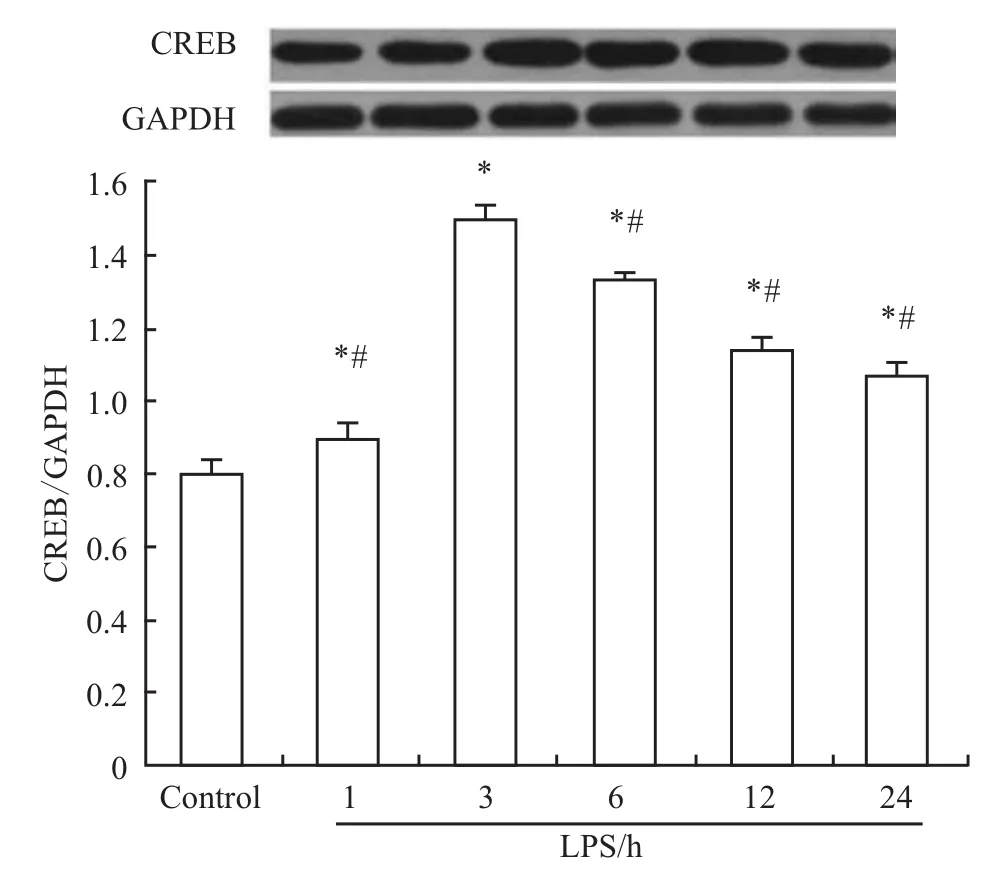
Fig 2 Effect of 10 mg·L-1 LPS on the expression of CREB at different time in RPMVEC(±s,n=6)

Fig 3 Effect of V5681on phosphorylation levels of CREB induced by LPS in RPMVEC(±s,n=6)
2.4 V5681对LPS诱导RPMVEC通透性变化的影响与正常对照组相比,10 mg·L-1LPS刺激使RPMVEC的通透性明显增加(P<0.05);而10μmol·L-1V5681与10 mg·L-1LPS共孵育后,RPMVEC通透性较单纯10 mg·L-1LPS刺激组明显增加(P<0.05);与正常对照组相比,V5681单独作用也可增加细胞单层通透性,差异具有统计学意义(P<0.05),见 Tab 1。
Tab 1 Effect of V5681 on permeability induced by LPS in RPMVEC(±s,n=6)
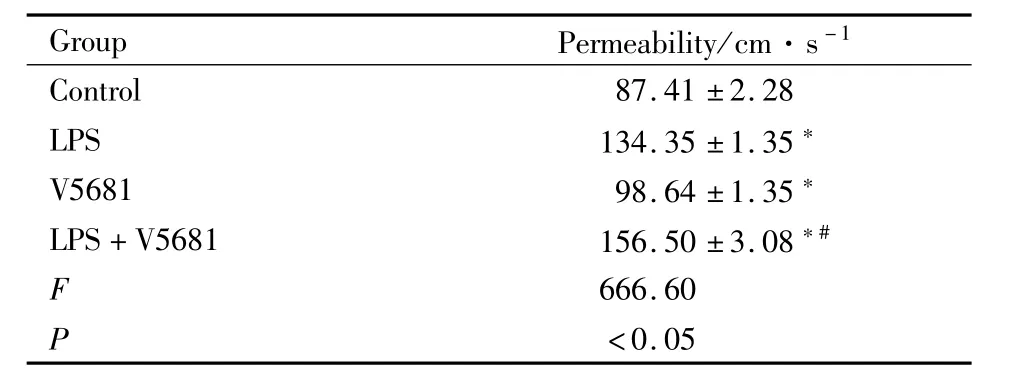
Tab 1 Effect of V5681 on permeability induced by LPS in RPMVEC(±s,n=6)
*P<0.05 vs control group;#P<0.05 vs LPS group.
Group Permeability/cm·s-1 Control 87.41±2.28 LPS 134.35±1.35*V5681 98.64±1.35*LPS+V5681 156.50±3.08*#F 666.60 P <0.05
3 讨论
CREB广泛存在于真核生物细胞核内,是一种通过磷酸化起作用的转录因子,能调控基因启动子中含有CRE的目的基因转录,它位于PKA通路下游,许多与PKA信号通路相关的重要生物学事件均是由CREB磷酸化介导的。CREB的一级结构由341个氨基酸残基构成,二级结构包括1个激酶诱导域、2个富含谷氨酸区域和1个基础亮氨酸拉链结构域,前两者对CREB活化和磷酸化至关重要,Ser133是其最主要的磷酸化位点,多种蛋白激酶均能诱导 Ser133残基磷酸化[7],如 PKA、PKC、MAPK。
有关CREB的研究主要集中于神经系统,如生物节律的调节、记忆与学习的形成、情绪反应、药物成瘾及戒断等方面[8]。研究发现,CREB参与了ARDS的发病过程,肺部炎症反应后中性粒细胞介导的细胞凋亡可能是ARDS的发病机制之一,转录因子CREB参与了上述过程[9]。在LPS诱导的小鼠急性肺损伤模型中,CREB通过调节细胞毒T淋巴细胞相关抗原4的表达发挥抗炎作用,同时在体外培养的EL4细胞(小鼠淋巴瘤细胞)和CD4+T细胞中得到同样的结果[10]。由此可见,CREB通过多种机制参与了ARDS发病过程。
p-CREB是CREB发挥功能的活性形式。既往研究证实:p-CREB经多种途径参与组织的炎症反应[3,11],在已分化的多巴胺神经元细胞中,CREB磷酸化能增加细胞对TNF-α诱导的炎症反应的抵抗作用[4]。研究发现基因敲除CREB基因后,正常和炎性损伤的内皮细胞通透性均明显增加。与正常组大鼠相比,CREB基因敲除大鼠对炎症诱导的肺水肿恢复缓慢[12],提示CREB在维持肺血管功能上起重要作用。
本实验首先复制RPMVEC单层损伤模型,发现LPS刺激RPMVEC后,CREB中Ser133位点磷酸化水平随着LPS刺激浓度的增加而逐渐升高,且在30 min时达到峰值,表明LPS能快速诱导RPMVEC中CREB磷酸化。加入PKA通路特异性抑制剂V5681,预孵育RPMVEC后,LPS诱导的CREB磷酸化几乎被完全抑制,这表明PKA通路介导了LPS诱导的CREB磷酸化。与LPS单独刺激相比,加入V5681预处理后,RPMVEC单层通透性增加。提示CREB磷酸化在LPS致RPMVEC炎症损伤过程中可能起保护作用。既往研究表明,气道平滑肌细胞在炎症反应时MAPK磷酸酶-1表达明显升高,这作为一种负反馈机制限制MAPK通路介导的炎症反应,而MAPK磷酸酶-1是CREB的靶基因,在炎症介质诱导MAPK磷酸酶-1表达上调过程中,cAMP/PKA/CREB通路参与了该过程[3];血红素加氧酶-1是血红素降解过程中限速酶,它具有抗炎抗氧化作用,在人脐静脉内皮细胞系中,炎症介质能经PKA、PKC等多种信号通路活化CREB,诱导血红素加氧酶-1表达,从而限制炎症反应和组织损伤[11]。证实炎症介质经一系列的信号通路使CREB磷酸化,活化后的CREB通过调控下游的靶基因表达限制炎症反应是CREB起保护作用的机制。
本实验证实LPS能快速诱导RPMVEC中CREB磷酸化,PKA通路介导了该过程;CREB磷酸化在LPS诱导的RPMVEC炎症损伤中可能起保护作用。期待在今后的实验中研究CREB基因敲除对PKA、PKC等蛋白激酶的反馈调节机制,针对其作用环节,采取干预措施改变细胞内信号转导,以期减轻炎症诱导的RPMVEC损伤。
参考文献:
[1]Qi L,SaberiM,Zmuda E,etal.Adipocyte CREB promotes insulin resistance in obesity[J].Cell Met,2009,9(3):277-86.
[2]Pasquinelli V,Townsend JC,Jurado JO,et al.IFN-gamma production during active tuberculosis is regulated by mechanisms that involve IL-17,SLAM,and CREB[J].J Infect Dis,2009,199(5):661-5.
[3]Che W,Manetsch M,Quante T,et al.Sphingosine 1-phosphate induces MKP-1 expression via p38 MAPK-and CREB-mediated pathways in airway smooth muscle cells[J].Biochim Biophys Acta,2012,1823(10):1658-65.
[4]Lee J K,Chung J,Druey K M,Tansey M G.RGS10 exerts a neuroprotective role through the PKA/c-AMP response-element(CREB)pathway in dopaminergic neuron-like cells[J].JNeurochem,2012,122(2):333-43.
[5]You QH,Sun G Y,Wang N,etal.Interleukin-17F-induced pulmonarymicrovascular endothelialmonolayer hyperpermeability via the protein kinase C pathway[J].J Surg Res,2010,162(1):110-21.
[6]Farley K S,Wang L,Mehta S,et al.Septic pulmonarymicrovascular endothelial cell injury:role of alveolar macrophage NADPH oxidase[J].Am J Physiol Lung Cell Mol Physiol,2009,296(3):L480-8.
[7]Mayr B,Montminy M.Transcriptional regulation by the phosphorylation-dependent factor CREB[J].Nat Rev Mol Cell Biol,2001,2(8):599-609.
[8]何 萍,陈家欢,黄晓亮,等.慢性吗啡处理对大鼠交感神经节pCREB和 CREB mRNA表达的影响[J].中国药理学通报,2013,29(2):238-41.
[8]He P,Chen JH,Huang X L,et al.Effects of chronic morphine treatment on expression of pCREB and CREBmRNA in sympathetic ganglia of rats[J].Chin Pharmacol Bull,2013,29(2):238-41.
[9]Chopra M,Reuben JS,Sharma A C.Acute lung injury:apoptosis and signaling mechanisms[J].Exp Biol Med,2009,234(4):361-71.
[10]Li J,Lin K W,Murray F,et al.Regulation of cytotoxic T lymphocyte antigen 4 by cAMP[J].Am J Respir Cell Mol Biol,2013,48(1):63-70.
[11]Kronke G,Bochkov VN,Huber J,et al.Oxidized phospholipids induce expression of human heme oxygenase-1 involving activation of cAMP-responsive element-binding protein[J].J Biol Chem,2003,278(51):51006-14.
[12]Chava K R,Tauseef M,Sharma T,et al.Cyclic AMP response element-binding protein prevents endothelial permeability increase through transcriptional controlling p190RhoGAP expression[J].Blood,2012,119(1):308-19.

