青蒿琥酯对增生性瘢痕成纤维细胞的抑制作用及机制探讨
李 战,农晓琳,李佳荃,朴 智,唐黎黎
(广西医科大学1.口腔医学院口腔颌面外科、2.医学科学实验中心,广西南宁 530021)
皮肤增生性瘢痕是临床上常见而治疗棘手的疾病,常不同程度地影响患者的容貌和功能[1]。在创伤愈合过程中,由多种原因所致的以成纤维细胞为主的细胞成分过度增殖、多种致纤维化因子过度表达、以胶原为主的细胞外基质过度合成及降解减少,导致增生性瘢痕的形成[2]。
广西是青蒿药材的主产地,青蒿素是从青蒿中分离出来的一种化合物,系高效、低毒的抗疟药。青蒿琥酯(artesunate,ART)是青蒿素经化学合成的水溶性衍生物,研究证实其除具有传统的抗疟疾作用外,还具有抗肿瘤、抗纤维化等作用[3-4]。本研究通过体外培养人皮肤增生性瘢痕成纤维细胞,采用不同浓度的ART进行干预,检测其对成纤维细胞增殖、胶原水平及其合成降解相关因子的表达的影响,探讨ART对皮肤增生性瘢痕的抑制作用及其可能机制,为利用其开发抗瘢痕药剂提供实验依据。
1 材料
1.1 主要仪器TS-100F型倒置显微镜,日本Nikon公司;全自动多功能型酶标仪,美国BIO-RAD公司;Step-one plus型PCR扩增仪,美国ABI公司;NanoDrop 2000核酸测定仪,美国Thermo公司。
1.2 主要试剂青蒿琥酯,纯度99.99%,桂林南药股份公司;DMEM培养基、胎牛血清,美国Gibco公司;噻唑蓝(MTT),美国Sigma公司;鼠抗人波形蛋白抗体、羊抗鼠抗兔HRP标记二抗,武汉博士德公司;RNA提取试剂盒RNAiso Plus、逆转录试剂盒编号 DRR036A、荧光定量 PCR试剂盒编号DRR420A,日本TaKaRa公司;鼠抗人CTGF单克隆抗体、兔抗人Ⅰ型胶原多克隆抗体,台湾Abnova公司;鼠抗人β-actin单克隆抗体,上海康成公司。
2 方法
2.1 增生性瘢痕成纤维细胞的原代培养及鉴定瘢痕标本来源于广西医科大学第一附属医院烧伤整形外科手术切除的增生性瘢痕,病程3~6月,取材前经患者知情同意。纳入标准为近2年内未接受抗瘢痕治疗,无系统疾病者。采用组织块法原代培养瘢痕成纤维细胞[5],培养液为含20%胎牛血清的DMEM培养基,按1∶3反复传代纯化成纤维细胞。原代培养和传代过程中均于倒置显微镜下观察细胞的形态。取第3代成纤维细胞,制备细胞爬片,4%多聚甲醛固定,行免疫组化抗波形蛋白染色鉴定。实验使用第3~5代细胞。
2.2 MTT法测定青蒿琥酯对人皮肤瘢痕成纤维细胞增殖的影响取前述实验获得的对数生长期的成纤维细胞,调整细胞浓度为0.5×108·L-1,接种于96孔培养板,每孔加入100μl的细胞悬液和100μl的培养基,培养24 h后吸弃原培养液。干预组:分别加入配置好的含ART浓度为75、150、300及600 μmol·L-1的培养基 200μl;对照组:每孔只加 200 μl的培养基;每组设6个复孔。继续培养24 h后,加入20μl 5 g·L-1MTT,摇匀,4 h后吸弃上清,加入200μl DMSO,震荡10 min,于酶标仪492 nm波长下测定吸光度(A)值。记录结果,计算ART对皮肤瘢痕成纤维细胞的抑制率。生长抑制率/%=(1-用药组A/对照组A)×100%。
2.3 实时荧光定量 RT-PCR法检测 CTGF、pro-COL1A2和MMP1的mRNA表达每25 cm2培养瓶接种5×105个细胞,培养24 h后,弃原培养液,换用含药培养基干预24 h,按试剂说明书提取各组细胞总RNA,按逆转录试剂盒说明书进行逆转录。委托TaKaRa公司进行引物设计及合成,并通过NCBI数据库进行BLAST验证引物的特异性,引物序列见Tab 1。按试剂盒说明书进行荧光定量PCR扩增,反应体系为SYBR®Premix Ex TaqTM10 μl,Forward Primer 0.4μl,Reverse Primer 0.4μl,ROX Reference Dye 0.4μl,dH2O 6.8μl,cDNA 2 μl,总共20μl;扩增条件为95℃预变性30 s,95℃变性5 s,60℃退火、延伸 30 s,共 40个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s,分析溶解曲线。使用 2-△△Ct法表示目的基因的相对表达量。△Ct=Ct(目的基因)-Ct(内参基因),△△Ct=△Ct(干预组)-△Ct(对照组)。

Tab 1 Sequences of PCR primers
2.4 免疫印迹法检测CTGF和collagenⅠ的蛋白表达不同浓度ART药液干预24 h后,每25 cm2细胞加入蛋白裂解液200μl,冰上裂解细胞30 min,离心收集总蛋白。常规聚丙烯酰胺凝胶电泳、转膜,5%脱脂奶粉室温下封闭2 h,4℃孵育一抗过夜(CTGF 1∶500稀释,Ⅰ型胶原1∶1 000稀释),室温下孵育二抗30 min(1∶5 000稀释);β-actin作为内参照(1∶10 000稀释)。暗室内ECL化学发光及显影、定影。扫描胶片,Quantity One软件分析比较CTGF及Ⅰ型胶原条带与β-actin条带灰度值比值。
2.5 统计学分析应用SPSS 16.0统计软件进行统计学分析。计量资料用±s表示,多样本间比较采用完全随机设计单因素方差分析SNK-q检验。
3 结果
3.1 增生性瘢痕成纤维细胞原代培养状况培养5~7 d可见组织块周围有细小呈长梭状贴壁细胞爬出,之后梭形细胞增殖迅速,15~20 d可长满25 cm2培养瓶(Fig 1A);传代3次,获得较纯的成纤维细胞,所有细胞胞质均呈抗波形蛋白染色阳性(Fig 1B)。
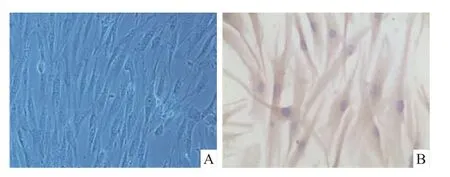
Fig 1 M orphologic observation of fibroblasts derived from hypertrophic scar and its immunohistochem ical staining against vimentin(×200)
3.2 青蒿琥酯对成纤维细胞增殖的影响经MTT法检测,各浓度ART作用后,均能抑制成纤维细胞增殖,且随着ART浓度升高,抑制率逐渐增高(Fig 2)。

Fig 2 Effect of ART on cell proliferation of hypertrophic scar fibroblasts(±s,n=6)
3.3 青 蒿 琥 酯 对 CTGF、proCOL1A2和MMP1m RNA表达的影响 2-△△Ct法分析发现各干预组CTGF的表达明显低于对照组,差异具有显著性(P<0.01);ART 300μmol·L-1与ART 600μmol·L-1组两两比较差异无统计学意义(P>0.05),其余各ART组间两两比较差异有显著性(P<0.01)。除75μmol·L-1组外,其余各干预组MMP1的表达均明显高于空白对照组,差异具有显著性(P<0.01);各ART组间两两比较差异有显著性(P<0.01)。各干预组proCOL1A2的表达均低于对照组,差异具有显著性(P<0.01),ART 75μmol·L-1与 ART 300μmol·L-1组两两比较及ART 150μmol·L-1与 ART 600μmol·L-1组两两比较差异有显著性(P<0.01),其余各ART组间两两比较差异无统计学意义(P>0.05),见 Fig 3,4。

Fig 3 Effect of ART on the expression of CTGF and proCOL1A2 mRNA(±s,n=3)
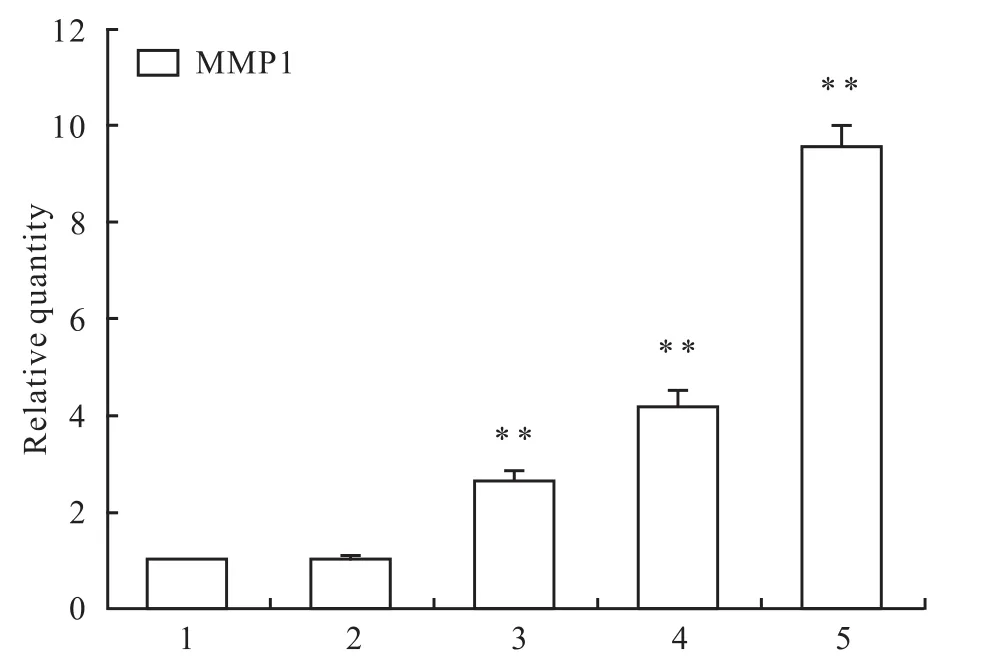
Fig 4 Effects of ART on the expression of MMP1 mRNA(±s,n=3)
3.4 青蒿琥酯对CTGF和Ⅰ型胶原蛋白表达的影响 各组成纤维细胞CTGF蛋白表达相对灰度值结果显示,ART 75μmol·L-1组与空白对照组两两比较差异无统计学意义(P>0.05),ART 150μmol·L-1组,ART 300μmol·L-1组及 ART 600μmol·L-1组与空白对照组比较差异均有显著性(P<0.01),各ART组间两两比较差异均有显著性(P<0.01)。各干预组collagenⅠ蛋白表达量与空白对照组比较差异均有显著性(P<0.01),各ART组间两两比较差异均有显著性(P<0.01)见Fig 5。
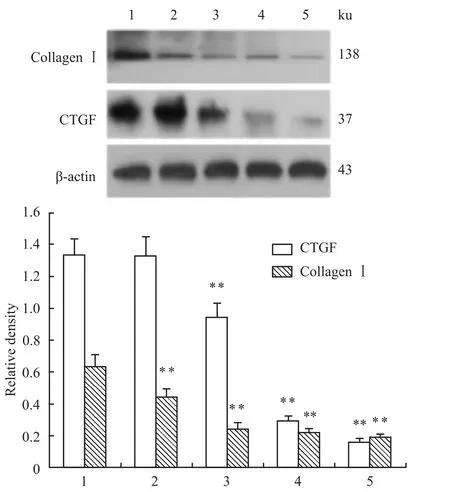
Fig 5 Effect of ART on the protein expression of CTGF and collagenⅠ(±s,n=3)
4 讨论
皮肤病理性瘢痕是临床上一种常见的皮肤纤维组织增生性疾病,包括增生性瘢痕及瘢痕疙瘩。治疗增生性瘢痕常用的措施主要包括:手术切除、冷冻、激光、硅胶膜制品贴敷、瘢痕内注射激素类药物等[2],尽管如此,增生性瘢痕仍经常可见,且疗效仍欠理想。皮肤创伤愈合过程,通过阻断参与瘢痕组织形成过程中的细胞及细胞因子的作用,抑制细胞外基质的过度产生和集聚,可能达到减轻瘢痕组织的目的;具体包括以下几个方面:(1)通过诱导细胞凋亡,减少或去除参与瘢痕组织形成的细胞成分,或直接抑制这些细胞的生长和增殖;(2)阻断对成纤维细胞合成细胞外基质有促进作用的阳性信号,或增强对成纤维细胞合成细胞外基质有抑制作用的阴性信号。这些信号可来自于细胞间接触、细胞因子或细胞外基质;(3)抑制成纤维细胞基质前体合成的转录和翻译,以及已合成基质的聚合,或抑制与之有关的信号转导;(4)增强基质降解酶如胶原酶的活性,以去除已形成的纤维成分[6]。
成纤维细胞是组织创伤修复过程中细胞外基质合成的主要效应细胞,其异常增殖及凋亡延迟将导致细胞外基质失去原有平衡,导致细胞外基质过度沉积。本课题组前期实验将ART作用于兔耳瘢痕模型,观察发现在一定剂量内可以明显抑制兔耳瘢痕增生,且可抑制其成纤维细胞的增殖活性和胶原合成量[7]。已有研究报道ART可对体外培养的瘢痕疙瘩成纤维细胞产生增殖抑制作用[8],本研究通过MTT细胞增殖检测,验证了其对增生性瘢痕成纤维细胞也具有相似的增殖抑制能力。
转化生长因子 β1(transforming growth factorβ1,TGF-β1)是已知的最强烈的纤维化促进因子[9],组织损伤后,局部 TGF-β1增多促进了成纤维细胞的活性,扰乱了胶原合成与降解的平衡,引起持续的细胞外基质沉积。人类CTGF主要由成纤维细胞等间质细胞分泌产生,是TGF-β1致纤维化作用的直接下游效应介质,在CTGF的启动子序列存在着一个重要的TGF-β1调控元件,后者的点突变可以导致TGF-β1活性的完全丧失。研究发现[10],抑制CTGF的表达,瘢痕成纤维细胞的胶原合成即受到明显抑制;阻断其表达,则可完全阻断TGF-β1所介导的胶原合成[11]。本研究表明,150μmol·L-1以上浓度的ART能明显降低CTGF在mRNA及蛋白水平的表达,并具有浓度依赖性。推测ART可能通过下调CTGF的表达,从而抑制TGF-β1通路,抑制其致纤维化效应,发挥抗瘢痕作用。
Ⅰ型胶原是皮肤胶原的主要类型,由两条α1链及一条α2链构成,分别由对应的前胶原基因编码。作为增生性瘢痕细胞外基质中含量最多的胶原,Ⅰ型胶原的过度合成和降解减少是增生性瘢痕形成的主要原因。抑制成纤维细胞分泌胶原则可以明显抑制瘢痕增生[10]。而细胞外基质的持续降解和重建过程又受到组织细胞所分泌的基质金属蛋白酶类(MMPs)的调控。MMP1,又称间质胶原酶,能特异性松弛胶原中的三维螺旋结构,破坏胶原热稳定性;具有降解Ⅰ、Ⅱ、Ⅲ型胶原及氨基多糖等作用,并与其他MMP有协同作用。因此组织中MMP1的含量多少及活性高低直接影响细胞外基质的降解程度[12]。本研究发现ART对Ⅰ型胶原蛋白及其前胶原mRNA表达均有抑制作用,但蛋白水平抑制作用的浓度依耐性优于其前胶原mRNA水平,提示ART通过下调前胶原mRNA表达,而下调胶原蛋白合成的能力是有限的,可能还通过转录后机制调控其胶原蛋白的水平,因此,本研究进一步检测了可特异性降解Ⅰ型胶原蛋白的MMP1的基因水平。结果发现,150μmol·L-1以上浓度的 ART作用后,MMP1的表达明显上调,且随着ART浓度的上升,促进作用逐步增强。从而推测ART可能一方面通过下调Ⅰ型胶原的前胶原mRNA,使其合成减少;与此同时,通过上调MMP1的表达,加速胶原的降解。
综上,本实验提示了ART能抑制人皮肤瘢痕成纤维细胞的增殖,并可下调其促纤维化因子CTGF的水平,上调胶原降解因子MMP1的表达,从而抑制细胞外胶原基质的沉积,发挥抗瘢痕纤维增生及胶原沉积的作用。但是,细胞因子网络错综复杂,ART是否还可通过调节其他细胞因子而抑制增生性瘢痕,有待继续探索。
参考文献:
[1]胡大海,刘佳琦.任重道远:进一步加强瘢痕的基础与临床研究[J].中华烧伤杂志,2011,27(6):407-10.
[1]Hu D H,Liu JQ.A long way to go in scar research-further enhancement of basic and clinical research of the scar[J].Chin J Burns,2011,27(6):407-10.
[2]Gauglitz G G,Korting H C,Pavicic T,et al.Hypertrophic scarring and keloids:pathomechanisms and currentand emerging treatment strategies[J].Mol Med,2011,17(1-2):113-25.
[3]陆金健.青蒿素类化合物抗肿瘤研究进展[J].中国药理学通报,2010,26(6):818-20.
[3]Lu J J.Progress in the research on the anti-cancer activity of artemisin in compounds[J].Chin Pharmacol Bull,2010,26(6):818-20.
[4]来丽娜,杨柳絮,郭春花,等.青蒿琥酯抗大鼠免疫性肝纤维化的作用及机制研究[J].中国药理学通报,2011,27(1):125-9.
[4]Lai L N,Yang L X,Guo C H,et al.Effects and mechanisms of artesunate on immunological hepatic fibrosis in experimental rats[J].Chin Pharmacol Bull,2011,27(1):125-9.
[5]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,2007:58-9.
[5]Situ Z Q,Wu J Z.Cell culture[M].Xi’an:World Publishing Corporation,2007:58-9.
[6]蔡景龙.现代瘢痕学[M].北京:人民卫生出版社,2008:25.
[6]Cai J L.Contemporary cicatrix medicine[M].Beijing:People′s Medical Publishing House,2008:25.
[7]农晓琳,陈 洪,陈石海,等.青蒿素、青蒿琥酯抗皮肤瘢痕的研究[J].中华皮肤科杂志,2009,42(6):421-4.
[7]Nong X L,Chen H,Chen SH,et al.Artemisinin and artesunate cream in the prevention and treatmentofhypertrophic scar in rabbit ears[J].Chin JDermatol,2009,42(6):421-4.
[8]肖 亮,贺光照,余泽浩,等.人瘢痕疙瘩成纤维细胞相关基因表达及青蒿琥酯的作用[J].中华烧伤杂志,2013,29(2):185-90.
[8]Xiao L,He G Z,Yu Z H,et al.Expressions of the related genes in fibroblasts of human keloid and the effect of artesunate[J].Chin JBurns,2013,29(2):185-90.
[9]Penn JW,Grobbelaar A O,Rolfe K J.The role of the TGF-beta family in wound healing,burns and scarring:a review[J].Int J Burns Trauma,2012,2(1):18-28.
[10]Sun X,Phan T N,Jung SH,et al.LCB 03-0110,a novel pandiscoidin domain receptor/c-Src family tyrosine kinase inhibitor,suppresses scar formation by inhibiting fibroblast and macrophage activation[J].JPharmacol Exp Ther,2012,340(3):510-9.
[11]Nakerakanti SS,Bujor A M,Trojanowska M.CCN2 is required for the TGF-beta induced activation of Smad1-Erk1/2 signaling network[J].PLoSOne,2011,6(7):e21911.
[12]Visse R,Nagase H.Matrixmetalloproteinasesand tissue inhibitors ofmetalloproteinases:structure,function,and biochemistry[J].Circ Res,2003,92(8):827.

