具有酪氨酸酶抑制作用的酵母多肽的分离纯化及分子量分布
吴悦,刘学,唐蔚,曹光群
(江南大学化学与材料工程学院,江苏无锡 214122)
酪氨酸酶是一种75 KDa含铜酶,来源于胚胎神经鞘细胞,是黑色素代谢反应的主要限速酶。近年来,天然短肽物质因具有良好的酪氨酸酶活性抑制作用和很高的安全性而成为人们关注的热点。Zhuang等[1]采用胰蛋白酶水解水母蛋白,分离纯化后得到具有酪氨酸酶抑制活性的多肽(JCP),其分子量分布为400~1 200 Da。Chen等[2]研究显示,酸奶乳清中含有能较好抑制酪氨酸酶活性的多肽。酵母多肽是酵母蛋白经生物酶解后分离纯化得到的生物活性多肽,国内对酵母多肽的研究主要集中在抗高血压性、抗氧化性方面等[3-4],有关酵母多肽的酪氨酸酶活性抑制作用研究相对较少。彭宁等[5]研究显示,酵母提取物中含对酪氨酸酶和黑色素细胞具有抑制作用的活性物质,指出具有抑制活性的物质可能为多肽组分,可将其开发应用于皮肤的美白护肤品中,但并未对具有酪氨酸酶抑制活性的成分作进一步剖析。更未有研究涉及探究具有抑制酪氨酸酶抑制活性的酵母多肽的分子量分布。
本实验以酪氨酸酶活性抑制率为检测指标,先将酵母多肽粗制品溶液(CPYP)进行超滤,进而比较不同分子量范围的多肽对酪氨酸酶抑制活性的影响,再将抑制酪氨酸酶活性最高的组分依次采用DEAE-52 Cellulose阴离子柱层析法、Sephadex-15凝胶柱层析法分离,收集各洗脱组分并进行活性检测,确定具有最佳活性的洗脱组分。通过高效液相空间排阻色谱法(SEC-HPLC)测定酪氨酸酶抑制多肽的分子量分布。为酵母多肽在功能性食品及化妆品领域的应用提供实验依据,也为进一步开发特定功能的酵母多肽奠定理论基础。
1 实验部分
1.1 试剂与仪器
CPYP,自制;酪氨酸酶、熊果苷均为生化试剂;DEAE-52阴离子纤维树脂;G-15葡聚糖凝胶;酪氨酸、Tris、盐酸、磷酸氢二钠、磷酸二氢钠均为分析纯。
HH·S/1-1S数显式电热恒温水浴锅;R-201旋转蒸发器;SHB-III循环水式多用真空泵;LGJ-10真空冷冻干燥机;Avanti J-E多用途高效离心机;UF-101超滤系统;AKTA蛋白质分析仪;TU-1900双光束紫外-可见分光光度计;Waters600高效液相色谱仪。
1.2 酵母多肽的分离纯化
1.2.1 超滤法 将CPYP依次通过截留分子量为10 KDa、5 KDa和1 KDa的超滤膜,分别获得分子量处于 >10 KDa、5~10 KDa、1~5 KDa、<1 KDa的4个组分(记为 YP1、YP2、YP3、YP4)。分别进行冷冻干燥。取适量干燥物以去离子水配制成5 mg/mL的溶液,测定酪氨酸酶活性的抑制效果。
1.2.2 DEAE-52 Cellulose阴离子交换柱层析 根据1.2.1节实验结果,取YP4样品25 mg溶于5 mL Tris-HCl缓冲溶液 A(10 mmol/mL,pH 8.5)中,配制成浓度为5 mg/mL的溶液。用DEAE-52 Cellulose阴离子交换层析法进一步分离纯化。采用梯度洗脱方式:洗脱液B为含0.1~0.8 mol/L NaCl的缓冲液A,进样量为5 mL,流速为0.5 mL/min,检测波长为220 nm,收集各峰组分,并对各峰组分的抑制活性进行比较。取抑制活性最高的峰组分冷冻干燥,备用。
1.2.3 Sephadex G-15凝胶柱层析 将Sephadex G-15凝胶在室温下以蒸馏水溶胀24 h,装柱,以超纯水对凝胶层析柱进行平衡。取1.2.2节中冷冻干燥样品适量溶于超纯水中,以0.22 μm微孔滤膜过滤,进样,进样量为1 mL,以超纯水进行洗脱,流速为0.5 mL/min,检测波长为220 nm,收集各峰组分,并检测各峰组分对酪氨酸酶活性的抑制作用。取抑制活性最高的峰组分冷冻干燥,备用。
1.3 分析方法
1.3.1 SEC-HPLC测定相对分子质量分布 冷冻干燥样品溶于超纯水中,采用高效液相空间排阻色谱法测定其分子量分布,条件如下:色谱柱为TSK gel 2000 SWXL(300 mm ×7.8 mm),柱温30 ℃,流动相乙腈/水/三氟乙酸 =45/55/0.1(体积比),流速0.5 mL/min,检测波长 220 nm。
以细胞色素 C(MW 12 500)、杆菌酶(MW 1 450)、乙 氨 酸-乙 氨 酸-酪 氨 酸-精 氨 酸(MW 451)和乙氨酸-乙氨酸-乙氨酸(MW 189)为相对分子质量标准品,作相对分子量校正曲线。
1.3.2 酪氨酸酶抑制活性测定[6]按表1中所列的各反应液组分的体积以微量移液器依次准确吸取磷酸缓冲液(pH=6.8)、样品溶液及酪氨酸酶溶液(100 μg/mL)置于试管中。将试管置于恒温水浴锅中,37℃ 恒 温 10min。分 别 加 入 0.5mL(8 mmol/L)L-酪氨酸,摇匀,继续于37℃下恒温反应20 min。取出,将反应液迅速移入比色皿中,在475 nm处测定吸光值ODA、ODB、ODC和ODD。进行3次平行实验,按下式计算样品的酪氨酸酶抑制率(X)。

2 结果与讨论
2.1 超滤法截留组分的酪氨酸酶抑制活性
CPYP经超滤法得到的4个截留组分 YP1、YP2、YP3和YP4的酪氨酸酶抑制活性结果见表2。
表2 超滤法各截留组分的酪氨酸酶抑制率±s)Table 2 Tyrosinase inhibition ofultrafiltration fractions±s)
组分 抑制率/%YP1 25.39 ±1.5 YP2 30.25 ±2.7 YP3 41.67 ±3.68 YP4 58.17 ±2.1
由表2可知,各分子段截留组分的活性随着相对分子质量的减小而增大,相对分子质量低于1 KDa的组分活性最高。这可能是因为随着酵母蛋白被蛋白酶的逐步降解,肽段数量不断增加,酵母多肽的相对分子质量不断下降,在一定范围内,其活性位点的暴露量不断增加,从而使其活性也相应的增加。
2.2 DEAE-52阴离子交换柱层析
YP4组分进行纤维素DEAE-52阴离子柱交换层析色谱进行分离,结果见图1。

图1 YP4组分的纤维素DEAE-52阴离子交换色谱图Fig.1 Chromatogram of fraction YP4 by DEAE-52 anion exchange chromatography
由图1可知,DEAE-52阴离子交换层析柱分离纯化主要得到 a、b、c、d、e、f、g 7 个峰组分。分别收集各峰组分,除盐后冷冻干燥为粉末。取各峰粉末溶解于去离子水中,配制成浓度为5 mg/mL的水溶液,分别测定其酪氨酸酶抑制效果,结果见图2。
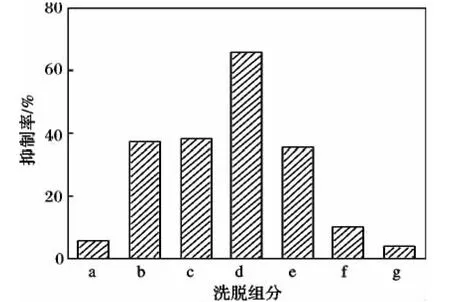
图2 DEAE-52阴离子柱分离得到的各组分的酪氨酸酶抑制活性Fig.2 Tyrosinase inhibition of each fraction by DEAE-52 anion exchange chromatography
由图2可知,峰组分d对酪氨酸酶的抑制活性最高,抑制率为65.9%(5 mg/mL),且各洗脱峰的酪氨酸酶抑制率有明显差异,说明纤维素DEAE-52阴离子交换层析柱对活性多肽有较好的分离作用。收集活性最高组分d并进行浓缩和冷冻干燥,用于下一步分析。
2.3 Sephadex G-15凝胶柱层析
d组分多肽液以Sephadex G-15凝胶柱进一步分离,分别收集各信号峰相应的洗脱液(依次编号为 d-1、d-2、d-3、d-4),色谱结果见图3。

图3 组分d的Sephadex G-15凝胶层析色谱图Fig.3 Chromatogram of fraction d by Sephadex G-15 gel chromatography
将各组分分别浓缩并冷冻干燥,以去离子水配制成浓度为4 mg/mL的溶液,测定其对酪氨酸酶活性的抑制效果,结果见图4。

图4 Sephadex G-15凝胶层析得到的各组分的酪氨酸酶抑制活性Fig.4 Tyrosinase inhibition of each fraction by Sephadex G-15 gel chromatography
由图4可知,d-1的酪氨酸酶抑制活性最高,抑制率为68.57%(4 mg/mL),具有较高的酪氨酸酶抑制活性。多肽呈现一定的酪氨酸酶抑制作用,可能与其减缓氧化反应进程[7]和对酪氨酸酶活性中心的 Cu2+的绑定[8]有一定的关系。Cristina[9]指出,肽链的长度可能影响多肽对活性中心Cu2+的绑定,肽链太短,绑定不够稳定,而不利于多肽和酪氨酸酶的结合。d-1对酪氨酸酶具有较好抑制作用可能是由于组分d-1分子量较其他洗脱组分更大,肽链较长而更利于d-1和酪氨酸酶的结合所致。
2.4 分子量测定
采用TSKgel 2000 SWXL分析d-1组分中多肽的相对分子量分布,根据标准品相对分子质量校正曲线回归方程 logMW=6.724 -0.235 T,R2=0.991,d-1组分相对分子质量分布见图5。
由图5可知,具有酪氨酸酶抑制活性的多肽分子量主要分布在200~800 Da。根据氨基酸平均分子量为128 Da,多肽组分为2~8个氨基酸组成的肽为主。多肽结构复杂,其酪氨酸酶抑制活性一方面可能与其特定氨基酸组成密切相关;另一方面,还可能与其氨基酸组成序列有关。Marloes Schurink等[10]指出,具有较好酪氨酸酶抑制活性的多肽通常含由一个甚至多个精氨酸残基和(或)苯丙氨酸残基再连接缬氨酸、丙氨酸或亮氨酸等疏水性氨基酸组成。酵母活性肽的氨基酸组成及结构有待进一步探索。

图5 d-1组分的HPLC分子量分布图Fig.5 Molecular weight distribution profile of fraction d-1 by HPLC
2.5 酪氨酸酶抑制活性
分别取不同浓度的d-1和熊果苷溶液,测定对酪氨酸酶活性的抑制效果,结果见图6。

图6 d-1、熊果苷质量浓度对酪氨酸酶活性的影响Fig.6 Effect of arbutin and fraction d-1 on tyrosinase activity
由图6可知,在一定浓度范围内,组分d-1对酪氨酸酶表现出明显的抑制作用,且抑制率随浓度的增加而逐渐升高,其IC50值为3.53 mg/mL。同样,作为对照的高效酪氨酸酶抑制剂熊果苷,也表现出随浓度的增加抑制率上升的趋势。不同的是熊果苷单位浓度的抑制率高于 d-1组分,其 IC50值为0.22 mg/mL。研 究 显 示[11],熊 果 苷 浓 度 超 过250 μg/mL时,将呈现明显的细胞毒性,而酵母多肽被广泛开发用于抗血压食品中[12-13],其安全性毋庸置疑。酵母多肽作为纯天然酪氨酸酶抑制剂,有望开发作为美白化妆品添加剂,美白皮肤,同时起到减少皮肤刺激及补充皮肤营养的功效。
3 结论
实验表明,分子量在1 KDa以内的酵母多肽具有最高的酪氨酸酶抑制活性。YP4经DEAE-52 Cellulose阴离子交换层析和Sephadex G-15凝胶层析分离纯化后,分离出对酪氨酸酶具有较高抑制活性的组分d-1,其IC50值为 3.53 mg/mL,主要为相对分子质量在200~800 Da范围内的多肽组分。酵母多肽的酪氨酸酶抑制机理和分离纯化还有待进一步研究。
[1]Zhuang Yongliang,Sun Liping,Zhao Xue,et al.Antioxidant and melanogenesis-inhibitory activities of collagen peptide from jellyfish(Rhopilema esculentum)[J].J Sci Food Agric,2009,89:1722-1727.
[2]Chen M J,Liu J R,Sheu J F,et al.Study on skin care properties of milk kefir whey[J].Asian-Australasian Journal of Animal Sciences,2006,19(6):905-908.
[3]倪贺.酵母来源血管紧张素转移酶抑制多肽的制备及其抑制机理的研究[D].广州:华南理工大学,2012.
[4]孙伟峰.酵母活性肽制备及其抗氧化活性研究[D].北京:中国农业科学院,2009.
[5]彭宁,张海波,张彦.酵母提取物对多酚氧化酶及黑素瘤细胞的抑制作用[J].香料香精化妆品,2013,6(3):24-26.
[6]Jin-Mi No,Seon-yeong Kwak,Do-Hyun Kim,et al.Kojic acid-tripeptide amide as a new tyrosinase inhibitor[J].Peptide Science,2006,88(2):300-306.
[7]You-Jung Kim.Antimelanogenic and antioxidant properties of gallic acid[J].Biological and Pharmaceutical Bulletin,2007,30:1052-1055.
[8]Ernest V Curto,Cecil Kwong,Heino Hermersdorfer,et al.Inhibitors of mammalian melanocyte tyrosinase:In vitro comparisons of alkyl esters of gentisic acid with other putative inhibitors [J].Biochemical Pharmacology,1999,57:663-672.
[9]Cristina Megías,Justo Pedroche,Maria M Yust,et al.Affinity purification of copper chelating peptides from chickpea protein hydrolysates[J].Journal of Agricultural and Food Chemistry,2007,50(10):3949-3954.
[10]Schurink Marloes,Berkel Willem J H van,Wichers Harry J,et al.Novel peptides with tyrosinase inhibitory activity[J].Peptides,2007,28:485-495.
[11]吴品茹.三种美白剂对B16细胞黑色素合成影响的研究[D].上海:上海交通大学,2008.
[12]Osamu Kanauchi,Kiharu Igarashi,Rie Ogata,et al.A yeast extract high in bioactive peptides has a blood-pressure lowering effect in hypertensive model[J].Current Medicinal Chemistry,2005,12:3085-3090.
[13]Ni He,Li Lin,Guo Shasha,et al.Isolation an identification of an angiotensin I-converting enzyme inhibitory peptide from yeast(Saccharomyces cerevisiae)[J].Current Analytical Chemistry,2012,8(1):180-185.

