聚癸二酸丙三醇酯的合成及电纺支架的制备
刘晓吉,李文博,张树江,包广洁,康宏
(1.兰州大学口腔医学院,甘肃兰州 730000;2.兰州大学化学化工学院生物化工及环境技术研究所功能有机分子化学国家重点实验室,甘肃兰州 730000;3.西北民族大学国家民委口腔医学重点实验室,甘肃兰州 730000)
可生物降解高分子聚合体由于具有优良的生物相容性、力学性能和可降解性,在生物科学技术领域如组织工程、药物载体和体内生物信号传导等方面得到广泛的运用[1-5]。特别是在组织工程领域中,非线性三维网状高分子聚合体支架的优异性能对组织再造产生了极其重要的意义。
静电纺丝是一种制备组织工程支架的常用方法,具有操作简便、成本低廉、结果可控的优点,且能直接制备出连续多孔的三维立体支架,有利于组织工程体系的成功构建[6-8]。
本文采用两种不同摩尔比的原料合成可生物降解聚酯弹性体PGS,并进行性能测定和静电纺丝支架的制备,讨论PGS运用于组织工程支架材料的理化潜力和生物学可行性。
1 实验部分
1.1 材料与仪器
丙三醇、癸二酸、四氢呋喃均为分析纯;左旋聚乳酸(PLLA,Mn=50 000,Mw=67 000,Mw/Mn<1.4),医用级;六氟异丙醇(HFIP),纯度>99%。
PL-GPC220型凝胶渗透色谱仪;RINT2000S型傅里叶变换红外光谱仪;C2000型接触角测量仪;CMT4104型电子拉力机;DT-1003型静电纺丝机;30TMPESEM扫描电镜。
1.2 聚癸二酸丙三醇酯的合成[9-10]
将丙三醇、癸二酸分别以1∶1,1∶2摩尔比置于三颈瓶中,常压下通入氮气,加热到130℃,维持3 h,减压脱水1 h,冷却后真空干燥24 h,得到PGS。
1.3 静电纺丝[11-12]
将等比合成的PGS和左旋聚乳酸(PLLA)以25∶75质量比共混,六氟异丙醇(HFIP)为溶剂,配制成质量浓度为25%的溶液,在磁悬浮搅拌器上以250 r/min的速度搅拌24 h,使溶质均匀溶解。应用静电纺丝机,设置参数电压为15 kV,溶液流速为1 mL/h,选用27 G的针头且针头距离接收装置的距离为12 cm,将溶液制备成三维多孔的组织工程支架材料。
1.4 性能测定
1.4.1 凝胶渗透色谱(GPC)分析 将试样溶于溶剂四氢呋喃,去掉不溶物,剩余物质用凝胶渗透色谱仪进行分析。
1.4.2 傅里叶红外光谱(FTIR)分析 将1 mg样品研磨均匀,应用压片机制成几乎透明的圆片,使用傅里叶变换红外光谱仪进行分析。
1.4.3 亲水性能 试样厚为1 mm,使用接触角测量仪测量在空气中试样表面的静态水接触角。
1.4.4 降解性能 在37℃下,将PGS(1∶1)和PGS(1∶2)各4组分别称重并将其溶于磷酸盐缓冲液(PBS),每36 h换一次液体,每隔5 d取出放置于真空干燥箱中至质量恒定,称重并计算其质量损失率。
1.4.5 力学性能 用电子拉力机对厚1 mm,宽2 mm哑铃形试样进行测试,拉伸速度为10 mm/min,拉伸前施加0.5 N的预压力。
2 结果与讨论
2.1 凝胶渗透色谱分析
2种PGS的凝胶渗透色谱分析见图1。

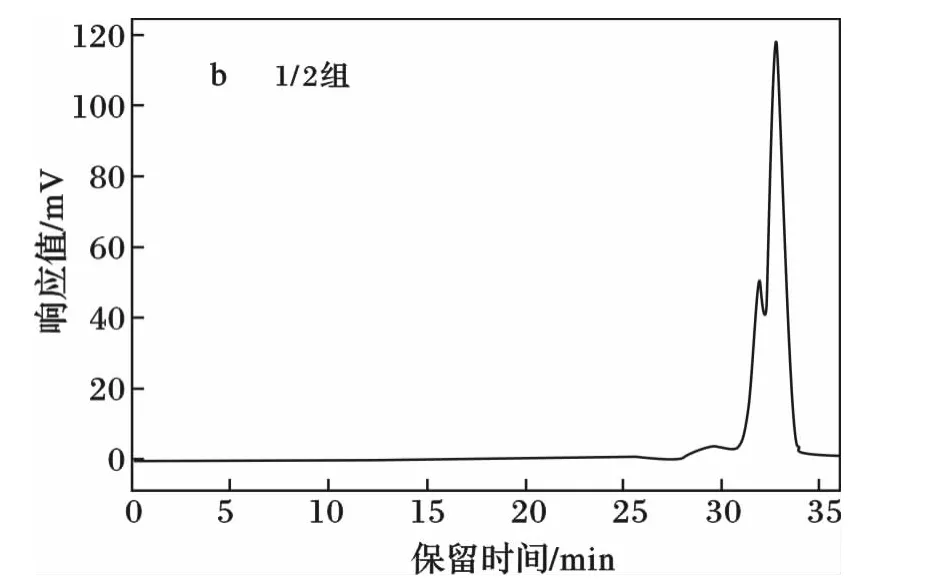
图1 PGS的凝胶渗透色谱(GPC)分析Fig.1 GPC curves of PGS

表1 PGS的凝胶渗透色谱(GPC)分析结果Table 1 GPC results of sol parts of PGS
如图1和表1,以1∶1比例的丙三醇和癸二酸合成的PGS相对分子质量为1 027 g/mol,而1∶2比例合成的PGS相对分子质量为2 277 g/mol,因为等比熔融聚合形成的PGS聚合物,存在大量未反应的羟基并形成氢键,而随着癸二酸用量的增多,未反应的羟基减少,酯化反应更加的完全,相对分子质量增大。总体上来说,由丙三醇癸二酸熔融缩聚法合成的PGS是一个低交联聚合体系。
2.2 傅里叶红外光谱(FTIR)分析
2种PGS的傅里叶红外光谱(FTIR)分析见图2。
由图2可知,聚合物在约3 500 cm-1处宽吸收峰为羟基缔合氢键的伸缩振动吸收峰,1 800 cm-1处窄峰为酯羰基的伸展振动吸收峰,通过2个峰的相对强度可以看出,等比聚合的PGS材料含有大量未参与酯化反应的羟基,从而缔合成为氢键;1∶2比例聚合的PGS的羟基吸收峰低矮,而酯羰基的吸收峰高耸,表明这组丙三醇羟基的酯化度加强,游离羟基减少。

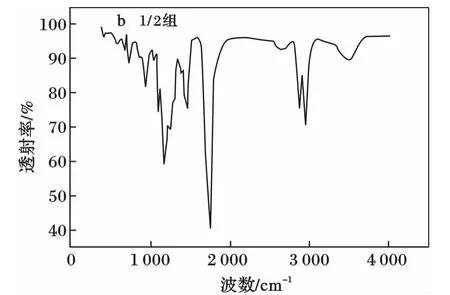
图2 2种PGS的傅里叶红外光谱图Fig.2 FTIR spectrum of two kinds of PGS
2.3 亲水性能
2种PGS的接触角测量结果见表2。

表2 2种PGS的接触角测量结果Table 2 Contact angle results of two kinds of PGS
由表2可知,PGS(1∶1)组的接触角为 38.4°,PGS(1∶2)组为40.5°,2 种 PGS 材料的接触角都 <90°,表明PGS材料是亲水的,且随着癸二酸用量的增加,接触角增大,亲水性降低。原因如下:随着癸二酸用量增多,聚合度增大,剩余亲水的丙三醇羟基基团减少,亲水性下降,且癸二酸的长碳链自身疏水性较高,增多其用量必定降低亲水性。所以,PGS(1∶1)的亲水性更强。
2.4 降解性能
2种PGS的质量损失率曲线见图3。
由图3可知,在最初的阶段,PGS的质量损失率增长较快,到第5 d后,增长逐渐变慢,到达第10 d,PGS(1∶1)组的曲线更是趋近于平缓,质量损失率渐渐稳定。由此可见,PGS(1∶1)组更适宜用于制备组织工程支架。
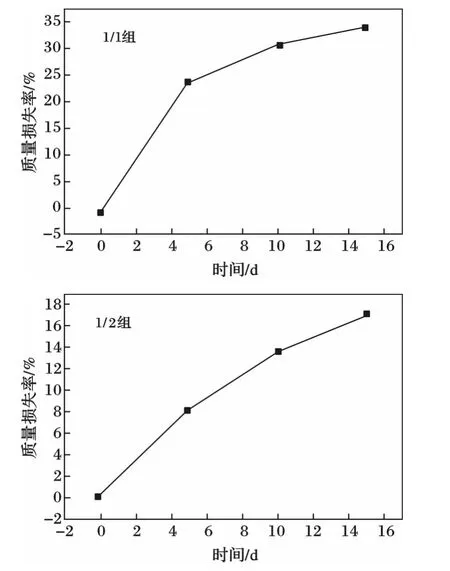
图3 2种PGS的质量损失率曲线Fig.3 Curves of mass loss rate and time of two kinds of PGS
2.5 力学性能
2种PGS的拉伸测试曲线见图4。
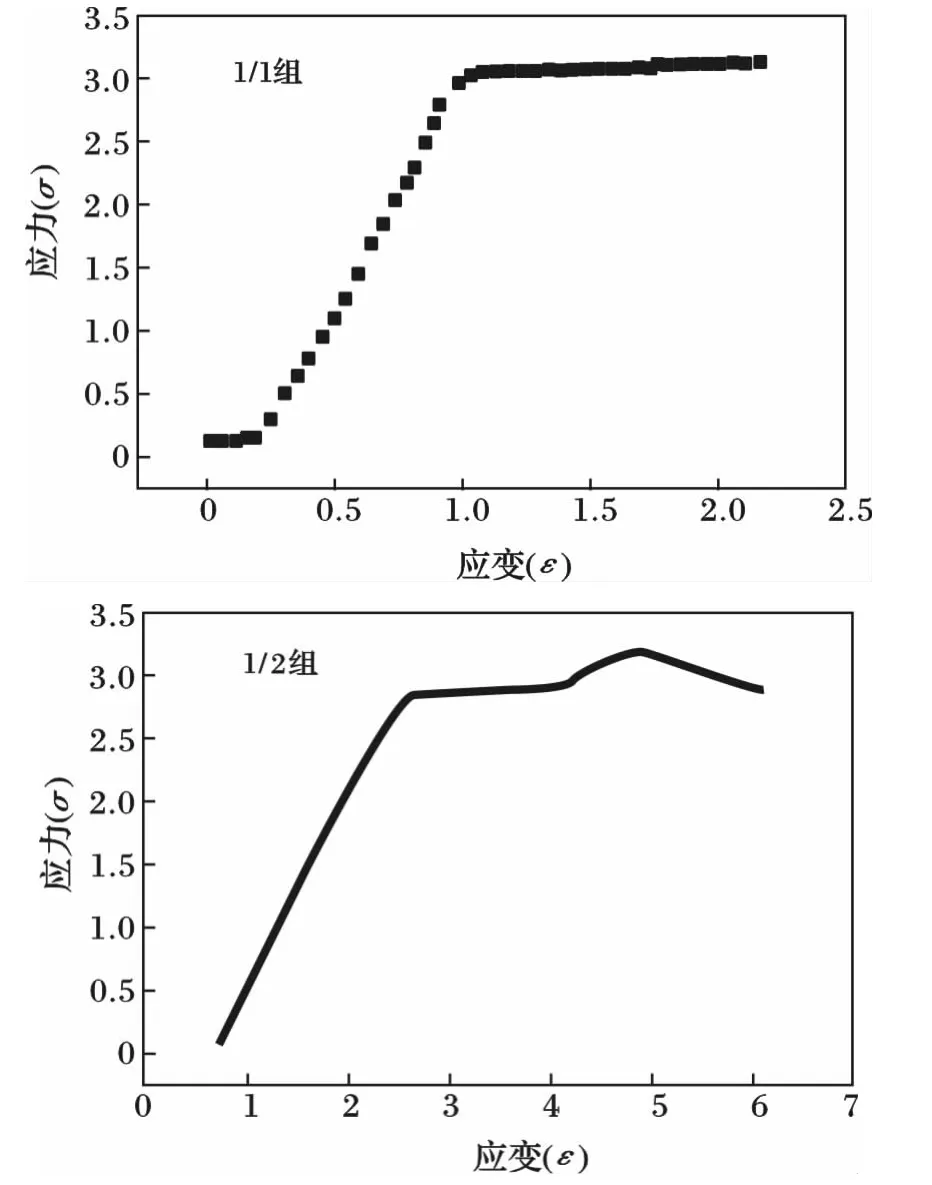
图4 2种PGS的拉伸测试曲线Fig.4 The curves for the tensile test of two kinds of PGS
由图4可知,PGS是一种非线性的弹性材料,弹性模量较低,当应力达到一定值后,即使不再变化或者轻微增大,应变仍然继续增大,试样继续伸长,出现屈服现象,PGS的这种力学性能阻碍其作为支架材料应用于组织工程,这也是后文应用聚乳酸与其共混电纺的主要原因。
2.6 静电纺丝
聚乳酸被广泛应用于组织工程及其他生物医学领域,是最早获得美国FDA认证的生物材料。PGS和PLLA两种材料各有优缺点:聚乳酸结构中缺乏亲水性基团,使其材料表面产生了强疏水性,严重地影响了它与细胞的亲和性,使它在某些领域尤其是组织工程领域的应用受到限制,但是,聚乳酸质硬脆,具有较高的机械强度;PGS有着优良的生物相容性,可纺性,但机械强度差。本课题组采用PGS和PLLA共混进行静电纺丝,将这两种材料的优点整合,通过PLLA使支架的力学性能得到提高,通过PGS使支架材料的弹性模量降低,断裂伸长率提高,改善支架材料延展性及亲水性能,从而获得综合性能优异的支架材料。
静电纺丝支架的扫描电镜图见图5。

图5 静电纺丝支架的扫描电镜图Fig.5 SEM picture of electrostatic spinning scaffords
由图5可知,静电纺丝PGS支架表面疏松多孔,结构三维立体,空隙大小在20~100 μm,比较均匀,支架中的孔隙大部分为开放型的结构,是种子细胞引入以及种子细胞生长所需养分进入和代谢产物排出所必需的通路,能满足组织工程细胞的生长需求。支架材料的机械性能和生物相容性仍需要进一步的实验研究。
3 结论
系统地研究了2种不同比例的丙三醇、癸二酸合成的PGS材料的结构性能,等比合成的PGS亲水性能良好,降解速率适当,且具有一定的热加工性能,用它和PLLA共混进行静电纺丝,构建了三维多孔的组织工程支架,为组织工程的支架材料队伍增添了优秀的一员,有待于应用合成的支架材料构建组织工程体系。
[1]Bodakhe S,Verma S,Garkhal K,et al.Injectable photocrosslinkable nanocomposite based on poly(glycerol sebacate)fumarate and hydroxyapatite:Development,biocompatibility and bone regeneration in a rat calvarial bone defect model[J].Nanomedicine,2013,8(11):1777-1795.
[2]Zaky S H,Lee K W,Gao J,et al.Poly(glycerol sebacate)elastomer:A novel material for mechanically loaded bone regeneration[J].Tissue Eng Part A,2014,20(1/2):45-53.
[3]Masoumi N,Johnson K L,Howell M C,et al.Valvular interstitial cell seeded poly(glycerol sebacate)scaffolds:Toward a biomimetic in vitro model for heart valve tissue engineering[J].Acta Biomater,2013,9(4):5974-5988.
[4]Mitsak A G,Dunn A M,Hollister S J,et al.Mechanical characterization and non-linear elastic modeling of poly(glycerol sebacate)for soft tissue engineering[J].J Mech Behav Biomed Mater,2012,11:3-15.
[5]Li Yuan,Huang Wenchao,Wayne D Cook,et al.A comparative study on poly(xylitol sebacate)and poly(glycerolsebacate):Mechanicalproperties,biodegradation and cytocompatibility[J].Biomed Mater,2013,8(3):035006.
[6]Rayatpisheh S,Heath D E,Shakouri A,et al.Combining cell sheet technology and electrospun scaffolding for engineered tubular,aligned,and contractile blood vessels[J].Biomaterials,2014,35(9):2713-2719.
[7]He X,Xiao Q,Lu C,et al.Uniaxially aligned electrospun all-cellulose nanocomposite nanofibers reinforced with cellulose nanocrystals:Scaffold for tissue engineering[J].Biomacromolecules,2014,15(2):618-627.
[8]Ghasemi-Mobarakeh L,Prabhakaran M P,Balasubramanian P,et al.Advances in electrospun nanofibers for bone and cartilage regeneration[J].J Nanosci Nanotechnol,2013,13(7):4656-4671.
[9]Wang Y D,Ameer G A,Sheppard B J,et al.A tough biodegrade able elastomer[J].Nat Biotechnol,2002,20(6):602-606.
[10]Gao J,Crapo P M,Wang Y D,et al.Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering[J].Tissue Eng,2006,12(4):917-925.
[11]Rajeswari Ravichandran,Jayarama Reddy Venugopal,Subramanian Sundarrajan,et al.Minimally invasive injectable short nanofibers of poly(glycerol sebacate)for cardiac tissue engineering[J].Nanotechnology,2012,23(38):385102.
[12]Xu Bing,Ben Rollo,Lincon A Stamp,et al.Non-linear elasticity of core/shell spun PGS/PLLA fibres and their effect on cell proliferation[J].Biomaterials,2013,34(27):6306-6317.

