壳聚糖希夫碱及壳聚糖改性微球的吸附性能研究
杨小玲,黄怡
(咸阳师范学院化学与化工学院,陕西咸阳 712000)
壳聚糖是迄今为止发现的唯一天然碱性多糖,分子内含有大量的官能团,如氨基和羟基等,对酚类、蛋白质、氨基酸等有机物有较强的吸附作用,并且具有良好的生物降解性、生物相容性和无毒性等特点,可以在污水处理中用作吸附剂、絮凝剂和重金属离子的螯合剂等。由于壳聚糖存在一些缺点,如耐酸性差,吸附率低,往往需要进行改性[1-4]。通过改性将壳聚糖交联成球,可以得到表面积大孔隙多的网状结构的壳聚糖微球,并提高壳聚糖在溶液中的稳定性,更有利于壳聚糖的吸附性能的发挥[5-8]。
本课题以壳聚糖为原料,制备壳聚糖希夫碱,并采用反相悬浮聚合法制备壳聚糖希夫碱微球。用静态吸附法,以壳聚糖为吸附剂,分别以磁流体及模型药物亚甲基蓝为吸附质,比较壳聚糖希夫碱及壳聚糖改性微球的吸附性能。
1 实验部分
1.1 试剂与仪器
壳聚糖,脱酰度为90%;对二甲氨基苯甲醛、冰乙酸、甲苯、亚甲基蓝均为分析纯;甲苯2,4-二异氰酸酯(TDI),化学纯。
IRPrestige-21型傅里叶变换红外光谱仪;SPECORD-50紫外可见分光光度计。
1.2 实验方法
1.2.1 壳聚糖希夫碱的制备 称取3.2 g壳聚糖,溶于200 mL 2%的醋酸溶液中,80℃下加热搅拌,滴加溶有3.0 g对二甲氨基苯甲醛的乙醇溶液,反应5 h,冷却,抽滤,洗涤,干燥,得壳聚糖希夫碱。
1.2.2 四氧化三铁的制备 在150 mL蒸馏水中溶解3.47 g FeCl3,将其倒入250 mL的三口烧瓶中,在恒温水浴30℃下反应20 min,缓慢加入60 mL 8.43 g/L的 Na2SO3,经过 20 min 后,再快速加入60 mL 233.33 g/L的NaOH,将水浴升温至55℃,继续反应15 min,再升温至80℃,反应30 min后,得灰棕色液体,冷却,离心,除去上层清液,得四氧化三铁磁流体。
1.2.3 壳聚糖希夫碱微球的制备[9-10]称取1.0 g壳聚糖希夫碱,加入到25 mL 0.5%的NaOH溶液中浸泡数小时,作为水相。将20 mL环己烷、20 mL甲苯以及定量Span-60和Tween-20加入到250 mL三口瓶中,加热搅拌,使乳化剂完全溶解,作为油相。70℃时将水相滴加到油相中,再加TDI 8滴,同时搅拌,回流反应2 h,得到黄色乳液,离心,除去上层油相,用蒸馏水多次洗涤,50℃真空干燥,得到壳聚糖希夫碱微球。
1.3 壳聚糖希夫碱及希夫碱微球的吸附性
1.3.1 对四氧化三铁磁粉吸附 称取0.15 g壳聚糖希夫碱及希夫碱微球分别溶胀于2个100 mL蒸馏水中,加入1.0 g四氧化三铁,静置吸附,磁分离,得产物,即磁性/壳聚糖希夫碱及磁性希夫碱微球。称取磁性/壳聚糖希夫碱及磁性微球各0.1 g,用邻二氮菲分光光度法分别测定其磁含量。

式中 W——磁含量,mg/g;
C——Fe2+浓度,mg/L;
V——Fe2+溶液体积,L;
m——磁性壳聚糖希夫碱或磁性微球质量,g。
1.3.2 对亚甲基蓝的吸附 配制亚甲基蓝标准溶液,在其最大吸收波长668 nm处测定溶液的吸光度,绘制标准曲线,得出标准曲线方程y=0.154 9x+0.046 5(R2=0.996 2)。
称取0.2 g壳聚糖希夫碱和壳聚糖希夫碱微球各2份,分别加入100 mL浓度为40 mg/L的亚甲基蓝溶液中,吸附3 h时取上清液10 mL,同时补充原液,在668 nm波长处测上清液的吸光度,用以下公式计算吸附量Q及吸附率η。

式中 Q——吸附量,mg/g;
C0、C——分别为吸附前、后溶液中亚甲基蓝的质量浓度,mg/L;
m——吸附剂质量,g;
V——亚甲基蓝溶液体积,L。
1.4 希夫碱及微球中磁含量测定
用邻二氮菲分光光度法,分别配制浓度为1.0,2.0,3.0,4.0,5.0 mg/L 的 Fe2+溶液,测定吸光度,得到浓度-吸光度标准曲线方程 y=0.004 7x-0.002 5(R2=0.997 2)。
2 结果与讨论
2.1 红外测定结果
壳聚糖、希夫碱及微球的红外测试结果见图1。
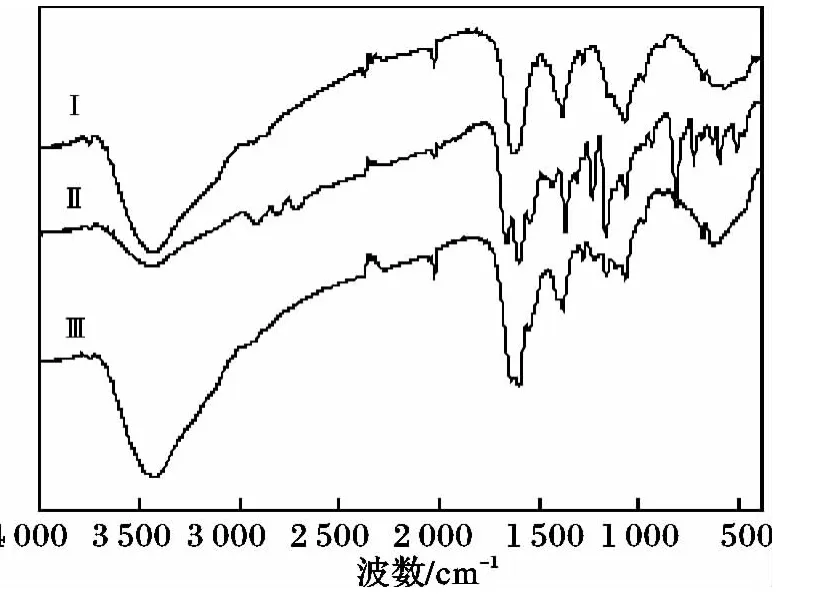
图1 壳聚糖与壳聚糖希夫碱及微球的红外谱图Fig.1 IR spectrum of CS and its Schiff base

2.2 磁含量测定结果
根据标准曲线方程计算,当以壳聚糖希夫碱为吸附剂时,溶液中Fe2+离子含量为2.850 mg/g,用公式(1)换算为四氧化三铁的吸附容量为39.279 mg/g;而希夫碱微球中,Fe2+离子含量为8.212 mg/g,换算为四氧化三铁的吸附容量为113.179 mg/g。结果表明,形成微球后的壳聚糖希夫碱对金属离子的吸附性要明显优于单纯的壳聚糖希夫碱,这是由于壳聚糖交联成的微球中有丰富孔隙结构,有利于提高吸附量,同时形成的空间网络结构通过键合作用提高吸附四氧化三铁的稳定性。
2.3 对亚甲基蓝吸附结果
2.3.1 中性水溶液动力学吸附 常温下,在不同时间,当亚甲基蓝浓度为40 mg/L时,壳聚糖希夫碱及希夫碱微球对亚甲基蓝的吸附结果见图2。
由图2可知,壳聚糖希夫碱与希夫碱微球对亚甲基蓝的吸附随着时间推移吸附率上升,从开始到30 min,吸附速率较快,30 min后吸附速率逐渐缓慢,到120 min后趋于平衡,150 min时均达到吸附平衡。当亚甲基蓝的初始浓度为40 mg/L,吸附剂浓度为2 g/L时,达到饱和吸附,壳聚糖希夫碱及希夫碱微球对亚甲基蓝的吸附率分别为60.7%和68.63%。在同一时间,壳聚糖希夫碱微球的吸附率总是大于壳聚糖希夫碱。
2.3.2 热力学吸附 图3、图4给出了壳聚糖希夫碱以及壳聚糖希夫碱微球对亚甲基蓝的吸附容量及吸附率随溶液中亚甲基蓝浓度的变化情况。

图3 亚甲基蓝溶液初始浓度对吸附容量影响Fig.3 Effect of the initial methylene blue concentration on adsorption capacity of methylene blue

图4 亚甲基蓝溶液浓度对吸附率的影响Fig.4 Effect of the initial methylene blue concentration on adsorption rate of methylene blue
由图3、图4可知,随着亚甲基蓝浓度的增大,壳聚糖希夫碱及希夫碱微球的吸附容量均不断增大,而吸附率出现一个极大值。除了初始浓度10 mg/L时,壳聚糖希夫碱的吸附率高之外,其他亚甲基蓝溶液浓度相同的情况下,壳聚糖希夫碱微球的吸附容量及吸附率均大于壳聚糖希夫碱。当亚甲基蓝浓度为50 mg/L时,壳聚糖希夫碱及希夫碱微球对亚甲基蓝的吸附容量分别为 15.33,17.15 mg/g;二者的吸附率最大值分别是:当亚甲基蓝浓度为30 mg/L时,壳聚糖希夫碱的吸附率为76.73%;亚甲基蓝浓度为20 mg/L时,微球的吸附率为84.9%。因此整体上,微球吸附性能高于壳聚糖希夫碱。
3 结论
以壳聚糖和对二甲氨基苯甲醛为原料,制得壳聚糖希夫碱,然后以壳聚糖希夫碱为底物,制备壳聚糖希夫碱微球。并选取2种吸附对象:四氧化三铁和亚甲基蓝,比较希夫碱及其微球的吸附性能。结果表明,希夫碱及其微球对四氧化三铁的吸附为物理吸附,吸附容量分别为 39.279,113.179 mg/g,壳聚糖希夫碱及其微球对亚甲基蓝的吸附平衡时间均为150 min,饱和吸附容量随着亚甲基蓝初始质量浓度的增大而增大,且微球的吸附容量大于壳聚糖希夫碱,吸附率不随浓度增大单调递增,而是有一极大值。整体上,微球吸附性能优于壳聚糖希夫碱。
[1]张艳雅,马启敏.壳聚糖改性吸附剂的制备及其吸附性能研究[J].中国海洋大学学报,2006,36(增刊):153-156.
[2]安胜姬,张兰英,郑松志,等.二异氰酸酯与壳聚糖交联产物对金属离子的吸附性能[J].长春科技大学学报,1999,29(2):197-199.
[3]赵春禄,刘辉,刘振儒.壳聚糖的化学改性及其吸附性能的研究[J].环境化学,2005,24(2):209-212.
[4]曹佐英,赖声礼.微波辐射下甲醛交联壳聚糖的制备及其吸附性能的研究[J].现代化工,1999,19(6):24-26.
[5]苏苗,王丽丽,林强.壳聚糖/β-环糊精交联聚合物的制备及其对葛根素的吸附性能[J].过程工程学报,2011,11(6):978-983.
[6]贺小进,谭天伟,戚以政,等.球形壳聚糖树脂制备方法及吸附性能研究[J].离子交换与吸附,2000,16(l):47-53.
[7]葛华才,黄仕英,梁恺.壳聚糖改性微球的微波辐射制备及吸附性能[J].华南理工大学学报:自然科学版,2009,37(6):27-30,36.
[8]张所信,江龙法,王为国,等.球形壳聚糖希夫碱的制备及性质[J].南京化工大学学报,1999,21(6):89-91.
[9]李桂银,杨栋梁,黄可龙,等.Fe3O4/羧基改性壳聚糖复合纳米粒子的制备、表征及生物学应用[J].功能材料,2009,40(7):1184-1187.
[10]季业,邵慧萍,郭志猛,等.超声乳化法制备纳米Fe3O4磁性颗粒及壳聚糖表面改性[J].北京科技大学学报,2011,33(6):751-755.

