复方鹿角霜对胶原诱导性关节炎模型小鼠抗炎作用研究*
陈腊霞,王燕燕,孙伟光,许鑫
(1.三峡大学第一临床医学院,宜昌 443002;2.湖北省宜昌市中心人民医院药剂科,宜昌 443002;3.华中科技大学同济医学院药学院,武汉 430030;4.湖北中医药大学,武汉 430065)
复方鹿角霜对胶原诱导性关节炎模型小鼠抗炎作用研究*
陈腊霞1,王燕燕2,孙伟光3,许鑫4
(1.三峡大学第一临床医学院,宜昌 443002;2.湖北省宜昌市中心人民医院药剂科,宜昌 443002;3.华中科技大学同济医学院药学院,武汉 430030;4.湖北中医药大学,武汉 430065)
目的 观察复方鹿角霜对小鼠胶原诱导性关节炎(CIA)体内相关炎症细胞因子的表达及滑膜组织病理学的影响。方法建立小鼠CIA模型,实验小鼠随机分为5组:空白对照组,模型对照组,复方鹿角霜总膏低、高剂量组(C1,C2组),雷公藤多苷片组。小鼠第一次免疫后,观察小鼠的一般情况,记录小鼠前后足爪病变发生情况。小鼠第二次免疫后,复方鹿角霜C1、C2组分别灌胃给予复方鹿角霜总膏2.5,5 g·kg-1·d-1,雷公藤多苷片组灌胃给予雷公藤多苷片13.6 g·kg-1·d-1,连续4周。小鼠给药结束后,取血分离血清,酶联免疫吸附试验(ELISA)检测小鼠血清肿瘤坏死因子-α(TNF-α)和白细胞介素-4(IL-4)的表达水平。取小鼠足踝关节,光镜观察关节滑膜组织病理学变化。结果与模型对照组比较,复方鹿角霜C1、C2组、雷公藤多苷片组血清TNF-α均明显降低;而复方鹿角霜组血清IL-4水平升高。模型对照组关节病理可见滑膜组织增生,各给药组关节病理形态有所改善。结论复方鹿角霜可减轻胶原诱发的小鼠关节炎红肿症状,其作用机制可能与降低炎性因子TNF-α、调节抑炎因子IL-4作用有关。
鹿角霜,复方;关节炎;胶原,Ⅱ型;细胞因子
类风湿关节炎(rheumatoid arthritis,RA)是目前严重危害人类健康的自身免疫性疾病,其病因尚不明确,可能与遗传、环境及感染等因素相关。中医将类风湿关节炎归属于痹症,患者多因体虚与湿热、淤血互结,导致类风湿临床症状的产生。《金匮要略》认为营卫不和是类风湿关节炎常见病机,营卫气血即中医免疫系统,调和营卫法被广泛的用于治疗类风湿关节炎。同时现代免疫学认为,RA属于炎症性自身免疫性疾病,而以细胞因子为靶点的免疫治疗,已成为RA疾病治疗切入点。复方鹿角霜处方为宜昌市中心人民医院经验方,来源于临床有效方剂鹿角霜抗风湿复方,而其抗炎作用机制尚不明确。笔者在本实验中探讨复方鹿角霜对胶原诱导性小鼠血清肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin, IL)-4及关节组织的影响,明确其可能的抗炎作用机制,为研究复方鹿角霜的治疗作用提供实验依据。
1 材料与方法
1.1 动物 6~8周龄SPF级Balb/c小鼠,雄性,体质量(18±2)g,由湖北省疾病控制中心提供,合格证号: SCXK2008-0005。动物饲养在SPF级动物房,环境温度(22±2)℃,相对湿度(55±5)%,12 h光暗循环。所有实验均严格按照实验动物有关条例进行。
1.2 试剂 复方鹿角霜(华中科技大学同济医学院药学院研究室提取制备),雷公藤多苷片(上海复旦复华药业有限公司,批号:Z31020415),羧甲基纤维素钠(国药集团化学试剂有限公司,批号:F20101222),牛Ⅱ型胶原(Sigma公司,批号:C7806),完全弗氏佐剂(Sigma公司,批号:F5881);不完全弗氏佐剂(Sigma公司,批号: F5506);TNF-α酶联免疫吸附试验(enzyme-linked immuno-sorbent assay,ELISA)试剂盒(武汉博士德生物技术有限公司,批号:EK0527);IL-4 ELISA试剂盒(武汉博士德生物技术有限公司,批号:EK0405)。
1.3 主要仪器 电子天平(沈阳龙腾电子有限公司),高速离心机(TG16A-WS),加样器(Eppendorf research,1 000,200,10 μL),光学显微镜(Olympus, BH-2,Japan),-20℃低温冰箱(SIEMENS)。
1.4 动物分组 小鼠适应性喂养3~5 d,通过随机数字表法,将小鼠分为空白对照组、胶原诱导性关节炎(collagen induced arthritis,CIA)模型对照组、复方鹿角霜低剂量组(C1组)、复方鹿角霜高剂量组(C2组)、雷公藤多苷片组共5组,每组10只。
1.5 药物的制备 中药鹿角霜抗风湿复方提取物:取鹿角霜、蜂房、鹿衔草、忍冬藤、桑枝、桂枝药材,12倍水浸泡药材1 h,煎煮2次,每次3 h。经减压浓缩、真空干燥、粉碎,过筛孔内径0.180 mm(80目)筛,即得复方鹿角霜提取物,本品呈棕灰色粉末状。雷公藤多苷片剂,研磨成粉末状。0.5%羧甲基纤维素钠混悬,得药物混悬液。
1.6 造模 4组Balb/c雄性小鼠[1-2],造模,随机留1组作为空白对照组。造模前1 d,将牛Ⅱ型胶原溶于0.1 mol·L-1的醋酸溶液中,终浓度2 mg·mL-1,置于4℃冰箱中过夜备用。将溶解的牛Ⅱ型胶原与完全弗氏佐剂等体积混合,低温条件下充分乳化。将乳化完全的乳滴于Balb/c小鼠尾根部皮内注射100 μL,进行初次免疫,造模当天记为实验第1天。第21天将牛Ⅱ型胶原与不完全弗氏佐剂等体积混合,用同样的方法进行第2次免疫[3-5]。空白对照组给予0.9%氯化钠溶液进行免疫。小鼠关节出现红、肿表现或畸形即为实验造模成功[6-7]。
1.7 给药方法 第2次免疫完成后,第22天小鼠开始灌胃给药。空白对照组和模型对照组给与等体积0.5%羧甲基纤维素钠;C1组和C2组分别给予复方鹿角霜250,500 mg·mL-1,雷公藤多苷片组给予1.36 mg·mL-1雷公藤多苷片。灌胃前混悬均匀,小鼠灌胃量按0.1 mL·(10 g)-1给药,连续灌胃4周。
1.8 指标检测 最后一次给药结束后,小鼠摘取眼球取血,取血量约1.0 mL。血液室温静置1 h, 3 000 r·min-1离心10 min。取上层血清,分装于EP管中,置-20℃冰箱中储存备用。ELISA测定血清TNF-α、IL-4水平,严格按照试剂盒操作步骤进行。
1.9 小鼠后踝关节病理学观察 实验结束后,小鼠脱臼处死,剥离切取各组右侧踝关节,立即放入10%甲醛溶液中。常规脱水,石蜡包埋,切片,苏木精-伊红染色。光学显微镜下观察关节组织的病理变化,主要从滑膜细胞增殖、炎症和骨质侵蚀等方面进行观察。
1.10 统计学方法 实验数据采用SPSS18.0版软件进行分析,以均数±标准差(±s)表示。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠大体情况变化 小鼠第1次免疫后,空白对照组小鼠尾根部红肿很快恢复正常;模型对照组小鼠尾根部表现红肿,有些出现明显的溃烂,直至实验结束时仍无好转。
2.2 小鼠前后足爪病变情况 第30天小鼠足爪开始出现红肿,有的表现为足趾红肿,有的表现为足掌红肿。小鼠足爪肿胀一直存在,持续至实验结束。说明牛Ⅱ型胶原诱导的关节炎造模成功,可以为本实验评价复方鹿角霜对CIA模型的治疗作用提供参考。
2.3 复方鹿角霜对小鼠血清TNF-α和IL-4的影响与模型对照组比较,C1组、C2组小鼠血清TNF-α明显降低(P<0.01);C1组小鼠血清中IL-4水平含量增加(P<0.01),C2组IL-4水平含量有增加的趋势,但差异无统计学意义。见表1。

表1 5组小鼠血清TNF-α、IL-4比较Tab.1 Comparison of serum levels of TNF-α and IL-4 in five groups of mice
2.4 关节组织结构的变化 空白对照组小鼠关节软骨表面光滑平整,无炎性细胞浸润,如图1A所示;模型对照组小鼠滑膜组织明显增厚,滑膜内血管丰富,如图1B所示;而各给药组小鼠滑膜细胞增生、血管炎表现在一定程度上减轻,如图1C、D、E所示。见图1。
3 讨论
RA属中医“痹症”范畴,正气不足是类风湿关节炎发病的根本,邪气入侵是类风湿关节炎的发病条件,基本病机是素体本虚,气血不足,肝肾亏损,风寒湿邪痹阻脉络[8]。RA病因及发病机制尚不明确,但病理改变的靶器官以关节滑膜为主,同时伴随着全身免疫系统的活化。复方鹿角霜处方是医院经验方,来源于临床有效方剂鹿角霜抗风湿复方,由鹿角霜、蜂房、鹿衔草、忍冬藤、桑枝、桂枝6味药组成。以鹿角霜为君,补肾助阳,活血通脉;以鹿衔草、忍冬藤为臣,强筋健骨,祛风除湿,疏利关节;以蜂房为佐,祛风止痛;以桑枝、桂枝为使,气血通融,邪去正复。因而,如何借助现代药理实验,明确鹿角霜抗风湿复方治疗RA活性及作用机制,寻找和开发新的防治RA的药物成为极待进一步研究的问题。研究表明,TNF-α促进血管内皮细胞表达黏附分子;趋使炎性细胞聚集于关节滑膜处;诱导软骨、成纤维细胞合成和分泌胶原酶、前列腺素E2(prostaglandin E2,PGE2)等炎症递质;介导滑膜炎症和软骨破坏[9-11]。IL-4是一种具有多生物学效应的细胞因子,其抑炎作用主要通过以下途径:调节多种RA不同类型细胞活性,从而抑制TNF-α、IL-6等致炎因子的产生,同时也可抑制PGE2的表达,控制炎症的发生和发展;IL-4还可协同IL-10的抗炎作用[12-13]。通过对小鼠足趾和尾根部观察,成功建立了小鼠胶原诱导性关节炎模型。结果发现,在治疗实验中,用乳化完全的乳滴对Balb/c小鼠尾根部进行两次皮内注射,可以制作稳定的小鼠关节炎模型。ELISA法结果显示,模型对照组血清TNF-α含量上升,IL-4含量下降。表明炎性因子TNF-α和IL-4参与了胶原诱导性关节炎的发生过程,与文献报道一致。而复方鹿角霜治疗后,各治疗组血清TNF-α含量明显少于模型对照组,说明复方鹿角霜可抑制胶原诱导的关节炎小鼠血清TNF-α的表达。复方鹿角霜组小鼠血清IL-4水平高于模型对照组,但高剂量组有升高趋势,差异无统计学意义。病理结果显示:模型对照组滑膜组织增生明显、炎性细胞浸润;复方鹿角霜治疗后,滑膜组织增生轻于模型对照组。表明复方鹿角霜可抑制小鼠胶原诱导的关节炎症反应。由此可见,复方鹿角霜减轻小鼠胶原诱导的关节炎可能与调节小鼠血清TNF-α和IL-4表达有关。
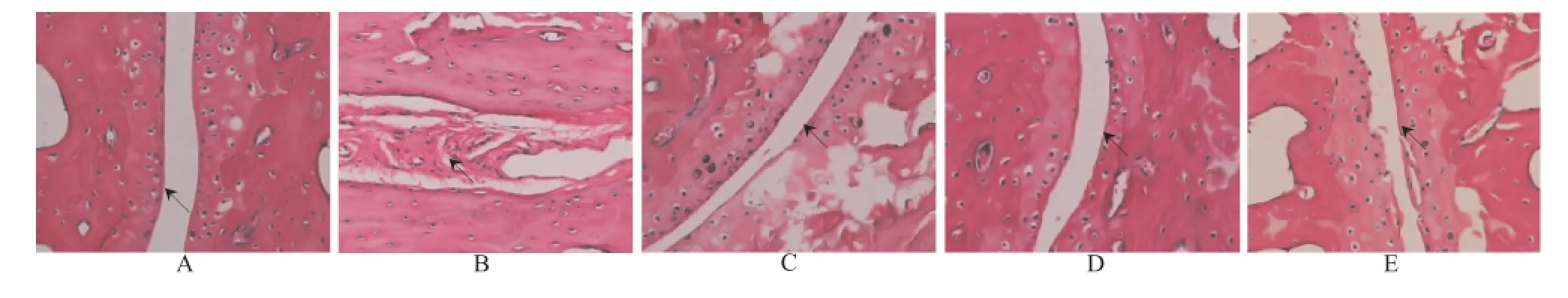
A.空白对照组;B.模型对照组;C.C1组;D.C2组;E.雷公藤多苷片组图1 光镜下5组小鼠关节组织的结构变化(HE,×100)A.blank control group;B.model control group;C.group C1;D.group C2;E.glucosidorum tripterygll totorum groupFig.1 Pathological changes of articular tissues in five groups of mice by light microscope(HE,×100)
参考文献
[1] 周茹,杨以阜,左建平.Ⅱ型胶原诱导的小鼠关节炎动物模型的建立及影响因素[J].中国药理学通报,2006,22 (12):1532-1535.
[2] JOE B,WILDER R L.Animal models of rheumatoid arthritis [J].Mol Med Today,1999,5(8):367-369.
[3] 肖智勇,张令令,张小锐,等.小鼠胶原诱导性关节炎模型的建立及其免疫学变化研究[J].中国比较医学杂志, 2011,21(10):136-140.
[4] TRENTHAM D E,TOWNES A S,KANG A H.Autoimmunity to type II collagen:an experimental model of arthritis [J].J Exp Med,1977,146(3):857-868.
[5] BRANG D D,LATHAM K A,ROSLONIEC E F.Collageninduced arthritis[J].Nat Protoc,2007,2(5):1269-1275.
[6] 张玲玲,刘云洁,童彤,等.DBA/1小鼠胶原性关节炎模型建立方法及评价指标[J].中国药理学通报,2010,26 (8):1108-1111.
[7] 宋珊珊,张玲玲,魏伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报,2011,27(12): 1648-1653.
[8] 陈艳凤,孙素平.中医辨治类风湿关节炎研究概况[J].实用中医内科杂志,2011,25(10):60-61.
[9] 罗心静,莫选荣,周玲玲.TNF-α诱导类风湿关节炎滑膜细胞NF-κB信号通路活化的探讨[J].免疫学杂志, 2012,28(4):321-323.
[10] 马武开,姚血明,黄颖,等.金乌健骨方对关节炎模型大鼠的抗炎作用研究[J].医药导报,2013,32(5):569-572.
[11] 胡清,曾玉琴,李雪锋,等.小剂量生物制剂联合甲氨蝶呤治疗类风湿关节炎35例[J].医药导报,2012,31(8): 1026-1028.
[12] 范雪亮,肖金鱼.关节炎大鼠模型血清中IL-4、IL-10表达的检测[J].中国中医急症,2011,20(7):1102-1127.
[13] 缪建春,蔡威黔.天然药物抗类风湿关节炎作用的研究进展[J].医药导报,2010,29(7):872-874.
DOI 10.3870/yydb.2014.08.003
Anti-inflammatory Effect of Compound Cornu Cervi Degelatinatum on Collagen-induced Arthritis Model of Mice
CHEN La-xia1,WANG Yan-yan2,SUN Wei-guang3,XU Xin4
(1.The First College of Clinical Medical Science, China Three Gorges University,Yichang 443002,China;2.Department of Pharmacy,Yichang Central People's Hospital,Yichang 443002,China;3.School of Pharmacy,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;4.Hubei University of Chinese Medicine,Wuhan 430065, China)
Objective To investigate the effects of compound cornu cervi degelatinatum on the expression of related inflammatory cytokines and pathological changes of the synovium in mice with collagen-induced arthritis(CIA).MethodsThe CIA model of Balb/c mice was established.The mice were randomly divided into 5 groups:blank control group,model control group,low-dose group(C1),high-dose group(C2)and glucosidorum tripterygll totorum group D.After the first immunization in mice,we observed the general condition and lesions of the fore and hind jaws.After the second immunization, the mice in groups C1 and C2 were orally administered with compound cornu cervi degelatinatum at the doses of 2.5 and 5 g·kg-1body weight per day for 4 weeks,and meanwhile those in group D were administrated with glucosidorum tripterygll totorum at the dose of 13.6 mg·kg-1body weight per day.The serum of the mice was collected to detect the levels of TNF-α and IL-4 by ELISA.Ankle joints were harvested,and the pathological changes of synovial tissues were observed under light microscope.ResultsAs compared with the model control group,the level of TNF-α in the treatment groups was significantly decreased,while the level of IL-4 was elevated in group C1.Histological pathology of ankle joints demonstrated that the synovium of the CIA mice were hyperplastic and the synovial tissues were markedly ameliorated in treatment groups.ConclusionThe compound cornu cervi degelatinatum can relieve redness and swelling in mice with CIA.The mechanism may be related to the inhibition of pro-inflammatory cytokine TNF-α and regulation of anti-inflammatory cytokine IL-4.
Cornu cervi degelatinatum,compound;Arthritis;Collagen,typeⅡ;Cytokine
R286;R285.5
A
1004-0781(2014)08-0988-04
2013-04-19
2013-12-03
*国家“重大新药创制”科技重大专项项目(2011ZX09102-006-05)
陈腊霞(1986-),女,湖北监利人,药师,硕士,研究方向:药理学。电话:(0)18986774195,E-mail:chenlaxia103 @126.com。
王燕燕(1964-),女,湖北宜昌人,主任药师,硕士生导师,博士,主要从事中药药效学、医院药学研究。电话:0717-6487741,E-mail:wangyy1001@163.com。

