小鼠卵巢组织冷冻保存方法对组织内分泌功能的影响
朱夏琴,孙正怡,郁琦,甄璟然,王雪,何方方
(中国医学科学院,北京协和医学院,北京协和医院妇产科,北京 100730)
肿瘤放化疗的性腺毒性是女性肿瘤患者生殖内分泌功能丧失的主要原因,随着肿瘤治愈率及生存率的提高,女性肿瘤患者的生育问题得到关注。卵巢组织获取相对容易,且卵巢组织冷冻复苏后除可以重建患者的内分泌功能外,还可能获得生育能力,因此卵巢组织冷冻复苏在临床上具有重要的应用前景。目前卵巢组织冷冻多采用慢速冷冻,玻璃化冷冻作为近期发展起来的新技术,与慢速冷冻相比,不需要冷冻仪器、耗时更短,且本中心将玻璃化冷冻应用于卵裂球及囊胚冻存,其复苏后的胚胎存活率及临床妊娠率均处于国内领先水平,我们前期的研究也显示玻璃化冷冻可以较好地保存卵巢组织[1]。因此本实验在既有的研究基础之上,进一步评价不同的冷冻保存方法对卵巢组织内分泌功能的影响。
材料和方法
一、实验动物
由北京协和医院动物实验中心提供,6周龄ICR雌鼠,体重25~28g。经动物中心培养1周后,行阴道脱落上皮涂片观察小鼠动情周期,选择动情周期正常的25只ICR雌鼠。
二、卵巢组织的获取与预处理
颈椎脱臼法处死ICR雌鼠,从下腹正中切口处获取双侧卵巢,放入经羟乙基哌嗪乙硫磺酸(HEPES)缓冲的拟人输卵管液(HTF)(Sage,美国)试管内,夹于冰间,送回实验室。37℃热台上用1ml针头的切割面剔去卵巢血管结缔组织,并将卵巢组织切成小块,每块大小约为1mm×1mm×1mm。操作于含有HEPES-HTF培养液的培养皿中进行。根据不同的冷冻方法,将卵巢组织随机分为5组,每组5例:新鲜对照组、二甲亚砜(DMSO)慢速冷冻组(A组)、丙二醇(PROH)慢速冷冻组(B组)、冷冻管玻璃化冷冻5min组(C组)及冷冻管玻璃化冷冻8min组(D组)。
三、冷冻复苏方案
实验所用试剂除标注外均购自美国Sigma公司。冷冻基础液为含5mg/ml人血清白蛋白(HSA,Sage,美国)的 HEPES-HTF。
1.慢速冷冻方案:冷冻基础液加入1.5mol/L DMSO(A组)或PROH(B组)作为冷冻保护液1,冷冻基础液中加入1.5mol/L DMSO(A 组)或PROH(B组)+0.1mol/L蔗糖作为冷冻保护液2。
卵巢组织在含有冷冻保护液1的培养皿中停留5min,装入含1.8ml冷冻保护液2的冷冻管(Nunclon,丹麦),4℃冰箱平衡30min。放入程序冷冻仪。
自4℃开始以2℃/min的速度降温至-8℃,-8℃维持10min,人工植冰后再维持10min;以0.3℃/min的速度降温至-40℃;以-30℃/min的速度降温至-150℃后投入液氮。
2.玻璃化冷冻方案:冷冻基础液中加入7.5%(体积/体积,v/v)DMSO 及 7.5% (v/v)乙二醇(EG)作为预平衡液;冷冻基础液中加入15%(v/v)DMSO+15%(v/v)EG+5.8mg/ml聚蔗糖(Ficoll 400)+0.58mol/L蔗糖作为玻璃化液。
卵巢组织在含有预平衡液的培养皿中停留5min(C组)或8min(D组),转移至含有玻璃化液的培养皿中停留5min(C组)或8min(D组),迅速转移至含有液氮的冷冻管中后投入液氮。
3.复苏方案:卵巢组织冻存2~10d后复苏。将含有卵巢组织的冷冻管自液氮中取出,在空气中停留5~10s后,于37℃水浴解冻至肉眼所见冰晶溶解。分别投入含有0.67、0.33、0.2、0mol/L蔗糖的复苏液中,充分洗涤,平衡5min;最后移入添加了5%HSA的HTF中,放入5%CO2培养箱中培养。
四、冷冻复苏后卵巢组织的培养
Transwell-24孔板(Corning,美国),隔孔放入一个嵌入式小室,每个小室底部铺100μl经α-最低必需培养基(α-MEM)以3∶1稀释的 matrigel胶(BD,美国),待胶凝固后小室内放入卵巢组织两枚,加入培养液150μl,小室外室加入培养液650μl。培养液成分为α-MEM(中国医学科学院基础医学细胞 中 心)中 加 入 50ml/l HSA、10ml/l ITS(10μg/ml胰岛素、5.5μg/ml转铁蛋白和5.0ng/ml亚硒酸)、0.5U/ml人绝经期促性腺激素(HMG,丽珠医药)、100U/ml青霉素和100μg/ml链霉素(中国医学科学院基础医学细胞中心)。在37℃5%CO2培养箱中培养14d。隔天从外室吸出培养液500μl装入eppendorf试管内,-80℃保存至分析用;并同时补充入等量新鲜培养液。
五、卵巢组织冷冻复苏后行小鼠肾包膜下移植
冷冻复苏方案同上。复苏后卵巢组织放入5%CO2培养箱中培养24h,然后经背部切口将卵巢组织块移植入ICR小鼠肾包膜下,左右各移植2块,移植同时去除受体鼠卵巢。为提高可比性,增加了未处理的自然对照组,以及去除卵巢后未移植卵巢组织的去势未移植对照组。移植了卵巢组织的受体ICR小鼠常规饲养2周后,取血测定血清E2水平,比较各组间的差异。
六、E2水平的检测
体外培养隔天收集的培养液及移植小鼠的血清统一采用化学免疫发光法测定E2水平。试剂盒由Beckman Coulter(美国)提供,检测按说明书要求进行,数值超出检测上限时行α-MEM稀释后检测。
七、统计学方法
数据采用SPSS 17.0软件进行统计。培养液及血清E2值各组比较分别采用重复测量数据方差分析及单因素方差分析。P<0.05表示差异有统计学意义。
结 果
一、各组体外培养液中E2浓度
体外培养14d,各组培养液中E2水平随培养时间逐渐增加(F=14.146,P<0.001)。同一天的E2水平比较,A组、B组显著高于对照组、C组及D组(P<0.05),A组与B组之间无显著性差异,对照组、C组及D组之间无显著性差异(P>0.05)(表1)。
二、复苏移植常规饲养14d后受体小鼠血清E2浓度
新鲜对照组及各实验组冷冻复苏后移植入同种异体小鼠,14d后,比较各组小鼠血清E2平均水平,DMSO慢速冷冻复苏移植组、PROH慢速冷冻复苏移植组的平均E2水平显著高于其他各组(P<0.05);新鲜移植对照组、玻璃化5min复苏移植组、玻璃化8min复苏移植组及去势未移植对照组的平均E2水平显著低于未处理的自然对照组(P<0.05);新鲜移植对照组、玻璃化5min复苏移植组、玻璃化8min复苏移植组比较,E2水平无显著性差异(P>0.05)(表2)。
表1 体外培养各组培养液中E2浓度(±s)
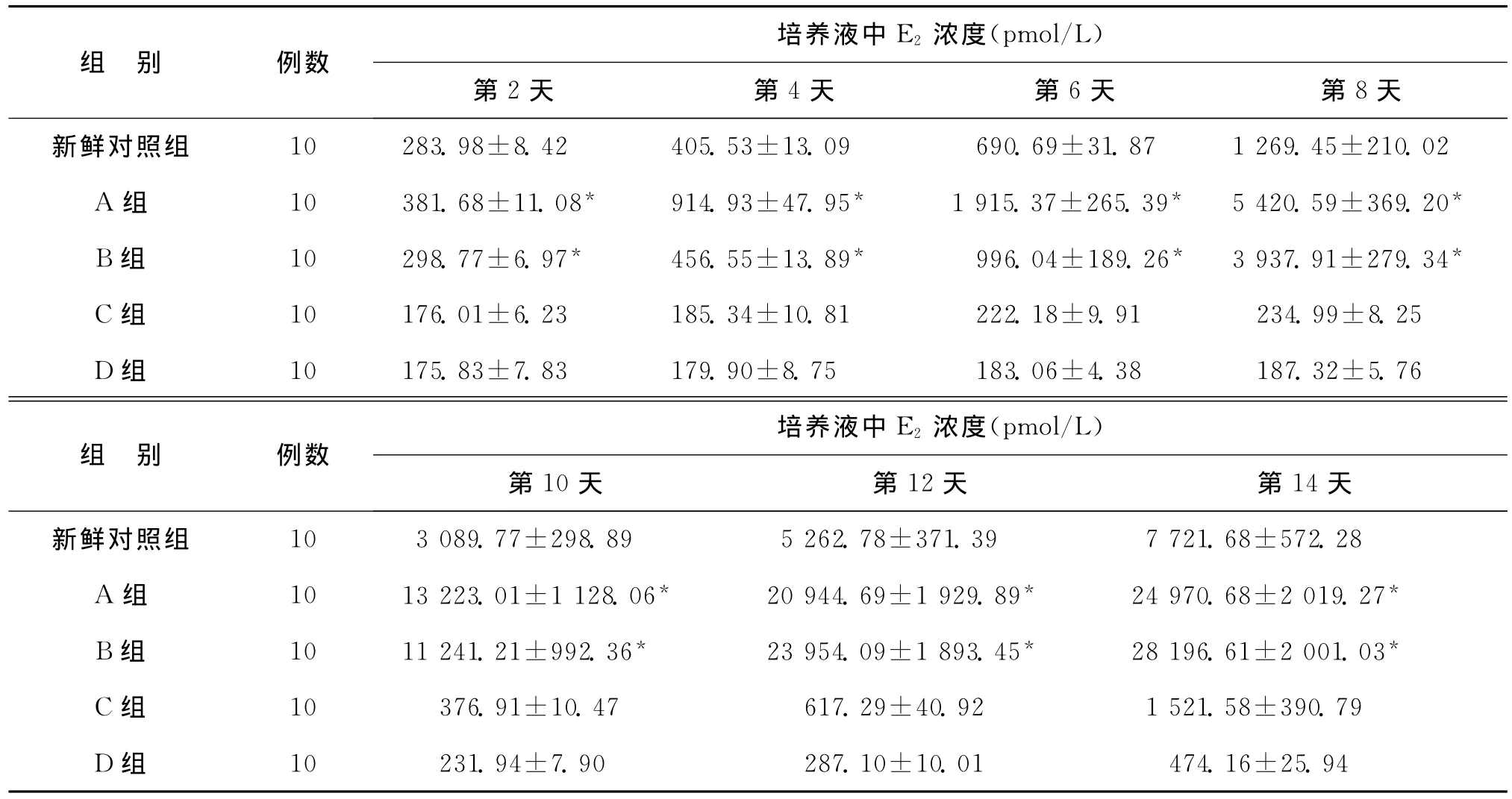
表1 体外培养各组培养液中E2浓度(±s)
注:与对照组、C组及D组比较,*P<0.05
组 别 例数培养液中 E2 浓度(pmol/L)第2天 第4天 第6天 第8天新鲜对照组 10 283.98±8.42 405.53±13.09 690.69±31.87 1 269.45±210.02 A组 10 381.68±11.08* 914.93±47.95* 1 915.37±265.39* 5 420.59±369.20*B组 10 298.77±6.97* 456.55±13.89* 996.04±189.26* 3 937.91±279.34*C组 10 176.01±6.23 185.34±10.81 222.18±9.91 234.99±8.25 D组 10 175.83±7.83 179.90±8.75 183.06±4.38 187.32±5.76组 别 例数培养液中E2 浓度(pmol/L)第10天 第12天 第14天新鲜对照组 10 3 089.77±298.89 5 262.78±371.39 7 721.68±5 10 231.94±7.90 287.10±10.01 474.16±25.94 72.28 A组 10 13 223.01±1 128.06* 20 944.69±1 929.89* 24 970.68±2 019.27*B组 10 11 241.21±992.36* 23 954.09±1 893.45* 28 196.61±2 001.03*C组 10 376.91±10.47 617.29±40.92 1 521.58±390.79 D组
表2 复苏移植各组第14天小鼠血清E2水平比较(±s)
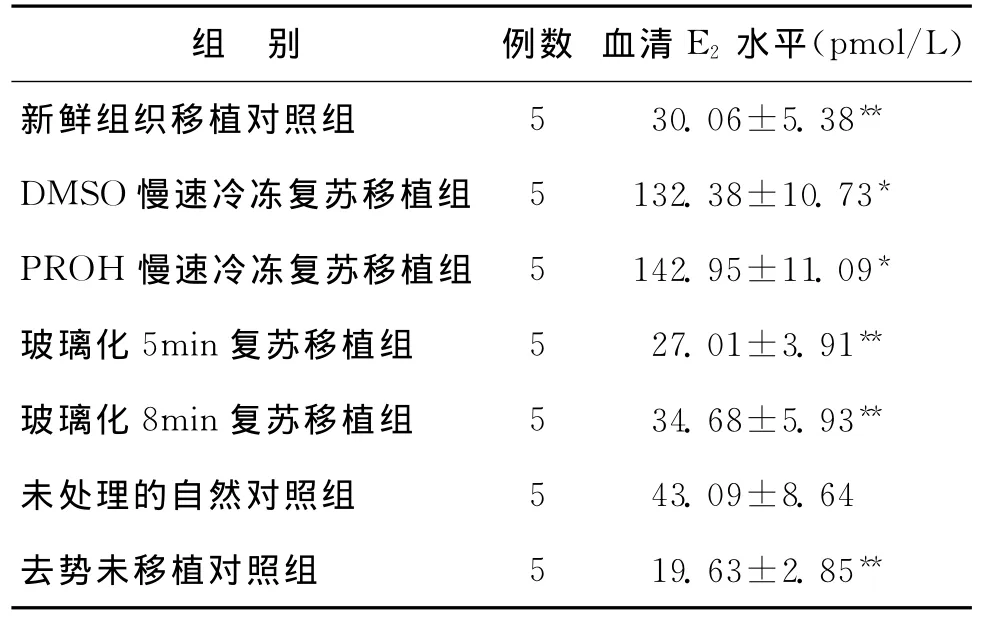
表2 复苏移植各组第14天小鼠血清E2水平比较(±s)
注:与其他各组比较,*P<0.05;与未处理的自然对照组比较,**P<0.05
组 别 例数 血清E2水平(pmol/L)新鲜组织移植对照组 5 30.06±5.38**DMSO慢速冷冻复苏移植组 5 132.38±10.73*PROH慢速冷冻复苏移植组 5 142.95±11.09*玻璃化5min复苏移植组 5 27.01±3.91**玻璃化8min复苏移植组 5 34.68±5.93**未处理的自然对照组 5 43.09±8.64去势未移植对照组 5 19.63±2.85**
讨 论
女性肿瘤患者经过手术或放化疗后生殖功能必然受到影响,在性腺功能受损前进行卵巢组织的冷冻适合于青春期前卵泡尚未发育成熟的患者、不能延误肿瘤治疗以及促排卵有禁忌或者有切除双侧附件风险的女性患者[2]。目前卵巢组织的冷冻保存尚处于研究阶段。
卵巢皮质内具有大量的卵泡储备,原始卵泡因体积小、代谢率低等特征能够耐受低温损伤,在皮质冷冻中可以相对多地完好保存[3]。冷冻方法根据降温方式的不同可以分为慢速冷冻和玻璃化冷冻。慢速冷冻是传统的冷冻方法,采用低浓度的冷冻保护剂以降低细胞毒性;玻璃化冷冻因为降温迅速,组织或细胞与冷冻剂接触时间短,则需要更高浓度的冷冻保护剂和更快的降温速率。目前卵巢组织的冷冻方案尚无统一意见,但多数采用慢速冷冻并取得了一定的临床活产[4]。玻璃化冷冻因其较好的胚胎/卵母细胞存活率、操作耗时短、无需特殊仪器等特点逐渐受到青睐,也逐步应用至卵巢组织冷冻的研究中[4]。本中心玻璃化冷冻囊胚、卵母细胞的存活率较高[5],有较为成熟的临床操作方案,因此,本研究比较现有的玻璃化冷冻方案用于卵巢组织冷冻相对于慢速冷冻的效果。
目前的研究显示,慢速冷冻与玻璃化冷冻对卵巢组织保存效果的结果不尽一致:部分研究结果显示慢速冷冻相对于玻璃化冷冻可以更好地保存卵泡;部分研究结果则相反。冷冻保护剂的选择、组织块的大小、降温速率以及冷冻工具的选择等是导致结果不同的主要因素。比如玻璃化冷冻采取了多种不同的改良:直接投入液氮、冷冻管、固相表面等方法。慢速冷冻多数采用DMSO或者PROH作为冷冻保护剂;最早Gosden等[6]采用DMSO进行羊的卵巢组织冷冻,自体移植后分娩了小羊;其后的多数研究表明DMSO的慢速冷冻可以保存窦前卵泡,移植后B超监测显示有卵泡的生长发育[7]。Castro等[8]的研究发现,DMSO与蔗糖加或不加血清都可以在体外培养中见到较好的卵泡生长。PROH因其用于卵母细胞和胚胎的冷冻效果满意,此后被应用至慢速冷冻的研究。研究发现,PROH除可保存卵泡外,对前颗粒细胞的保存也有较好的效果。Fabbri等[9]的研究表明相对低的PROH与蔗糖可以获得较好的慢速冷冻效果。本实验中分别采用DMSO和PROH作为冷冻保护剂进行慢速冷冻,结果显示均能较好地维持组织粒的内分泌功能,统计学分析无显著性差异。
玻璃化冷冻因保护剂的浓度高,常联合采用多种保护剂以降低毒性损伤,因此各中心根据自己的条件所采用的冷冻方案各有区别,冷冻效果也有所差异[10]。近期的研究认为针灸针的应用可以获得更好的玻璃化冷冻效果[11]。玻璃管冷冻是囊胚玻璃化冷冻的演变,直接将经预平衡液和玻璃化液两步平衡好的组织投入玻璃管中,迅速降温,以期达到玻璃化的状态,更好地保护卵巢组织。整个操作耗时短,因此本实验希望能够通过对卵巢组织块大小、冷冻、复苏液中保护剂的浓度以及平衡时间的调整,摸索合适的冷冻方案。结果显示,两步平衡作用时间5min和8min相比,差异无统计学意义;无论是体外培养液还是同种移植小鼠血清E2水平比较,结果均提示本实验中的两种冷冻方法复苏后的卵巢组织均具有内分泌功能,且慢速冷冻效果可能优于玻璃化冷冻效果。
体外培养通过构建合适的气体浓度和营养物质,提供卵巢组织体外生长的条件,并可通过培养液中的激素检测分析、评价组织的内分泌功能[12]。研究显示,体外培养卵巢组织的E2分泌与卵泡直径的大小相关[13]。本实验中,体外培养液未添加E2合成相关物质,而培养液中E2水平在各组14d中均呈现出持续上升的趋势,提示在培养过程中,原始卵泡可向初级卵泡发育,且不仅原始卵泡在冷冻过程中可以被保存,部分初级卵泡也可以一定程度地被保存。因培养时间相对较短,原卵巢组织中的前体物质可提供E2的合成原料。本实验中几种冷冻方法与新鲜对照组比较,无显著性差异。
卵巢组织的移植可分为同种自体移植、同种异体移植和异种移植;根据移植部位的不同可分为原位移植和异位移植。动物实验中,裸鼠的移植部位常选择皮下、肌肉或腹腔;其他移植部位包括肾包膜下等,这些部位移植均获得较好的生长情况[14-15]。肾包膜提供了相对表浅的移植位置,且贴近肾组织,血供相对丰富;但手术操作亦容易引起肾出血。研究表明,即使卵泡数有所下降,移植后的卵巢组织仍具有良好的分泌激素的功能[15]。本实验中,血清E2水平也提示卵巢组织具有分泌活性,其中慢速冷冻血清E2水平高于玻璃化冷冻组,提示慢速冷冻组对卵泡保存的效果优于冷冻管玻璃化冷冻组,这一趋势与前期研究结果类似[1]。慢速冷冻因降温过程中细胞内冰晶形成、物理损伤及冷冻保护剂的细胞毒性等对组织/细胞有一定程度损伤;但本实验中慢速冷冻复苏组培养液及移植组血清E2水平高于新鲜对照组,这一结果难以用单一的冷冻损伤解释,可能与冷冻过程中,部分具有分泌功能的生长卵泡受到冷冻损伤,原本合成、未来得及分泌的E2进入培养液/血液;以及移植后这部分不完全受损的卵泡逐渐恢复分泌功能,与由原始卵泡发育而来的卵泡共同作用,显示出持续的较高E2水平;以及本实验样本量较少,存在一定不可避免的偏倚有关。其具体原因尚需要进一步的研究验证。
本研究结果提示慢速冷冻与玻璃化冷冻复苏后的卵巢组织具有一定内分泌能力,慢速冷冻效果可能优于玻璃化冷冻。同种移植实验成功为进一步获卵等操作提供了可行性。实际操作中可根据不同的条件和要求选择适当的冷冻方法,且可以对冷冻方法进行改进,以获得更好的冷冻保存效果。但本实验样本量较少,且培养液或血清E2水平仅仅是卵巢组织功能的一方面体现,日后的研究应该完善样本总量并结合其他指标综合评价冷冻效果。
[1] 符晓倩,何方方,甄璟然 .兔卵巢组织慢速冷冻和玻璃化冷冻保存方法的研究[J].生殖医学杂志,2011,20:400-405.
[2] Ethics Committee of American Society for Reproductive Medicine.Fertility preservation and reproduction in patients facing gonadotoxic therapies:a committee opinion[J].Fertil Steril,2013,100:1224-1231.
[3] Salama M,Winkler K,Murach KF,et al.Female fertility loss and preservation:threats and opportunities[J].Ann Oncol,2013,24:598-608.
[4] Amorim CA,Curaba M,Van Langendonckt A,et al.Vitrification as an alternative means of cryopreserving ovarian tissue[J/OL].Reprod Biomed Online,2011,23:160-186.
[5] 孙正怡,何方方,郁琦,等 .冷冻环玻璃化法与程序冷冻法对人囊胚冷冻复苏效果的比较[J].生殖医学杂志,2006,15:161-164.
[6] Gosden RG.Memoir of fertility preservation[J].Adv Exp Med Biol,2013,761:85-94.
[7] Gook DA,Edgar DH,Stern C.Cryopreservation of human ovarian tissue[J].Eur J Obstet Gynecol Reprod Biol,2004,113,Suppl 1:S41-S44.
[8] Castro SV,de Carvalho AA,da Silva CM,et al.Freezing solution containing dimethylsulfoxide and fetal calf serum maintains survival and ultrastructure of goat preantral follicles after cryopreservation and in vitro culture of ovarian tissue[J].Cell Tissue Res,2011,346:283-292.
[9] Fabbri R,Pasquinelli G,Keane D,et al.Optimization of protocols for human ovarian tissue cryopreservation with sucrose,1,2-propanediol and human serum[J/OL].Reprod Biomed Online,2010,21:819-828.
[10] Fathi R,Valojerdi MR,Salehnia M.Effects of different cryoprotectant combinations on primordial follicle survivability and apoptosis incidence after vitrification of whole rat ovary[J].Cryo Letters,2013,34:228-238.
[11] Xiao Z,Wang Y,Li LL,et al.In vitro culture thawed human ovarian tissue:NIV versus slow freezing method[J].Cryo Letters,2013,34:520-526.
[12] Carlsson IB,Scott JE,Visser JA,et al.Anti-Müllerian hormone inhibits initiation of growth of human primordial ovarian follicles in vitro[J]. Hum Reprod,2006,21:2223-2227.
[13] Boland NI,Humpherson PG,Leese HJ,et al.Pattern of lactate production and steroidogenesis during growth and maturation of mouse ovarian follicles in vitro[J].Biol Reprod,1993,48:798-806.
[14] Oktay K,Newton H,Mullan J,et al.Development of human primordial follicles to antral stages in SCID/hpg mice stimulated with follicle stimulating hormone[J]. Hum Reprod,1998,13:1133-1138.
[15] Deng X,Zheng H,Yu X,et al.Cryopreserved ovarian tissues can maintain a long-term function after heterotopic autotransplantation in rat[J].Reproduction,2009,138:519-525.

