脱硫石膏基羟基磷灰石对Cu2+吸附性能的研究
严玉波,董晓丽,孙晓蕾,李健生,沈锦优,韩卫清,刘晓东,孙秀云*,王连军*
(1.南京理工大学环境与生物工程学院,江苏 南京210094;2.江苏省化工污染控制与资源化重点实验室,江苏 南京210094)
脱硫石膏基羟基磷灰石对Cu2+吸附性能的研究
严玉波1,2,董晓丽1,2,孙晓蕾1,2,李健生1,2,沈锦优1,2,韩卫清1,2,刘晓东1,2,孙秀云1,2*,王连军1,2*
(1.南京理工大学环境与生物工程学院,江苏 南京210094;2.江苏省化工污染控制与资源化重点实验室,江苏 南京210094)
以燃煤电厂废弃物脱硫石膏(FGD)为主要原料,利用水热合成法制备羟基磷灰石(FGD-HA),利用XRD和SEM对FGD-HA的物相组成和微观形貌进行了分析和观察.通过静态吸附实验研究了吸附动力学、吸附等温线以及吸附热力学.结果表明,伪二级动力学模型相关系数为0.9998,是描述FGD-HA吸附Cu2+的最佳动力学模型,Cu2+在FGD-HA上的吸附平衡符合Langmuir等温线模型(R2=0.9846),热力学表明此吸附是自发吸热的过程.利用响应面分析法对Cu2+的吸附条件进行优化,得出投加量3.11g/L、pH值4.96、温度22.09℃、Cu2+初始浓度24.75mg/L为最佳吸附条件,此条件下Cu2+去除率预测值为100%,相同条件下开展的验证实验结果为97.4%,与预测值相接近说明模型的选择是实际可行的.
脱硫石膏;羟基磷灰石;吸附;响应面分析法
近年来,随着电镀、采矿等行业的迅猛发展,大量的含铜工业废水随之进入天然水体.铜对人体有很强的毒害作用,过量的摄入会出现呕吐、腹部绞痛、痉挛等症状,严重者甚至死亡[1].因此,在含铜废水排放之前,必须对其进行达标处理.在众多的除铜技术中,吸附法由于其高效、经济、易操作而备受研究者亲睐[2-3].
羟基磷灰石是一种高效的重金属吸附剂,具有低水溶性和高稳定性等特点[4].目前研究者制备羟基磷灰石的钙源主要是化学试剂和生物材料,对于一些高钙工业废渣的关注较少.脱硫石膏是火电厂烟气脱硫后排放的废渣,其中硫酸钙含量一般在90%以上.据统计[5],2010年全国脱硫石膏排放量高达5230万t,大量脱硫石膏的堆积对大气与地下水造成严重污染.
本课题组拟采用脱硫石膏为钙源制备羟基磷灰石,并将其应用于含铜废水的处理中.分别从吸附动力学、吸附等温线以及吸附热力学等方面探讨FGD-HA对Cu2+的吸附性能.最后利用响应面分析法对影响 Cu2+吸附的因素进行优化,提出FGD-HA吸附Cu2+的最佳条件,为工业化应用提供理论依据.
1 材料与方法
1.1 原料与试剂
脱硫石膏取自南京某火力发电厂,样品中CaO的质量分数约为40%,此外还含有少量的SiO2、Al2O3和 Fe2O3,未检出重金属成分;1000mg/L含铜废水采用CuSO4·5H2O与去离子水配制而成,按比例稀释此废水即得实验所需浓度废水;CuSO4·5H2O、(NH4)2HPO4、NH3OH、无水乙醇等试剂均由南京化学试剂有限公司提供,且所有试剂均为分析纯.
1.2 FGD-HA的制备及表征
原脱硫石膏用去离子水洗涤多次后置于80℃下烘干,将烘干后的样品研磨至过200目筛,备用.按照 Ca/P摩尔比为1.67分别称取脱硫石膏2g,加入到100mL0.0429mol/L的(NH4)2HPO4溶液中,调节 pH值为10~11,充分搅拌后移入聚四氟乙烯内寸的反应釜中,置于150℃下反应24h,反应完成后陈化24h.将沉淀物取出先用去离子水洗至近中性后再用无水乙醇洗3遍,在80℃烘箱中烘干后收集.
获得的样品用 X 射线衍射仪(XRD) (D8Advance,Bruker,德国)测定其物相组成,用扫描电镜(SEM) (S-4800, Hitachi, 日本)观察其微观形貌.BET比表面积测定仪(ASAP2020, Micromeritics Instrument,美国)测出FGD-HA的比表面积为79.13m2/g,高于相关文献报道[6-7],有利于重金属离子的吸附.
1.3 吸附动力学实验
准确称取0.075g FGD-HA投加到25mL60mg/L的含铜废水(pH=5.3±0.1)中,置于恒温振荡培养箱中,控制温度为20℃,振荡速度为200r/ min.分别在5,10,20,30,45,60,90,120,150,180min取样,过0.22μm滤头后用等离子体原子发射分光光度计(ICP-AES) (Optima7000DV, PerkinElmer,美国)测定残余 Cu2+浓度,根据式(1)计算去除率.

式中: R为Cu2+去除率,%;Ct为t时刻废水中Cu2+的浓度,mg/L.
1.4 吸附等温线
准确称取0.05g FGD-HA分别投加到25mL不同浓度(20,40,60,80,100mg/L)的含铜废水(pH=5.3±0.1)中,控制温度为30℃,振荡速度为200转/min,充分反应3h后,取出测定残余Cu2+浓度,根据式(2)计算吸附容量.

式中: qe为Cu2+吸附容量,mg/g;C0为初始Cu2+浓度,mg/L;Ce为反应后残余Cu2+浓度,mg/L;V为废水体积,L;m为FGD-HA用量,g.
1.5 吸附热力学
准确称取0.05g FGD-HA投加到25mL60mg/L的含铜废水(pH=5.3±0.1)中,分别置于不同温度(20,30,40℃)下,控制振荡速度为200转/min,充分反应3h后取出测定残余Cu2+浓度.
1.6 吸附条件的响应面优化
选取 FGD-HA投加量、pH值、温度和Cu2+初始浓度4个影响因素,采用 Box-Behnken响应面模型设计29组试验,对FGDHA吸附的条件进行优化,旨在高效吸附去除废水中的Cu2+.具体试验因素与水平设计及结果见表1和表2.

表1 响应面设计因素、水平及编码Table1 Variables, levels and codes chosen for RSM
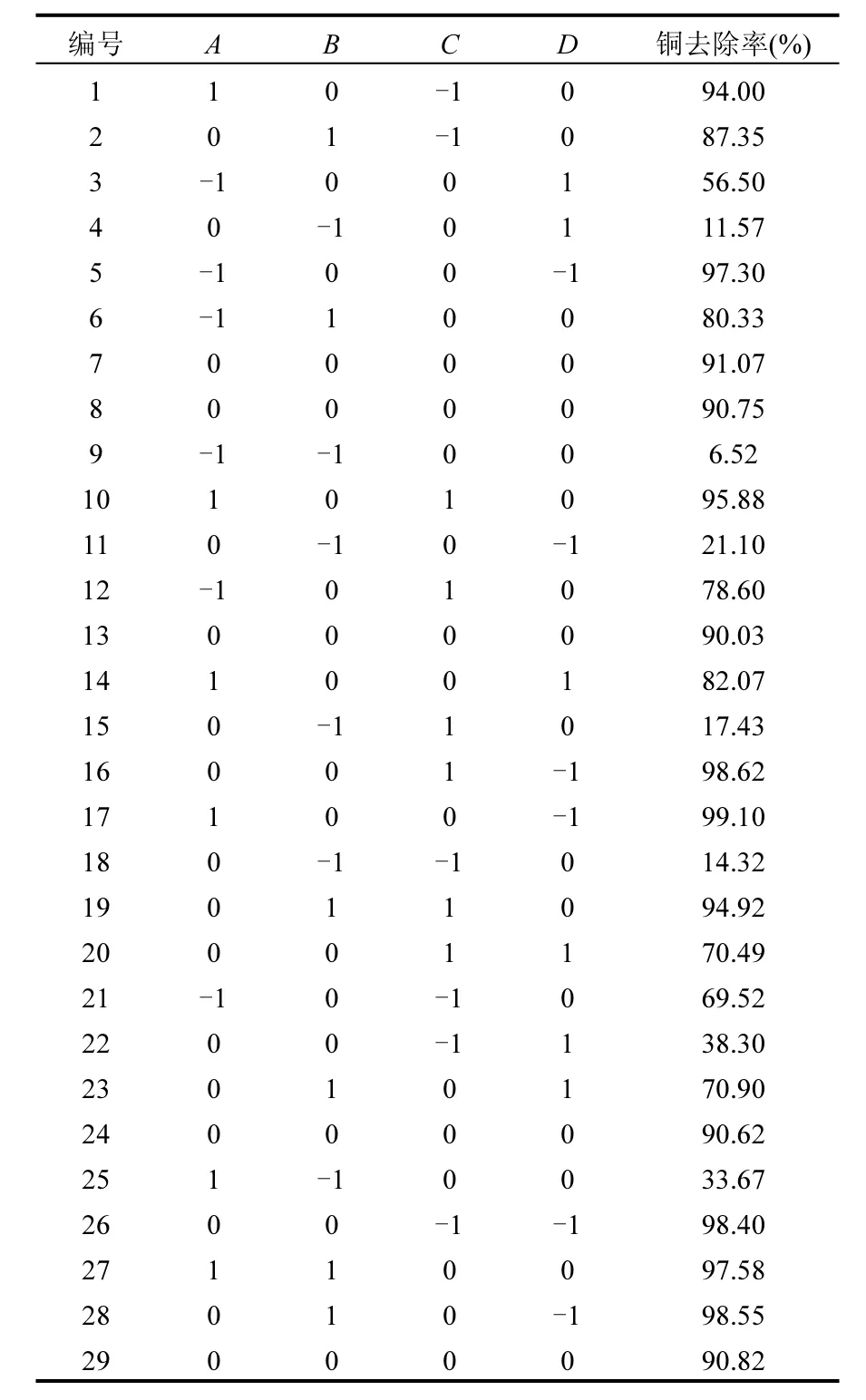
表2 响应面分析试验结果Table2 The experimental results of RSM
2 结果与讨论
2.1 FGD-HA的表征
图1为FGD-HA样品的广角XRD图.从图1可以看出FGD-HA在002、211、112、300、202、310、222、213处有较强的特征峰,且这些特征峰与羟基磷灰石标准卡片(JCPDS09-432)相吻合,说明合成的FGD-HA的主要成分是羟基磷灰石.从宽化的峰型来看,合成的羟基磷灰石具有较低的结晶度和较细的晶粒.

图1 FGD-HA的XRD图Fig.1 X-ray diffraction pattern of FGD-HA

图2 FGD-HA的SEM图Fig.2 SEM image of FGD-HA
图2为FGD-HA样品的SEM照片.由图2可见,FGD-HA表面由大量团聚的颗粒堆积成棉絮状,且具有大量不规则的孔道,提供了更多的吸附位点,有利于废水中Cu2+的去除.
2.2 溶液pH值对Cu2+吸附的影响
从图3可以看出,Cu2+吸附容量随着pH值的增大而增加.主要原因有如下几方面:在强酸性条件下,FGD-HA部分溶解,导致原有的吸附位点减少;低 pH值下 H+与 Cu2+竞争吸附较激烈; FGD-HA表面在pH值为2~6下带负电,且随着pH值的增加电负性略有增强,这有利于对正价Cu2+的吸附;pH值为6时,部分Cu2+会生成沉淀,提高了其吸附容量.
2.3 吸附动力学
废水中铜去除率随时间的变化结果如图3所示.从图3可以看出,FGD-HA吸附铜的过程可以分为2个阶段,第1阶段为快速吸附,即吸附的前10min,去除率达76%;第2阶段为缓慢吸附,较第1阶段去除率仅增加了11.6%.吸附在2.5h后基本达到平衡.由图3可见,原脱硫石膏对铜基本没有去除能力.
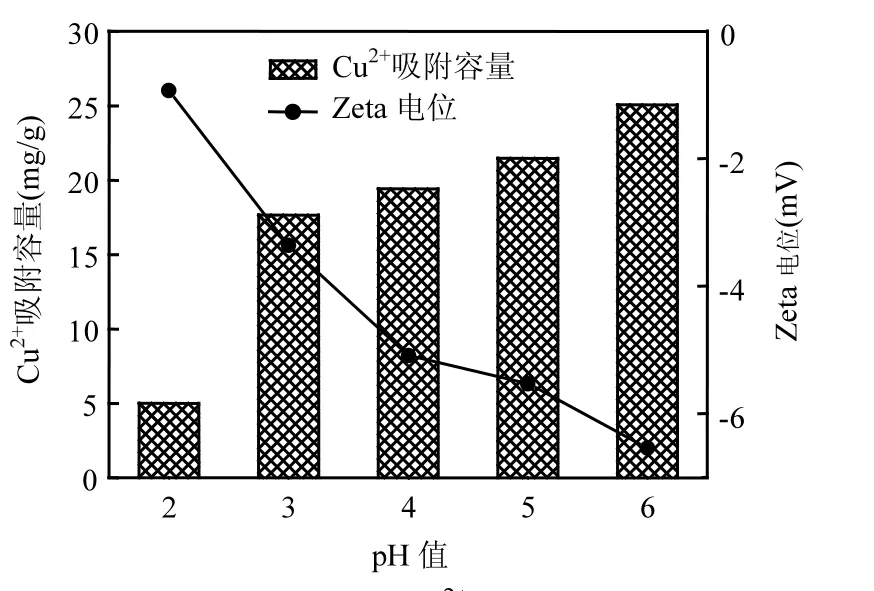
图3 pH值对Cu2+吸附的影响Fig.3 Effect of pH on Cu2+removal

图4 Cu2+去除率随时间的变化曲线Fig.4 Effect of time on Cu2+removal
为进一步考察FGD-HA对Cu2+的吸附机制,分别采用伪一级动力学模型[式(3)]、伪二级动力学模型[式(4)][8-10]对实验数据进行拟合分析,结果见表3.结果显示伪二级动力学模型的相关系数(R2=0.9998)大于伪一级动力学模型(R2=0.9376),并且伪二级动力学方程计算出的最大吸附容量(qm=17.73mg/g)与实验值(qm=17.54mg/g)十分相近,由此可以得出伪二级动力学模型更能反映FGD-HA对Cu2+的吸附行为,同时也可以说明吸附过程的总体速率主要受化学过程控制[11].
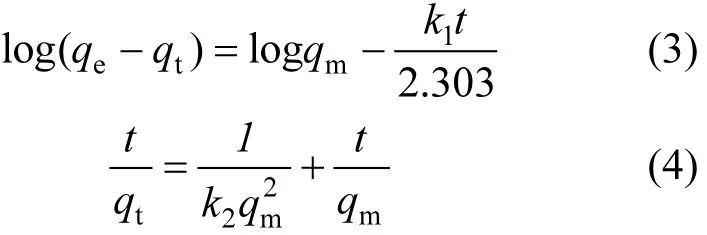
式中: qe为平衡吸附容量,mg/g;t为吸附时间,min;qt为t时刻吸附容量,mg/g;k1为伪一级动力学速率常数;k2为伪二级动力学速率参数;qm为最大吸附容量,mg/g.

表3 动力学参数Table3 Kinetics parameters of adsorption Cu2+onto FGD-HA
2.4 吸附等温线
选取 Langmuir[式(5)], Freundlich[式(6)]和Dubinin-Radukevich(D-R)[式(7)~式(9)][12-14]三种常用的吸附等温线模型对实验数据进行分析.
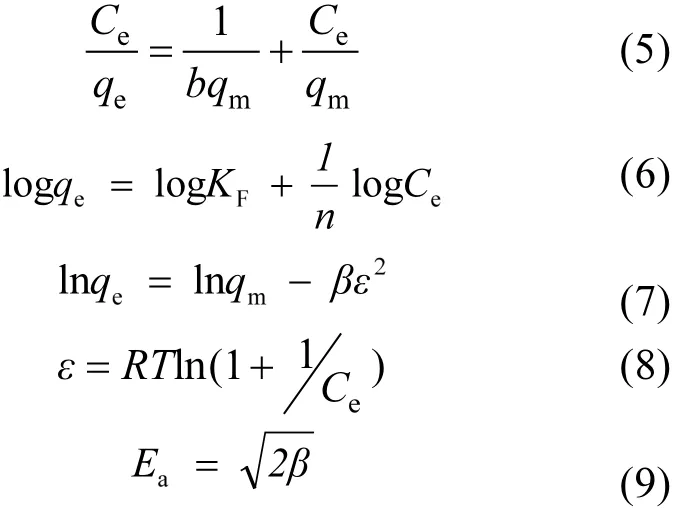
式中: Ce为平衡吸附浓度,mg/L;qe为平衡吸附容量,mg/g;qm为最大吸附容量,mg/g;b为Langmuir常数;KF、n为 Freundlich常数;β为 D-R常数,mol2/kJ2;ε为波拉尼吸附势能,J/mol;R为气体常数,8.3145J/(mol·K);T为吸附温度,K;Ea平均吸附能,kJ/mol.
拟合结果的各参数列于表3中.从相关系数上可以清楚的看出 Langmuir吸附等温线模型优于Freundlich和D-R模型,说明FGD-HA表面性质较为均一,其对 Cu2+的吸附过程为单分子层吸附.Freundlich方程中n=3.99,介于2~10之间说明此吸附过程是非常容易进行的[15-16].D-R模型中 Ea的取值更能反映出吸附机理.当 Ea<8KJ/mol时,吸附类型主要是物理吸附;当8

表4 等温线参数Table4 Equilibrium parameters of adsorption Cu2+onto FGD-HA
2.5 吸附热力学
吉布斯自由能变(ΔG°, kJ/mol)、焓变(ΔH°, kJ/mol)、熵变(ΔS°, kJ/mol/K)等热力学参数在吸附剂实际应用中具有指示性作用.采用热力学公式和 van’Hoff方程[式(10)~(12)]计算得到FGD-HA吸附Cu2+的热力学参数(表5).

式中: K为吸附平衡常数;Cs平衡吸附容量,mg/g; Ce为溶液中 Cu2+的平衡浓度,mg/L;R为气体常数,8.3145J/(mol·K);T为吸附温度,K.
负值的ΔG°和正值的ΔH°表明 FGD-HA对Cu2+的吸附是自发的吸热过程,ΔG°值随着温度的增加逐渐减小再次说明此吸附过程在较高温度下能获得较好的吸附效率. ΔS°为正值表明FGD-HA吸附Cu2+的过程其固液界面的混乱度增加,这与Hao等[18]利用氨基功能化的磁性纳米材料吸附Cu2+的研究结果一致.
2.6 共存离子的影响
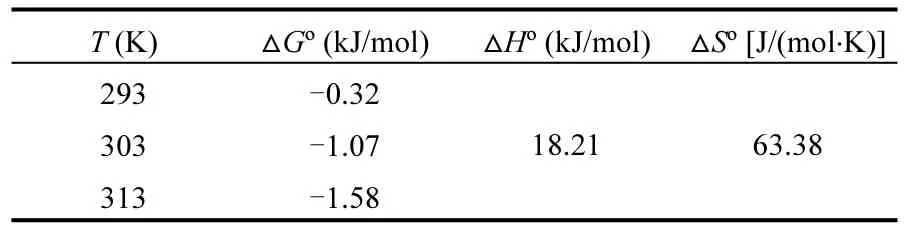
表5 FGD-HA吸附Cu2+的热力学参数Table5 Thermodynamic parameters of adsorption Cu2+onto FGD-HA
图4为不同阳离子(K+、Na+、Ca2+、Mg2+)对Cu2+吸附的影响.从图4可以看出,一价阳离子对 Cu2+吸附的影响要大于二价阳离子.当共存离子浓度从0增加到0.5mol/L时,Cu2+吸附受四种阳离子影响的顺序从大到小分别为 Na+>K+> Mg2+>Ca2+,吸附去除率从87.8%分别减至75.8%、76.6%、79.2%、80.4%.
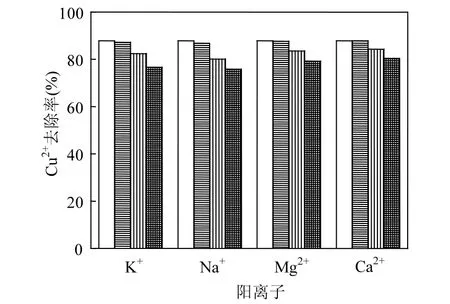
图5 共存离子对Cu2+去除率的影响Fig.5 Effect of co-existing ions on Cu2+removal
2.7 机理分析

图6 pH值对溶液中Ca2+浓度的影响Fig.6 Effect of pH on Ca2+concentration
图6为pH值对FGD-HA中Ca2+的溶出的影响.由图6可知,pH=2时,溶液中Ca2+浓度最高,当pH≥4时,溶液中Ca2+浓度基本稳定不变.主要原因是强酸性导致了FGD-HA的部分溶解.当Cu2+存在时,溶液中 Ca2+浓度相对于空白明显增加,这说明Cu2+与Ca2+之间发生了离子交换作用,同时也证实了D-R等温线模型的结论.在pH=6时,溶液中Ca2+浓度与空白想接近,说明在此 pH值下确有部分Cu2+生成沉淀而没有参与离子交换作用.
此外,通过对比磷酸钙(pKsp=28.7)、磷酸铜(pKsp=36.9)、硫酸钙(pKsp=5.04)和硫酸铜(易溶)的溶度积常数不难发现合成FGD-HA的路线是可行的(pKsp硫酸钙
2.8 吸附条件的响应面优化
2.8.1 回归模型 采用Design-Expert8.05软件对表2的试验数据进行二次多项式回归拟合,得到以Cu2+去除率(%)为响应值的方程:


表6 Box-Behnken模型的方差分析Table6 ANOVA for the fitted Box-Behnken model
模型方程的回归系数 R2=0.9812,表明此模型与实验结果拟合较好.方差分析(表6)结果表明,投加量、pH值、温度和初始浓度均对Cu2+的去除有显著影响,根据影响的程度排序为pH值>初始浓度>投加量>温度.在交互项中,只有温度-初始浓度交互作用对 Cu2+去除有显著影响,其余各因素之间的交互作用均不明显.
2.8.2 响应面分析 图4~图15为各因素交互影响的等高线图和响应曲面图.曲线越陡表明该因素对 Cu2+去除影响越大;曲面颜色越深表明Cu2+去除率越高[19-21].
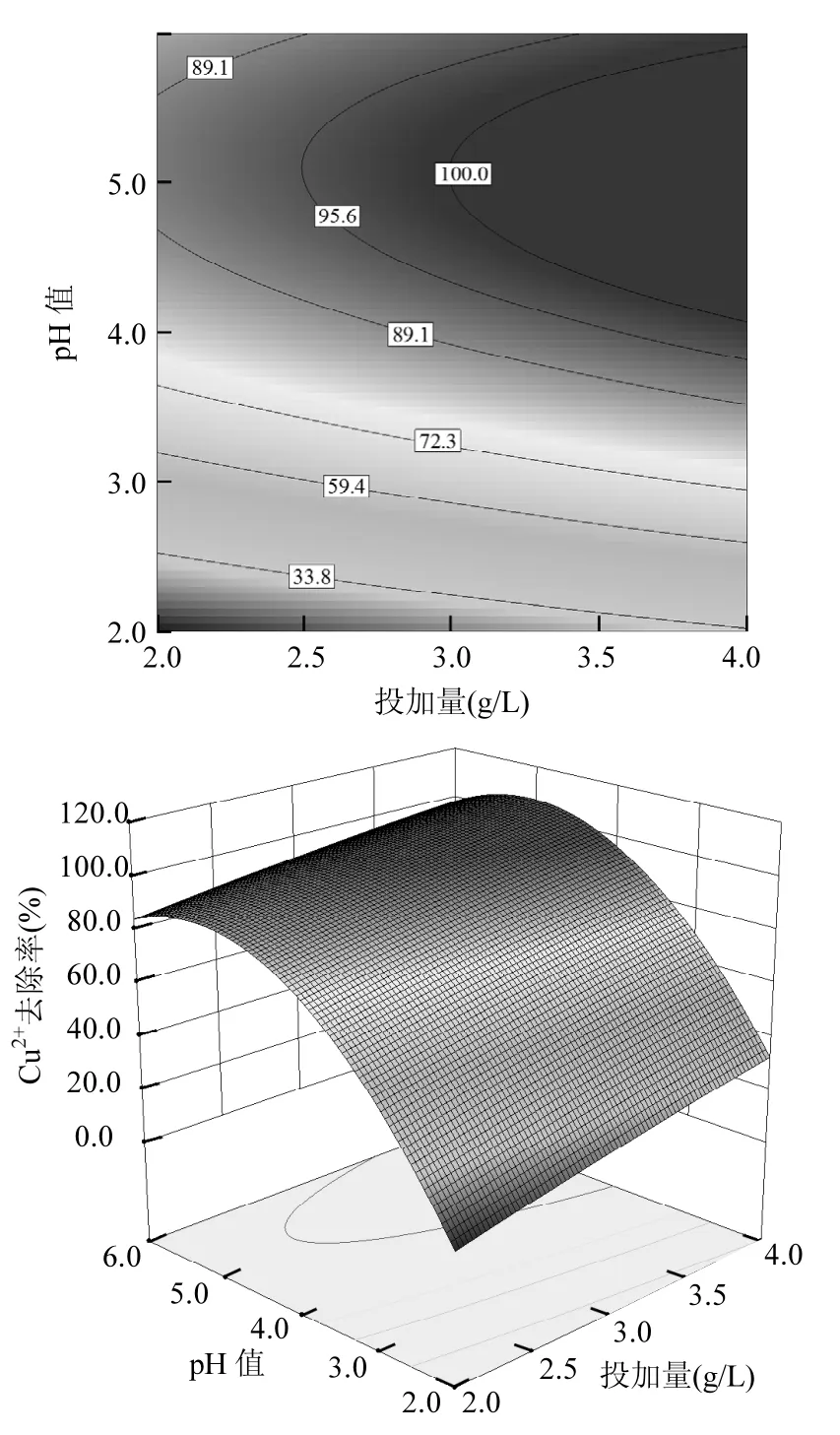
图7 pH值-投加量的等高线与响应曲面图Fig.7 Contour and surface plots for the effect of pH and dosage
从图4可以看出,在等高线图的右侧上部区域,即投加量>3.0g/L、pH值在4.5~6.0之间时图形颜色较深,Cu2+去除率较大;由图5可见,在等高线图右侧偏上部分,即投加量>3.5g/L、温度在28~38℃之间时图形颜色较深,Cu2+去除率效率较好;由图6可知,在等高线图的右侧下角区域,即投加量>3.0g/L、初始浓度小于50mg/L时图形颜色较深,Cu2+去除率较大;图7表明,当pH值介于4.5~6.0、温度介于28~40℃时,Cu2+去除率效率较好;从图8可以看出,当 pH>4.0、初始浓度<60mg/L时,Cu2+去除率较高;由图9可知,当Cu2+初始浓度<30mg/L时,即使在较低的温度下也可以获得较好的去除效果.总的来说提高溶液 pH值、提高FGD-HA投加量、增加吸附温度和降低Cu2+初始浓度都会提高Cu2+去除率.这是因为pH值的提高不仅降低了FGD-HA的溶解、质子与 Ca2+对吸附位点的竞争效应,而且增加了FGD-HA表面的电负性,有利于 Cu2+的吸附.随着FGD-HA投加量的增加,活性吸附位点随之增加,而 Cu2+初始浓度的减少其所需吸附位点也减少,所以提高投加量和减少初始浓度都有利于Cu2+的吸附.温度越高吸附效果越好,表明吸附过程涉及化学反应.原因可能是Cu2+易水合,打破水合作用释放出易被吸附的离子形态需要较高的能量;Cu2+与Ca2+发生离子交换是吸热过程,所以提高温度也可以相应增加Cu2+去除率.
2.8.3 验证实验 根据 Box-Behnken(BBD)模型分析结果得出利用FGD-HA去除废水中Cu2+的最佳条件为:投加量=3.11g/L、pH=4.96、温度=22.09℃、Cu2+初始浓度=24.75mg/L,此条件下Cu2+的去除率可达100%.在上述条件下开展验证实验,最终实测Cu2+去除率为97.4%,与预测值接近,再次说明该模型的可信性.
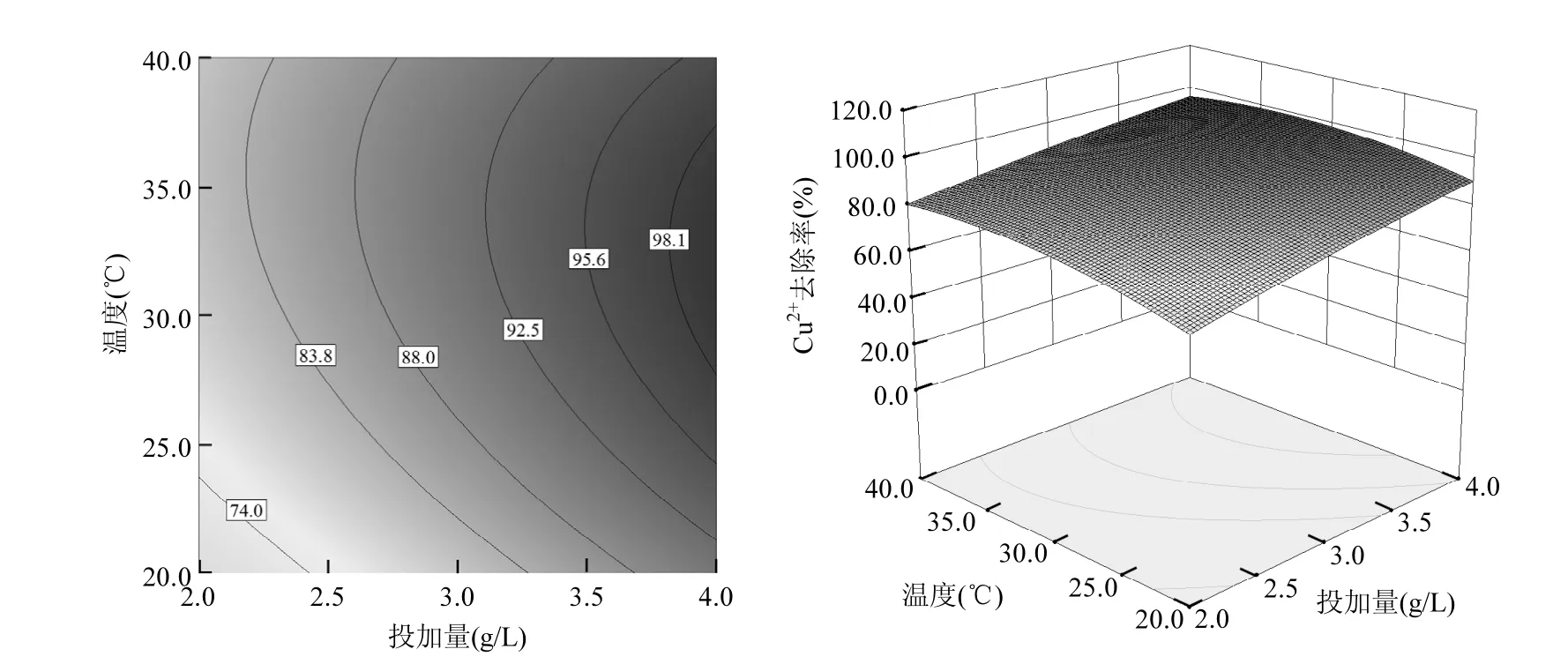
图8 温度-投加量的等高线与响应曲面图Fig.8 Contour and surface plots for the effect of temperature and dosage
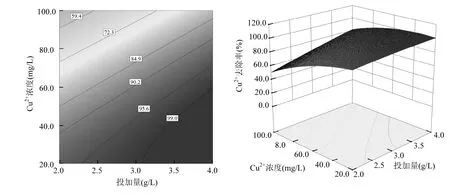
图9 初始浓度-投加量的等高线与响应曲面图Fig.9 Contour and surface plots for the effect of initial concentration and dosage
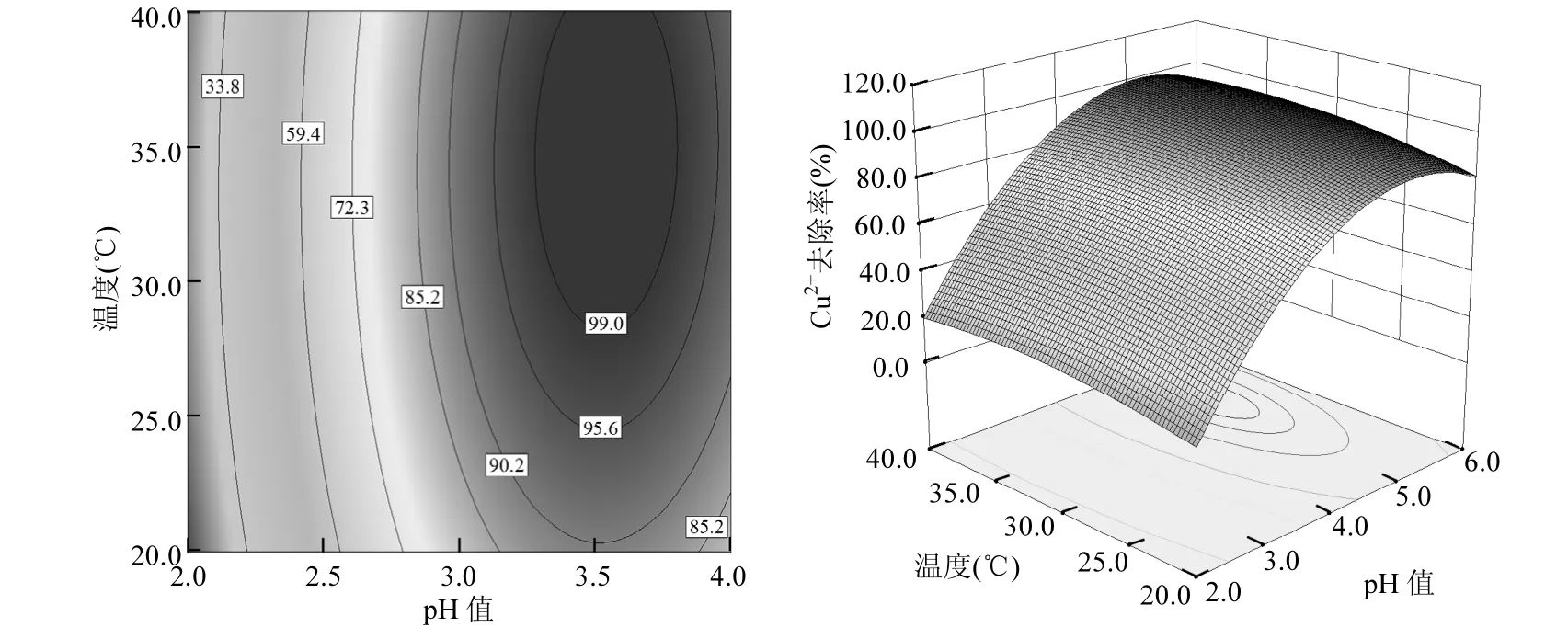
图10 pH值-温度的等高线与响应曲面图Fig.10 Contour and surface plots for the effect of pH and temperature
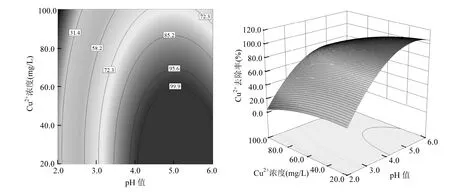
图11 pH-初始浓度的等高线与响应曲面图Fig.11 Contour and surface plots for the effect of pH and initial concentration

图12 初始浓度-温度的等高线与响应曲面图Fig.12 Contour and surface plots for the effect of initial concentration and temperature
3 结论
3.1 原脱硫石膏对废水中的Cu2+基本没有去除能力,而FGD-HA对Cu2+有较好的去除效果.
3.2 吸附动力学模型研究表明FGD-HA吸附Cu2+的过程符合伪二级动力学模型;分别采用Langmuir, Freundlich和 Dubinin-Radukevich等温线模型对Cu2+吸附数据进行拟合发现 Cu2+吸附更加符合Langmuir模型,根据Langmuir方程式计算出的最大吸附容量为30.30mg/g;吸附热力学研究发现FGD-HA吸附Cu2+的过程是自发的吸热过程.
3.3 机理分析结果表明,FGD-HA吸附 Cu2+的过程主要发生Ca2+与Cu2+离子交换反应.通过对比磷酸钙、磷酸铜、硫酸钙和硫酸铜的 pKsp发现Ca2+与Cu2+的离子交换是容易发生的.
3.4 响应面分析结果表明,在 FGD-HA吸附Cu2+系统中,投加量、pH值、温度和初始浓度对Cu2+去除率均有显著影响;在交互项中,只有温度-初始浓度对去除率有显著影响.
3.5 BBD模型优化结果表明,投加量=3.11g/L、pH=4.96、温度=22.09℃、Cu2+初始浓度=24.75mg/L为最优条件,在此最优条件下开展的验证实验结果与预测值较吻合,说明所建立的模型与实际相符.
[1] Liu Y, Chen M, Hao Y M. Study on the adsorption of Cu(II) by EDTA functionalized Fe3O4magnetic nano-particles [J]. Chemical Engineering Journal,2013,218(5):46–54.
[2] 唐文清,冯泳兰,李小明.掺硅碳羟基磷灰石的制备及其对 Pb2+的吸附性能 [J]. 中国环境科学,2013,33(6):1017–1024.
[3] Sismanoglu T, Kismir Y, Karakus S. Single and binary adsorption of reactive dyes from aqueous solutions onto clinoptilolite [J]. Journal of Hazardous Materials,2010,184(1–3):164–169.
[4] Meski S, Ziani S, Khireddine H. Removal of lead ions by hydroxyapatite prepared from the egg shell [J]. Journal of Chemical and Engineering Data,2010,55(9):3923–3928.
[5] 刘 涛,朱 林,薛建民,等.江苏省燃煤电厂脱硫石膏排放利用状况及综合利用对策 [J]. 江苏电机工程,2013,32(2):10–14.
[6] Ho Y S. Citation review of Lagergren kinetic rate equation on adsorption reaction [J]. Scientometrics,2004,59(1):171–177.
[7] Gómez del Rı′o J A, Morando P J, Cicerone D S. Natural materials for treatment of industrial effluents: comparative study of the retention of Cd, Zn and Co by calcite and hydroxyapatite. Part I: batch experiments [J]. Journal of Environmental Management,2004,7:169–177.
[8] Lin K, Pan J, Chen Y, et al. Study the adsorption of phenol from aqueous solution on hydroxyapatite nanopowders [J]. Journal of Hazardous Materials,2009,161:231–240.
[9] Ho Y S. Review of second order models for adsorption systems [J]. Journal of Hazardous Materials,2006,B136(3):681–689.
[10] 包汉峰,杨维薇,张立秋,等.污泥基活性炭去除水中重金属离子效能与动力学研究 [J]. 中国环境科学,2013,33(1):69–74.
[11] Zhang J, Shan W, Ge J, et al. Kinetic and Equilibrium Studies of Liquid-Phase Adsorption of Phosphate on Modified Sugarcane Bagasse [J]. Journal of Environmental Engineering,2012,138(3):252–258.
[12] 高淑玲,杨翠玲,罗鑫圣,等.坡缕石黏土污泥对水相中亚甲基蓝吸附研究 [J]. 中国环境科学,2014,34(1):78–84.
[13] 陈 颖,杨朝晖,李小江,等.茶树菇废菌体对水中Cr(VI)吸附的响应面优化及机理研究 [J]. 环境科学学报,2010,30(8):1593–1600.
[14] Yan Y, Dong X, Sun X, et al. Conversion of waste FGD gypsum into hydroxyapatite for removal of Pb2+and Cd2+from wastewater [J]. Journal of Colloid and Interface Science,2014,429:68–76.
[15] Chen H, Zhao J, Dai G, et al. Adsorption characteristics of Pb(II) from aqueous solution onto a natural biosorbent, fallen Cinnamomum camphora leaves [J]. Desalination,2010,262(1-3):174–182.
[16] 张秀蓉,龚继来,曾光明,等.磁性氧化石墨烯制备及去除水中刚果红的研究 [J]. 中国环境科学,2013,33(8):1379–1385.
[17] Mobasherpour I, Salahi E, Pazouki M. Comparative of the removal of Pb2+, Cd2+and Ni2+by nano crystallite hydroxyapatite from aqueous solutions: Adsorption isotherm study [J]. Arabian Journal of Chemistry,2012,5:439–446.
[18] Hao Y M, Chen M, Hu Z B. Effective removal of Cu(II) ions from aqueous solution by amino-functionalized magnetic nanoparticles [J]. Journal of Hazardous Materials,2010,184(1–3):392–399.
[19] 张 萌,邱 琳,于晓晴,等.亚铁盐除磷工艺的优化研究 [J]. 中国环境科学,2012,32(7):1223–1227.
[20] Muralidhar R V, Chirumamila R, Marchant R. Response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon source [J]. Biochemistry Engineering Journal,2001,9(1):17–23.
[21] Liu C, Liu Y, Liao W, et al. Application of statistically based experimental designs for the optimization of nisin production from whey [J]. Biotechnology Letters,2003,25(8):877–882.
Cu2+removal from wastewater using hydroxyapatite prepared from FGD gypsum.
YAN Yu-bo1,2, DONG Xiao-li1,2, SUN Xiao-lei1,2, LI Jian-sheng1,2, SHEN Jin-you1,2, HAN Wei-qing1,2, LIU Xiao-dong1,2, SUN Xiu-yun1,2*, WANG Lian-jun1,2*
(1.Department of Environmental Science and Engineering, Nanjing University of Science and Technology, Nanjing210094, China;2.Jiangsu Key Laboratory of Chemical Pollution Control and Resources Reuse, Nanjing210094, China). China Environmental Science,2014,34(8):2040~2048
Hydroxyapatite (FGD-HA) was synthesized from waste FGD gypsum using hydrothermal method. FGD-HA was characterized by X-ray diffraction (XRD) and scanning electron microscope (SEM) and investigated as adsorbent for removal Cu2+from wastewater. The sorption kinetics, isotherms and thermodynamics of Cu2+adsorption onto FGD-HA were investigated by batch tests. The kinetics was evaluated utilizing pseudo-first order and pseudo-second order models, and the experimental data agreed well with the pseudo-second order model due to its relatively high R2value (0.9998). The equilibrium data were further analyzed by using the Langmuir, Freundlich and Dubinin-Radushkevich models. Equilibrium sorption of Cu2+onto FGD-HA had best fitness with the Langmuir model. Response surface methodology (RSM) employed to optimize the adsorption process parameters. The optimum operating conditions were determined as dosage of3.11g/L, pH of4.96, temperature of22.09℃, initial concentration of24.75mg/g, and the removal efficiency for Cu2+was found to be100%. The verification experiment was also carried out at same conditions and the result was97.4%, confirming that the model was effective.
t:FGD gypsum;hydroxyapatite;adsorption;response surface methodology
X705
:A
:1000-6923(2014)08-2040-09
严玉波(1988-),男,江苏连云港人,南京理工大学环境与生物工程学院博士研究生,研究方向为工业固体废弃物的减量化与资源化.
2013-12-05
江苏省科技支撑计划(BE2011834)
* 责任作者, 教授, sunxyun@njust.edu.cn(孙秀云),wanglj@njust.edu. cn(王连军)

