光子晶体的分析化学应用研究新进展
陈 蕴, 郭振朋, 王进义, 陈 义,2*
(1.中国科学院化学研究所,活体分析化学院重点实验室,北京100190;2.北京分子科学国家实验室,北京100190;3.西北农林科技大学,陕西杨凌712100)
我们曾经写过一篇关于光子晶体(PCs)的综述[1],对其理论基础、命名分类以及制备方法进行了归纳。本综述将在前文的基础上,对PCs在分析领域中应用的新进展,作进一步的归纳和分析。
如前文所述,PCs是一种发现于上世纪末的具有周期性折射率结构的新颖材料[2-4]。与半导体调控电子的传播类似,PCs能调控光子的传播。当一种PC的折射率变化周期与某一光波波长处于同一量级时,它禁阻该光在其体内传播,即出现了光子带隙现象,其值可通过布拉格方程求解得到。
PCs可分为实心和空心两种。空心PCs又称为反蛋白石(reverse opal)。空心和实心PCs都可通过机械加工[5]、刻蚀[6-8]和自组装[9-11]等法来制备。实心PCs常采用合成颗粒经自组装而制得,而空心PCs则常通过去除包埋于某种高聚物基体中的实心PCs来制得。比如单分散胶体粒子可在溶液中自组装成三维有序的结构,形成胶体晶体阵列(crystalline colloidal arrays,CCAs[12-14]);若在凝胶或高分子预聚物中制备CCAs,固化后经煅烧、化学刻蚀或溶解等方法即可除去颗粒,变成空心CCAs。
下面我们探讨光子晶体在传感和分离研究中的新近发展。
1 光子晶体传感
光子晶体的晶格常数或折光率周期可因多种因素发生变化并伴随颜色变化,由此可实现传感测定。比如,利用对光、电、磁、热等有响应的材料,可制得晶格常数变化型PC传感器;而利用填充或吸附物质等办法,则可制得折射率变化型PC传感器。一般地,根据制备原理和测定对象的不同,PC传感可有生物、化学、物理之分。
1.1 生物传感
PCs可用于葡萄糖、果糖、胰岛素[15,16]等生物分子的传感测定,有单信号传感和多信号传感两类。Ayyub 等[17]和 Endo 等[18]对单信号传感有较多的研究[19,20],主要依据晶格常数引起的颜色变化来测定。比如用2-溴乙基苯硼酸修饰聚苯乙烯类PCs,可对不同浓度果糖溶液产生蓝、绿、橘红等颜色变化[17];而在环烯聚合物薄膜上印制二维光子晶体(见图1)并借助胰岛素抗体与胰岛素的免疫反应,可实现对葡萄糖的选择颜色响应,能检测到1.0 μU/mL 的葡萄糖[18]。
在单信号传感测定研究的同时,也出现了双与多信号的PC传感器,如Jin等[21]利用聚丙烯酰胺、导电聚合物3,4-乙烯二氧噻吩和葡萄糖氧化酶制备出的空心PC涂覆电极,构建了葡萄糖的光/电双响应传感器。它由糖与酶的作用来诱使凝胶收缩,产生光响应信号;而以3,4-乙烯二氧噻吩产生电流响应信号。

图1 二维打印光子晶体在(a)平面和(b)弯曲状态下的颜色变化及(c)反射光谱[18]Fig.1 (a)Stretched and(b)bended structural colors and(c)reflection spectrum of a flexible 2D-PC fabricated using printing technology[18]
另外,在生物大分子特别是DNA等[22-24]的传感测定上,也有新的研究进展,如Meade等[25]在光谱编码的多孔硅粒子上偶联寡核苷酸,构建了能高效快速传感检测DNA的新方法。将光子晶体和波导技术结合还可以检测单链DNA[26]。
光子晶体在糖尿病、癌症等重大疾病的临床研究中的应用[27]可能会有新的发展,值得大家关注。
1.2 化学传感
光子晶体可用于传感测定离子、pH、气体、有机溶剂等化学物质或物理化学参数。其中离子的传感测定主要是基于PCs中识别基团与靶离子相互作用引起的渗透压或者自由能的改变来实现,属晶格常数型传感。Arunbabu等[28]在聚丙烯酰胺水凝胶体系中组装聚苯乙烯颗粒,结合脲酶水解尿素产生的和来构建传感器。如该反应能被Hg2+所抑制且与浓度相关,由此构建Hg2+的传感测定方法,检测限达1 ppb。由硫脲功能化空心PCs,还能传感测定不同浓度的 Cd2+[29]。
Griffete 等[30]结合 Langmuir-Blodgett技术[31]制备出了由二维缺陷层来增敏的空心型凝胶PC(见图2),再嵌入聚甲基丙烯酸甲酯就可制得pH传感器。Yang等[32]由蝴蝶翅膀得到灵感,用聚甲基丙烯酸甲酯制备具有分层结构PC的pH传感器。Shin等[33]则由共聚甲基丙烯酸羟乙酯来制备pH传感器。
为同时测定多种离子,Huang等[34]设计出了多禁带光子晶体微点阵芯片,利用8-羟基喹啉为探针,可对12种金属离子进行同时识别和测定(见图3)。这是一种简便的高通量传感测定策略,有发展前景。
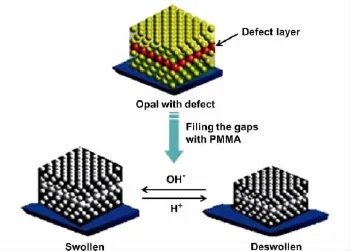
图2 以二维缺陷层增敏之空心凝胶光子晶体及其随pH变化而出现的体积响应示意图[30]Fig.2 pH-dependent volumetric response of an inverse opal hydrogel prepared from a sacrificial opal with an enhancive defect layer[30]
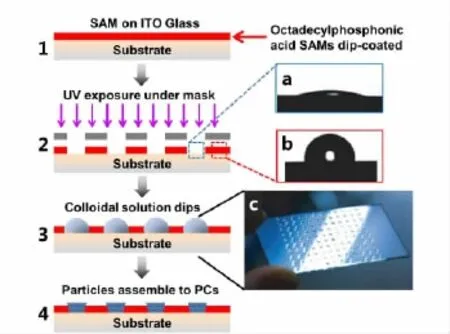
图3 利用浸润性差异来制备光子晶体芯片的过程[34]Fig.3 Schematic procedure for fabricating PC dots on a differential wettability patterned substrate[34]1.Form a single molecular layer of octadecylphosphonic acid on an indium tin oxide glass;2.photolithography via UV light through a micro-mask to produce different hydrophilic area with contact angles of(17.7±2.8)°or(100.9±3.4)°(a and b),respectively;3.selective adsorption of latex droplets on the hydrophilic areas;and 4.self-assembly of the colloidal particles to form ordered PC dots.
将气体渗入到PCs中,也能改变PCs的晶格常数或折射率,可用于气体的定量测定。比如Hong等[35]以SiO2实心PC为模板,在玻璃片上制备空心型聚二甲氨基丙基甲基丙烯酰胺PC薄层,其晶格常数可随CO2含量(0~100%,v/v)增加而增大。此外,利用中空光子晶体光纤,结合拉曼光谱法还能建立氧、氮等气体传感器[36];由聚苯胺修饰PCs,可制得对NH3和HCl有可逆变色效果的气体传感器[37]。
类似地,将溶剂渗入PCs也会改变其晶格常数或折射率,可用于构建溶剂传感器。Wang等[38]利用旋涂法[39,40]制备得到的TiO2与聚甲基丙烯酸甲酯-聚羟乙基甲基丙烯酸酯-聚乙二醇二甲基丙烯酸酯复合光子晶体薄膜,会因接触溶剂的折射率不同而显示不同颜色(见图4)。Colodrero等[41]利用TiO2和SiO2的疏水性差异,提高了对折射率相似而亲疏水性不同的有机溶剂的分辨力。
1.3 物理传感
光子晶体的晶格常数也可以利用诸如拉伸、加压、光照等物理方法来改变,可用于物理参数的传感测定。比如,Iwayama等[42]制得的对压力有响应的弹性凝胶光子晶,能在压力比为1.0、0.85、0.80、0.75时,分别显示黄、浅绿、深绿、蓝等颜色;Ozin等[43]制得的柔性光子晶体薄膜,则可在按压时显示彩色指纹(见图5),且显色可逆,能反复使用,适合于制作指纹识别器,用于防伪等工作。
把液晶和PCs结合起来,可开发出新的传感测定方法,或为液晶提供新的研究思路。比如,Kubo等[44,45]将液晶分子完全渗入到空心的 PC 中(图6a),用以研究液晶在受限空间中的状态;Liu等[46]则在80℃下,将87.3%的向列型液晶E7与12.7%的4-丁基-4-甲氧基偶氮苯混合,再旋涂到空心PC的表层,使之在毛细作用下部分渗入到空心的PC中(图6b),用以构建液晶的传感测定方法。其原理是,4-丁基-4-甲氧基偶氮苯经紫外光照后会发生由反式到顺式的构象变化,由此可导致空心PC的折射率和颜色变化。
1.4 分子印迹光子晶体传感
光子晶体自身并无选择性,所以需要与选择识别原理如免疫反应等联用。免疫反应有很多优点,但所用的蛋白质等识别原件成本高且易降解,难保存。一种可能的解决方案是开发利用核酸适体、分子印迹等人工选择技术。核酸适体目前还需要复杂的筛选和结构改造过程,还难以广泛使用。与此不同,分子印迹技术在色谱领域研究多年,原理和合成过程也不复杂,所以已顺利应用到光子晶体传感研究之中[47]。比如 Meng等[48]利用分子印迹空心型凝胶薄膜PC,制得了响应时间不到30 s的阿托品传感器,能检测人尿样品,检测限为1 pg/mL;通过改变印迹模板分子,该法还可用于制作氯胺酮传感器,其颜色会随氯胺酮浓度增大而从绿色变到红色[49]。利用分子印迹PCs构建的传感器还有双酚A[50]、手性氨基酸[51]、有机磷化合物[52]等。分子印迹PC传感器的选择性和优点可借Peng等[53]的工作证明:他们制备的香草醛传感器,能抗甲基香草醛和乙基香草醛等类似物的干扰,且对10-12~10-3mol/L的香草醛有响应,颜色可从波长451 nm变到486 nm,甚为宽泛。
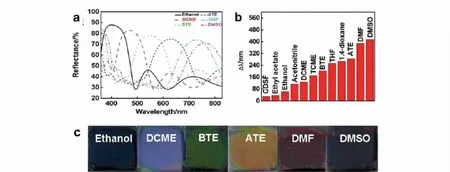
图4 1D PC在不同溶剂中的(a)反射光谱图和(b)禁带位移图以及(c)光照图[38]Fig.4 (a)R eflective spectra of a 1D PC in different solvents,(b)shift of the photonic stop band of the 1D PC in different solvents,and(c)photographs of the 1D PC in different solvents[38]
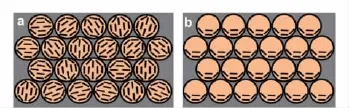
图6 液晶分子(a)完全和(b)部分渗入空心型PC中的取向模型(圈中短线代表液晶分子取向)[46]Fig.6 Orientation of liquid crystal molecules(the short line inside the circles)in the(a)completely and(b)partially infiltrated spheroidal voids in inverse opal film[46]
2 分离应用
以排列规整的PCs做色谱分离介质,可形成新的分离机制,用以构建高效的分离分析方法。根据范第姆特方程(即H=A+B/v+Cv,H为塔板高度,v为流动相速度,A、B、C为与粒径和填充规整度有关的参数),这种由小颗粒堆积的规则结构会有效降低塔板高度,提高分离效率。在可见光范围,由颗粒组装的PCs还存在规整的纳米通道,非常有利于产生滑流现象[54](见图7)。滑流可缩短色谱分离的传质过程和分离时间,提高分离效率。纳米通孔还可以产生筛分效果,能用于尺寸分离。利用纳米孔做电泳分离,可以在超高电场下产生超高效或超高速分离。因此,PCs在分离领域中深具研究价值。
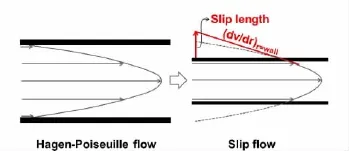
图7 抛物线粘滞流(左)和滑流(右)的对比图[54]Fig.7 Comparison of Hagen-Poiseuille flow(left)with slip flow(right)[54]
Wirth课题组[54]就利用了光子晶体的滑流效应来提高色谱的分离效率。他们用烷基三氯硅烷修饰的470 nm的SiO2颗粒组装成长21 mm、内径75 μm的毛细管PC柱,由压力驱动,在2 min内分离了两种荧光标记的BSA(图8a和b),发现其效率远远高于超高压液相色谱(UPLC,图8c)。这种柱子还可在常温下于40 s内分离出单克隆抗体,分离速度是UPLC的10倍。最近,他们用8种不同粒径的SiO2光子晶体[55]研究了甲苯和水的滑流机制,发现甲苯不会产生滑流现象,而水则会,其滑移长度为(63±2)nm。
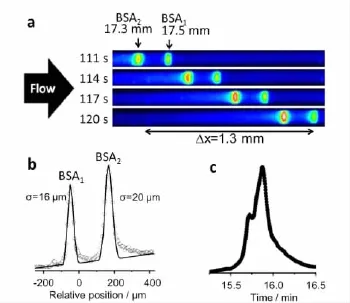
图8 两种荧光标记的BSA在(a、b)PC柱上与(c)UPLC柱上的分离效果比较[54]Fig.8 Comparison of(a and b)PC separation with(c)UPLC separation using two labeled BSA as testing samples[54]a.Time series of fluorescence micrographs from PC column;b.chromatogram plotted using the imaging(O)and Gaussian fitting(-)data;c.The chromatogram was obtained using a 50-mm long commercial UPLC column.
由颗粒组装得到的可见光PCs仅具有纳米级分离通孔,会产生很高的背压,难以用机械泵来推动分离,但可采用电渗泵来分离,也可直接实施电动或电泳分离。Wirth课题组[56]还利用330 nm的SiO2颗粒组装的12 mm ×75 μm ID 及100 μm ID 的毛细管PCs电动分离了甲醇中的DiI-C12(1,1-二(十八烷基)-3,3,3,3-四甲基吲哚羰花青高氯酸盐),效率达到230 nm塔板高度。当用C1和C18修饰PCs时,在1 000 V/cm电场下分离3种蛋白质(见图9)的效率则可达到50 nm的板高,即分子扩散仅约10 nm,其分离速度可高达 0.15 mm/s[57]。Qu 等[58]利用金纳米粒子修饰SiO2颗粒来组装PC,可在18 min内电色谱分离苯类样品,效率约2.5×105理论塔板数;而液相色谱则需时100 min。
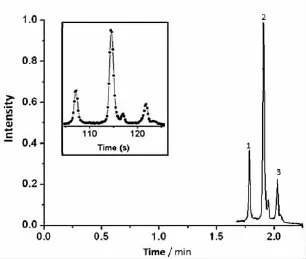
图9 溶菌酶(1)、核酸酶A(2)和细胞色素C(3)的PC电动色谱分离图[57]Fig.9 Electrochromatogram of lysozyme(1),ribonuclease A(2)and cytochrome C(3)separated on a PC column[57]
利用光子晶体不仅可以高效、重现,而且可以高速分离物质。我们的研究表明[59],利用通道长度仅2.2 mm长的光子晶体,便能在4 s内实现4种氨基酸的基线分离。这比 Zheng等[60]以及 Gong等[61]的分离速度更快;而用通道长度10 mm长的光子晶体,可在12 s内分离3种肽(见图10)。由FITC(异硫氰酸荧光素)测得的塔板高度是300 nm。
由于光子晶体具有数十纳米级别的通孔,因此会和凝胶一样,具有尺寸筛分效应。Zeng等[62]就利用了900 nm的SiO2颗粒组装的光子晶体,实现了对0.05~50 kbp DNA、20~200 kDa蛋白质等的尺寸分离,可与凝胶电泳相比。他们[63]还曾利用非对称脉冲电泳和二维光子晶体对2~50 kbp DNA进行连续的分离,并研究了DNA分离过程中的动力学行为[64],证实蠕动模型[65]等的可用性。
光子晶体用于分离研究的最大挑战在于如何快速制备连续、没有裂痕和空泡的光子晶体柱。目前国外所公布的方法,多数速度慢,操作繁琐,要用其制备一根较长的光子晶体柱通常需要数天乃至数周的时间。为了解决这一问题,我们发展了一种一步快速制作稳定光子晶体的方法,即热加速蒸发自组装结合尾端热固定的方法[59],可在15 min内于微流控微通道中组装出2 cm长无裂痕的二氧化硅光子晶体(见图11),能在高达2 000 V/cm的电场下,连续工作至少5 h,其在水溶液中保存2个月仍可继续使用。
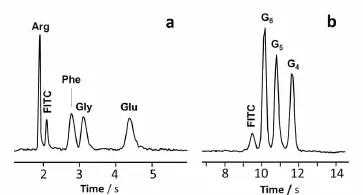
图10 基于光子晶体的超快速分离FITC标记(a)氨基酸和(b)甘氨酸4~6 肽[59]Fig.10 PC-based ultrafast separation of FITC-labeled(a)amino acids or(b)4-6 glycine oligopeptides[59]
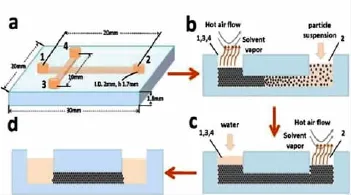
图11 玻璃微流控芯片中快速组装稳定光子晶体的流程图[59]Fig.11 Flow chart for the rapid assembly of stable PCs into glass microchip channels[59]
3 展望
就目前所发表的论文看,关于光子晶体的传感和分析应用研究的报道较多,形式和内容变化也比较丰富;但关于光子晶体在分离领域中的研究还相对较少,进展不多。其主要困难在于:1)理想的光子晶体柱的制备非常困难而且费时,不利于推广应用;2)细颗粒光子晶体柱的背压很高,很难利用常规的机械泵来推动分离;3)缺乏关于光子晶体柱分离的理论指导。
由此可知,关于光子晶体传感测定的研究会进一步加快发展的速度,而关于光子晶体的分离应用研究,还会有一段沉淀时期,目前的发展不会很快,其迅速发展有赖于上述3个问题的有效解决。我们目前正在着手解决前两个问题。其中第一个问题已有较好的解决策略和结果,但还有很大的发展空间;第二个问题的研究正在进行中,相信在不太长的时间内会有一个初步的策略提出;第三个问题国际上已经有些研究,但并不透彻,可能需要重新开始。我们也将做些尝试。我们的大胆预测是,基于光子晶体的分离分析方法,在未来10年内会进入快速发展时期。欢迎有志者一同来参与这一新领域的研究。
[1] Chen Y,Li J C.Chinese Journal of Chromatography(陈义,李晋成.色谱),2009,27(5):573
[2] John S.Phys Rev Lett,1987,58(23):2486
[3] Yablonovitch E.Phys Rev Lett,1987,58(20):2059
[4] Ho K M,Chan C T,Soukoulis C M.Phys Rev Lett,1990,65(25):3152
[5] Ozbay E,Abeyta A,Tuttle G,et al.Phys Rev B,1994,50(3):1945
[6] Campbell M,Sharp D N,Harrison M T,et al.Nature,2000,404(6773):53
[7] Deubel M,Von Freymann G,Wegener M,et al.Nat Mater,2004,3(7):444
[8] Ullal C K,Maldovan M,Thomas E L,et al.Appl Phys Lett,2004,84(26):5434
[9] Lee S K,Yi G R,Yang S M.Lab Chip,2006,6(9):1171
[10] Hayward R C,Saville D A,Aksay I A.Nature,2000,404(6773):56
[11] Gates B,Xia Y N.Adv Mater,2000,12(18):1329
[12] Hiltner P A,Krieger I M.J Phys Chem,1969,73(7):2386
[13] Hiltner P A,Papir Y S,Krieger I M.J Phys Chem,1971,75(12):1881
[14] Krieger I M,O Neill F M.J Am Chem Soc,1968,90(12):3114
[15] Sharma A C,Jana T,Kesavamoorthy R,et al.J Am Chem Soc,2004,126(9):2971
[16] Walker J P,Asher S A.Anal Chem,2005,77(6):1596
[17] Ayyub O B,Ibrahim M B,Briber R M,et al.Biosens Bioelectron,2013,46(15):124
[18] Endo T,Sato M,Kajita H,et al.Lab Chip,2012,12(11):1995
[19] Endo T,Ozawa S,Okuda N,et al.Sensor Actuat B-Chem,2010,148(1):269
[20] Endo T,Ueda C,Kajita H,et al.Microchim Acta,2013,180(9):929
[21] Jin L,Zhao Y J,Liu X,et al.Soft Matter,2012,8(18):4911
[22] Zhao Y J,Zhao X W,Hu J,et al.Angew Chem Int Ed,2009,48(40):7350
[23] Zhao Y J,Zhao X W,Hu J,et al.Adv Mater,2009,21(5):569
[24] Hu J,Zhao X W,Zhao Y J,et al.J Mater Chem,2009,19(32):5730
[25] Meade S O,Chen M Y,Sailor M J,et al.Anal Chem,2009,81(7):2618
[26] Toccafondo V,Garcia-Ruperez J,Banuls M J,et al.Opt Lett,2010,35(21):3673
[27] Ge J P,Yin Y D.Angew Chem Int Ed,2011,50(7):1492
[28] Arunbabu D,Sannigrahi A,Jana T.Soft Matter,2011,7(6):2592
[29] Lin FY,Yu L P.Anal Methods,2012,4(9):2838
[30] Griffete N,Frederich H,Maitre A,et al.J Mater Chem,2011,21(34):13052
[31] Massé P,Pouclet G,Ravaine S.Adv Mater,2008,20(3):584
[32] Yang Q Q,Zhu S M,Peng W H.ACS Nano,2013,7(6):4911
[33] Shin J,Han S G,Lee W.Anal Chim Acta,2012,752:87
[34] Huang Y,Li F Y,Qin M.Angew Chem Int Ed,2013,52(28):7296
[35] Hong W,Chen Y,Feng X,et al.Chem Commun,2013,49(74):8229
[36] Yang X,Chang A S P,Chen B,et al.Sensor Actuat B-Chem,2013,176:64
[37] Liu C H,Gao G Z,Zhang Y Q,et al.Macromol Rapid Commun,2012,33(5):380
[38] Wang Z H,Zhang J H,Li J X,et al.J Mater Chem,2011,21(4):1264
[39] Bonifacio L D,Lotsch B V,Puzzo D P,et al.Adv Mater,2009,21(16):1641
[40] Kurt P,Banerjee D,Cohen R E,et al.J Mater Chem,2009,19(47):8920
[41] Colodrero S,Ocana M,Miguez H.Langmuir,2008,24(9):4430
[42] Iwayama Y,Yamanaka J,Takiguchi Y,et al.Langmuir,2003,19(4):977
[43] Ozin G A,Arsenault A C.Materials,2008,11(7/8):44
[44] Kubo S,Gu Z Z,Takahashi K,et al.J Am Chem Soc,2002,124(37):10950
[45] Kubo S,Gu Z Z,Takahashi K,et al.J Am Chem Soc,2004,126(26):8314
[46] Liu Y J,Cai Z Y,Leong E S P,et al.J Mater Chem,2012,22(15):7609
[47] Meng L,Meng P J,Zhang Q Q,et al.Materials Review A(孟梁,孟品佳,张庆庆,等.材料导报A),2012,26(12):61
[48] Meng L,Meng P J,Zhang Q Q ,et al.Forensic Sci Int,2013,231(1/2/3):6
[49] Meng L,Meng P J,Zhang Q Q,et al.Anal Chim Acta,2013,771:86
[50] Griffete N,Frederich H,Maitre A,et al.J Colloid Interf Sci,2011,364(1):18
[51] Zhang Y X,Zhao P Y,Yu L P,et al.Sensor Actuat B-Chem,2013,181:850
[52] Liu F,Huang S Y,Xue F,et al.Biosens Bioelectron,2012,32(1):273
[53] Peng H L,Wang S Q,Li Y B,et al.J Agric Food Chem,2012,60(8):1921
[54] Wei B,Rogers B J,Wirth M J.J Am Chem Soc,2012,134(26):10780
[55] Rogers B J,Wirth M J.ACS Nano,2013,7(1):725
[56] Malkin D S,Wei B C,Fogiel A J,et al.Anal Chem,2010,82(6):2175
[57] Wei B C,Malkin D S,Wirth M J.Anal Chem,2010,82(24):10216
[58] Qu Q S,Peng S W,Mangelings D,et al.Electrophoresis,2010,31(3):556
[59] Liao T,Guo Z P,Chen Y,et al.Lab Chip,2013,13(4):706
[60] Zheng S P,Ross E,Wirth M J,et al.J Am Chem Soc,2006,128(28):9016
[61] Gong M J,Bohn P W,Sweedler J V.Anal Chem,2009,81(5):2022
[62] Zeng Y,Harrison D J.Anal Chem,2007,79(6):2289
[63] Zeng Y,He M,Harrison D J.Angew Chem Int Ed,2008,47(34):6388
[64] Nazemifard N,Bhattacharjee S,Harrison D J,et al.Angew Chem Int Ed,2010,122(19):3398
[65] Zimm B H.J Chem Phys,1991,94(3):2187

