金属标记结合高效液相色谱-选择离子监测质谱的蛋白质绝对定量新方法
李佳斌, 周廉淇, 颜 辉, 李楠楠, 郝斐然, 田 芳, 张养军
(蛋白质组学国家重点实验室,北京蛋白质组研究中心,军事医学科学院放射与辐射医学研究所,北京102206)
随着高效液相色谱技术、质谱仪器和技术的不断发展,研究人员已经可以实现对蛋白质组的深度覆盖。例如,Ruedi[1]实验室使用电泳-反相色谱两维分离结合质谱分析策略对人类骨肉瘤细胞系进行分析,成功鉴定了10 006个蛋白质;Mann[2]实验室使用离子交换-反相色谱两维分离策略结合质谱分析技术对HeLa细胞系进行分析,鉴定到10 025个蛋白质;Ding等[3]采用两维短梯度反相色谱分离策略结合质谱分析技术在12 h内鉴定了来自于哺乳动物细胞系的8 000个蛋白质。尽管如此,定性结果并不能提供诸如不同生理病理条件下蛋白质的差异表达状况以及蛋白质绝对表达量的信息,而这些信息与生物学问题和重大疾病调控机制相关联,所以我们亟须在定性鉴定的基础上,开发出高灵敏度、高准确度的定量方法。定量蛋白质组学可以分为相对定量和绝对定量,相对定量蛋白质组学主要是对不同生理病理条件下蛋白质的差异表达状况进行相对比较分析,而绝对定量蛋白质组学则是测定目标蛋白质的绝对含量。基于质谱的绝对定量和相对定量方法目前常使用稳定同位素标记来区分来自不同状态生物样本中的蛋白质或酶切肽段。现有的稳定同位素标记方法,包括稳定同位素标记标准肽段技术(absolute protein quantitation using stable isotope labeled peptides,AQUA)[4];代谢标记,如细胞培养条件下稳定同位素标记技术(stable isotope labeling by amino acids in cell culture,SILAC)[5];化学标记,如同位素标签相对标记与绝对定量技术(isobaric tags for relative and absolute quantitation,iTRAQ)[6]和质量差异标签相对与绝对定量技术(mass differential tags for relative and absolute quantification,mTRAQ)[7];酶促标记(如18O 标记[8,9])。这些基于同位素的标记技术都存在同位素试剂价格昂贵,同位素簇峰之间相距较近的问题,使得这些同位素峰在质谱分析时会发生相互干扰,从而给定量结果带来误差。为了解决这个问题,我们的研究目的是探索非同位素标记方法。
2004年,Whetstone等[10]首次以化学性质相近的稀土金属元素作为质量标签,提出了“元素标记亲和标签”(element-coded affinity tags,ECAT)的新方法,其优点是采用了金属元素作为质量标签,可以进行多重标记。另外,选择金属元素使得目标峰之间相距较远,但不足之处是该方法标记的是肽段中的半胱氨酸,无法对不含半胱氨酸的肽段进行定量。Liu等[11]使用二乙烯三胺五乙酸(DTPA)螯合稀土金属元素钇、铽(Y、Tb)作为金属标记标签对肽段的N端进行标记,可实现对所有肽段的标记和定量,但存在所选择的双功能试剂标记效率不高的问题。针对此问题,Wang等[12]用羟基琥珀酰亚胺-四氮杂环十二烷四乙酸(DOTA-NHS)作为螯合试剂,解决了原方法采用螯合试剂DTPA标记效率不高的问题,并通过对标记方法的优化使金属标记效率接近100%。之后采用4种不同的镧系金属(Tb、Ho、Tm、Lu),实现了对合成肽段和马心肌红蛋白胰蛋白酶酶切肽段的4重相对定量。另外,Wang等[13]将金属标记与多反应监测技术(MRM)相结合,成功地对腾冲嗜热菌蛋白进行了绝对定量,线性范围内的R2值大于0.99,RSD值小于15%。同金属标记方法相比,传统的AQUA技术采用化学合成方法,所需同位素试剂价格昂贵,制备周期长,质控过程复杂,且无法标记目标样品实现反相标记,而金属标记方法试剂价格低廉,操作简单,标记效率高,可以增强质谱信号,便于多重金属标记,无背景干扰。综上所述,金属元素标记方法具有多种优势,值得重视和进一步研究。
在对简单生物样本中的蛋白质进行定量时,如药代动力学和药效动力学中蛋白质的定量分析中,一般会采用抗体富集策略,这样会降低机体干扰。例如,Rix等[14]通过亲和沉淀技术首先富集了与治疗白血病的3种不同药物直接相关的不同激酶,然后对这些激酶在药效过程中的作用进行分析。这种策略的主要问题是方法的灵敏度。针对此问题,在质谱分析时采用选择性离子检测技术是一种合理的选择。在这种简单环境情况下,待测样品结构单一、纯净,此时使用一级图谱定量,相比于目前药物定量常采用的多反应监测技术[15-19],可避免使用二级图谱进行定量时肽段由于二级碎裂时多种碎裂行为并存使二级信号强度相比一级离子信号强度明显下降的问题,从而获得更高的灵敏度和准确性。
本文在前人工作的基础上,建立了基于金属标记结合高效液相色谱-选择离子监测质谱的蛋白质绝对定量新方法。该方法一方面以双功能试剂DOTA-NHS螯合镧系金属元素铽、钬和镥(Tb、Ho、Lu)为质量标签,继承金属元素标记方法标记效率高,价格低廉,可多重定量的优点;另一方面采用选择离子监测质谱技术,避免了二级离子信号降低的问题,提高了定量结果的灵敏度。
1 实验部分
1.1 仪器与试剂
高效液相色谱-电喷雾-线性离子阱-傅里叶变换离子回旋共振质谱仪(HPLC-ESI-LTQ-FT MS,美国Thermo Fisher Scientific公司);TSQ vantage质谱系统(美国Thermo Scientific公司);Eksigent nanoLC·2D高效液相色谱仪(美国AB SCIEX);4800基质辅助激光解吸电离飞行时间串联质谱仪(MALDI-TOF-TOF MS,美国 AB SCIEX公司);安捷伦1100毛细管色谱系统(美国Agilent公司);3K30型高效离心机(美国Sigma公司);真空浓缩仪(Concentrator Plus,德 国 Eppendorf公司);Sartorius CPA225D分析天平(德国Sartorius公司);Thermo Heraeus Fresco 21微量离心机(德国Heraeus有限公司)。
内标肽段由上海吉尔生化有限公司合成,色谱方法测定纯度为99%;氯化铽(terbium chloride)、氯化钬(holmium chloride)、氯化镥(lutetium chloride)、三乙二胺碳酸盐(triethylammonium bicarbonate,TEAB)、碳酸氢铵和醋酸铵购于美国Sigma公司;DOTA-NHS购于美国 Macrocyclics公司;测序级胰蛋白酶和二硫苏糖醇(DTT)购自美国Promega公司;碘乙酰胺(IAA)购自美国New Jersey公司;乙腈(色谱纯)购自美国J.T.Baker公司;三氟乙酸(TFA)购自美国Acros公司;甲酸(FA)购自德国Fluka公司;其他试剂为国产分析纯。实验用水由Milli-Q纯水系统制备(美国Millipore公司)。
1.2 实验方法
1.2.1 合成肽段的金属标记
对选择的合成肽段,采用以下步骤进行标记:(1)肽段与双功能试剂的反应:移取1 μg肽段溶于10 μL TEAB 缓冲液中(0.2 mol/L 且 pH=8.0),补加20 μL乙腈,混匀后加入 10 μL双功能试剂DOTA-NHS(50 nmol/μL),涡旋2 min,室温反应1 h。(2)金属与双功能试剂标记肽段反应:将反应液真空干燥,加入10 μL乙腈复溶,再加入40 μL醋酸铵缓冲液(0.1 mol/L且pH=6.0),之后加入金属氯化物的醋酸铵溶液,其中金属加入量为双功能试剂DOTA-NHS加入量的2倍(物质的量比),室温反应1 h后,使用MALDI-TOF质谱分析,以标记前后肽段质荷比的信号强度的比值考察标记效率。
1.2.2 金属标记的歧视性考察
随机选择3条合成的肽段,用同一种金属标记后,使用MALDI-TOF质谱考察金属标记的效率,考察金属对不同肽段是否存在歧视性。
对一条肽段使用3种不同的金属标记,使用MALDI-TOF质谱测定金属标记的效率,考察肽段对不同金属标记是否存在歧视。
1.2.3 金属标记的稳定性考察
为了考察金属与DOTA-NHS以及DOTANHS与肽段结合的稳定性,并同时考察标记的肽段是否会发生金属离子置换反应,将金属标记完成后的肽段加入到等物质的量的另外两种金属盐的混合溶液中,即将金属 Tb、Ho、Lu标记完成后的 Tb-DOTA-SSIIDIYAR、 Ho-DOTA-SSIIDIYAR、 Lu-DOTA-SSIIDIYAR分别加入到等物质的量的Ho和Lu、Tb和Lu以及Ho和Tb的混合溶液中放置24 h,在放置前后各取0.8 μL溶液进行 MALDITOF质谱检测。
1.2.4 不同金属标记的肽段的色谱保留时间及质谱响应行为考察
首先考察金属标记肽段(SSIIDIYAR和AGYTAIVSHR)在ESI源质谱中的一级质谱响应行为,DOTA修饰后的标准肽段分别使用3种金属(Tb、Ho、Lu)标记后再等物质的量混合进行HPLCESI-LTQ-FT MS分析,采用FULL SCAN模式,观察3种不同金属标记的肽段在色谱上的保留时间和ESI-LTQ-FT MS中的一级响应强度,基于质谱的检测结果,选择合适的金属标签应用于腾冲嗜热菌中烯醇酶蛋白的定量分析。
1.2.5 腾冲嗜热菌全蛋白的提取、酶切与标记
取75℃腾冲嗜热菌加入到适量的裂解液中(裂解液由8 moL/L 的尿素、5 mg DTT、10 μL 的蛋白酶抑制剂组成)进行超声破碎,超声功率为400 W,超声1 s,停2 s,超声40次为一循环,重复循环8次至溶液澄清。然后在4℃ 20 000 r/min条件下离心30 min,取上清液,采用Bradford法测定腾冲嗜热菌的蛋白质浓度,将蛋白质分装后于-80℃冰箱中保存备用。
取100 μg腾冲嗜热菌蛋白溶液,加入40 μL 0.2 mol/L且pH=8.0的TEAB缓冲液;混匀后加入DTT,使其终浓度为10 mmol/L,37℃反应4 h;加入IAA,其终浓度为50 mmol/L,暗处放置1 h。还原、烷基化后,按胰蛋白酶︰底物=100∶1(质量比)加入1 μg测序级胰蛋白酶,在37℃水浴孵育4 h后再加入2 μg的测序级胰蛋白酶继续酶解16 h。将腾冲嗜热菌酶解产物分装后于-80℃冰箱中保存备用。
取出10 μg的腾冲嗜热菌酶切产物使用金属标签进行标记,标记方法参考1.2.1节。
1.2.6 质谱鉴定
1.2.6.1 MALDI-TOF MS 质谱鉴定分析
仪器控制软件为4000 Series Explorer software。采用马心肌红蛋白的胰蛋白酶酶解肽段作为标准肽段对仪器进行校正,要求相对误差小于10 ppm,一级质谱数据采集使用MS-2 kV反射模式,加速电压20 kV,激光能量为3 500,每张谱图由1 600个亚谱累加获得。
1.2.6.2 HPLC-ESI-LTQ-FT MS 液相色谱-质谱联用系统鉴定分析
色谱分离:采用Agilent 1100系统,自动进样器上样,体积为20 μL。毛细管液相色谱流动相A为0.1%甲酸+2%乙腈水溶液,B相为0.1%甲酸+80%乙腈水溶液。洗脱梯度:0~26 min,5%B~35%B;26~31 min,35%B ~100%B;31~36 min,100%B;37~46 min,100%A平衡色谱柱。流速:300 nL/min。
质谱鉴定:(1)FULL SCAN模式:正离子模式;扫描范围为m/z 375.0~1 500.0;质谱采集时间为46 min;数据依赖模式为选取一级质谱全扫描的信号强度最高的10个离子进行MS/MS分析;二级碰撞能量为35 V,活化时间为10 ms;二级重复采集谱图2次后,动态排除,排除时间为25 s。(2)SIM模式:正离子模式,质谱采集时间为46 min;分辨率为100 000。
1.2.6.3 HPLC-ESI-TSQ MS 液相色谱-质谱联用系统鉴定分析
色谱分离:采用Eksigent nanoLC·2D系统,自动进样器上样,体积为20 μL。流动相组成、洗脱梯度设置及流速与LTQ色谱条件相同。
质谱鉴定:(1)FULL SCAN模式:正离子模式,扫描范围为:m/z 375.0~1 500.0;质谱采集时间为46 min;数据依赖模式:选取一级质谱全扫描的信号强度最高的10个离子进行MS/MS分析;二级碰撞能量为35 V,活化时间为10 ms;二级重复采集谱图3次后,动态排除,排除时间为32 s。(2)MRM模式:正离子模式,质谱采集时间为46 min;监视母子离子对为 m/z790.32/637.33、m/z 790.32/682.40。(3)SIM 模式:正离子模式,质谱采集时间为46 min;监视一级离子为m/z 790.32、m/z 808.82。
2 结果与讨论
2.1 金属元素标记的原理
金属元素标签部分由双功能试剂(大环类金属螯合剂)和镧系金属元素组成。双功能试剂的活性基团与肽段或蛋白质的氨基反应,再螯合上化学性质相近但质量数不同的镧系金属元素,从而形成肽段的质量标签。本实验的双功能试剂为带有琥珀酰亚胺酯活性基团的DOTA-NHS,DOTA-NHS与肽段反应后,肽段分子质量增加386.18 Da,螯合镧系单同位素金属铽、钬和镥(相对原子质量158.925、164.930和 174.967)后,肽段分子质量共增加542.08 Da、548.09 Da和 558.13 Da。
2.2 金属标记反应的可行性
为了实现金属标记质谱的定量新方法在蛋白质组学中的应用,首先使用合成肽段为研究对象,对金属标签的标记效率、肽段歧视性、稳定性、色谱保留时间及质谱响应行为等进行了一系列的考察。
2.2.1 金属标签标记效率
为了验证DOTA-NHS与肽段N端的反应效率和特异性,首先将肽段AFAAGVDLGFR(分子质量975 Da)与50倍质量的DOTA-NHS在pH 8.0~8.5 TEAB缓冲液中室温反应1 h。反应中需要严格控制反应体系的pH值,这是由于当pH值较低时,肽段N端的伯氨基由于带电荷而使其亲核性减弱,降低反应效率;而当pH过高时赖氨酸侧链上的氨基也会参与反应,使得一个肽段标记上多个标签,反应副产物增加,影响肽段的定量结果。为了尽可能地避免DOTA-NHS酯键水解,反应体系中乙腈体积为TEAB缓冲液的3倍。
然后将样品真空干燥,在pH 6.0的NH4OAc缓冲液中与2倍过量的金属TbCl3室温反应1 h。MALDI-TOF MS检测结果如图1所示,肽段的m/z为976(图1a),与DOTA-NHS反应后质量数增加386(图1b),且此时质谱图上已经检测不到原肽段。再与金属Tb螯合,质量数共增加542(图1c),且此时质谱图上也检测不到合成肽段与DOTA-NHS反应后的肽段,说明标记反应完全。
2.2.2 金属标签的歧视性
考察金属标记中是否存在歧视性,即考察金属标签是否只适用于特定的肽段以及肽段是否只适用于特定的金属标记。使用3种不同的金属元素,对分子质量为1 426 Da的肽段AQIEETTSDYDR进行标记,标记效率如表1所示;而同一种金属元素铽对3条随机选择的合成肽段的标记效率如表2所示。大于99%的标记效率证明金属标记是一种标记效率高且具有广泛适用性的标记方法。
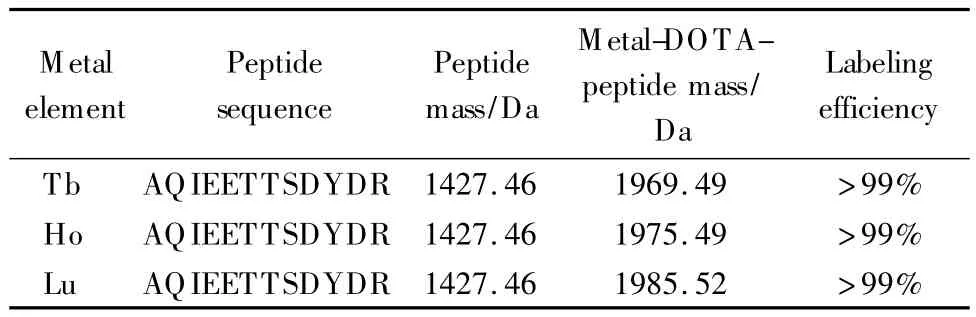
表1 3种金属标记同一条随机选择的合成肽段的标记效率Table 1 Labeling efficiencies of one peptide labeled with three metal elements
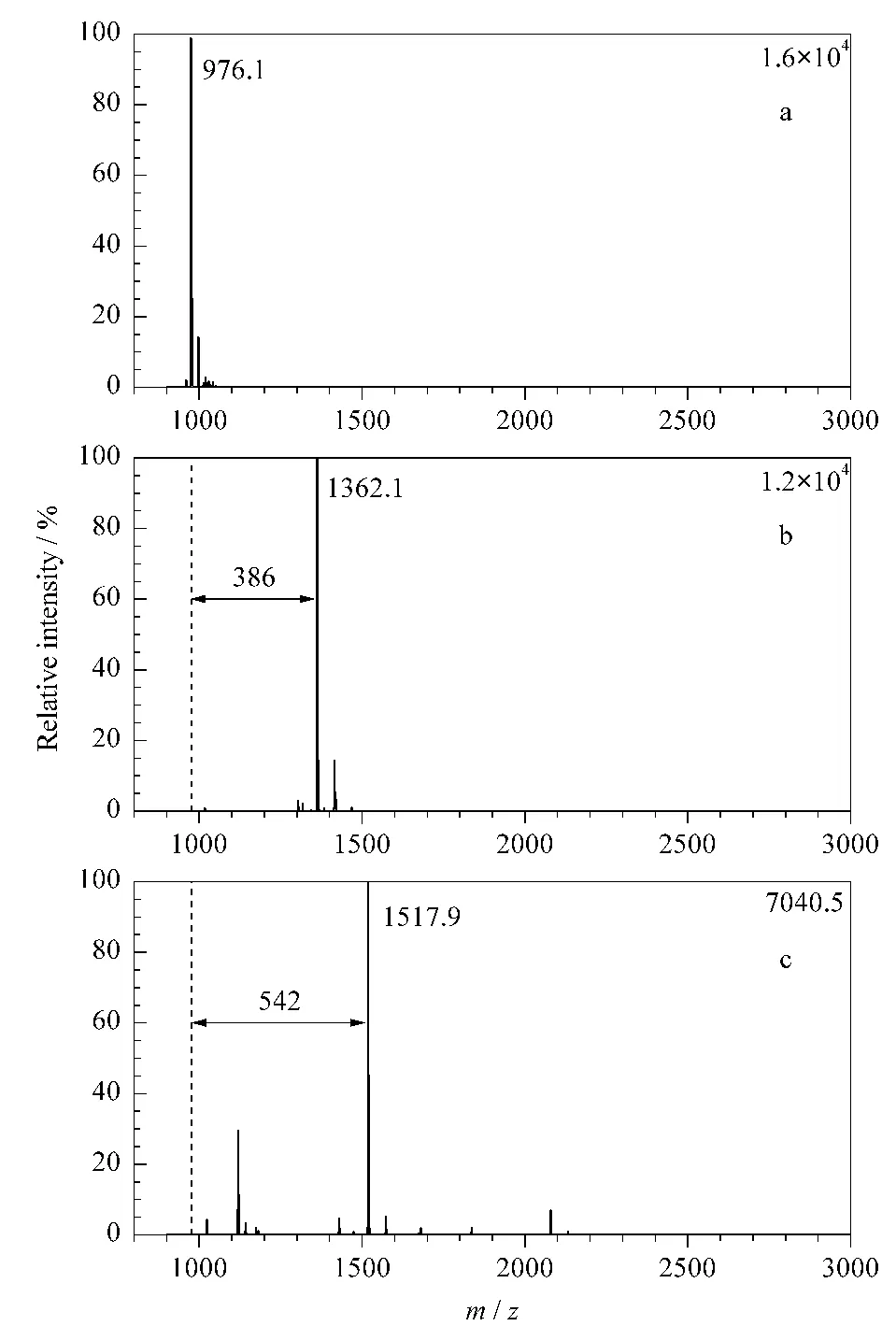
图1 (a)肽段AFAAGVDLGR、(b)肽段与双功能试剂反应后与(c)其再与金属离子Tb螯合后的质谱图Fig.1 MALDI-TOF MS spectra of(a)peptide(AFAAGVDLGR),(b)DOTA-AFAAGVDLGRand(c)Tb-DOTA-AFAAGVDLGR
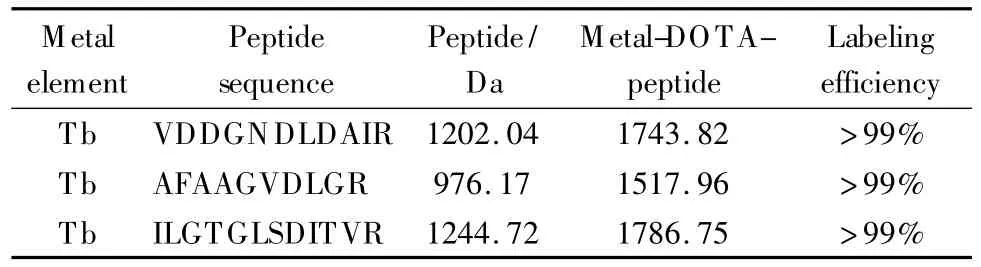
表2 同一金属标记3条不同肽段的标记效率Table 2 Labeling efficiencies of three peptides labeled with one metal element
2.2.3 金属标记的稳定性
标记肽段的金属离子置换反应的考察实验结果如图2所示,图2a为金属标记完成后的肽段Lu-DOTA-SSIIDIYAR(分子质量1 595 Da)点靶分析的MALDI-TOF质谱图,图2b为金属Lu标记完成后的肽段Lu-DOTA-SSIIDIYAR加入到等物质的量的Ho和Tb的混合溶液中并放置24 h后所得的MALDI-TOF质谱图,比较图中质谱峰(肽段SSIIDIYAR分子质量1 037 Da,DOTA-SSIIDIYAR 分子质量1 423 Da)可以发现已标记上的金属未脱落,且未检测到发生金属置换反应的肽段(Tb-DOTASSIIDIYAR 分子质量1 579 Da,Ho-DOTA-SSIIDIYAR分子质量1 585 Da)。其他两种金属标记肽段的稳定性评价结果与Lu标记肽段结果一致,证明金属标记是稳定的。
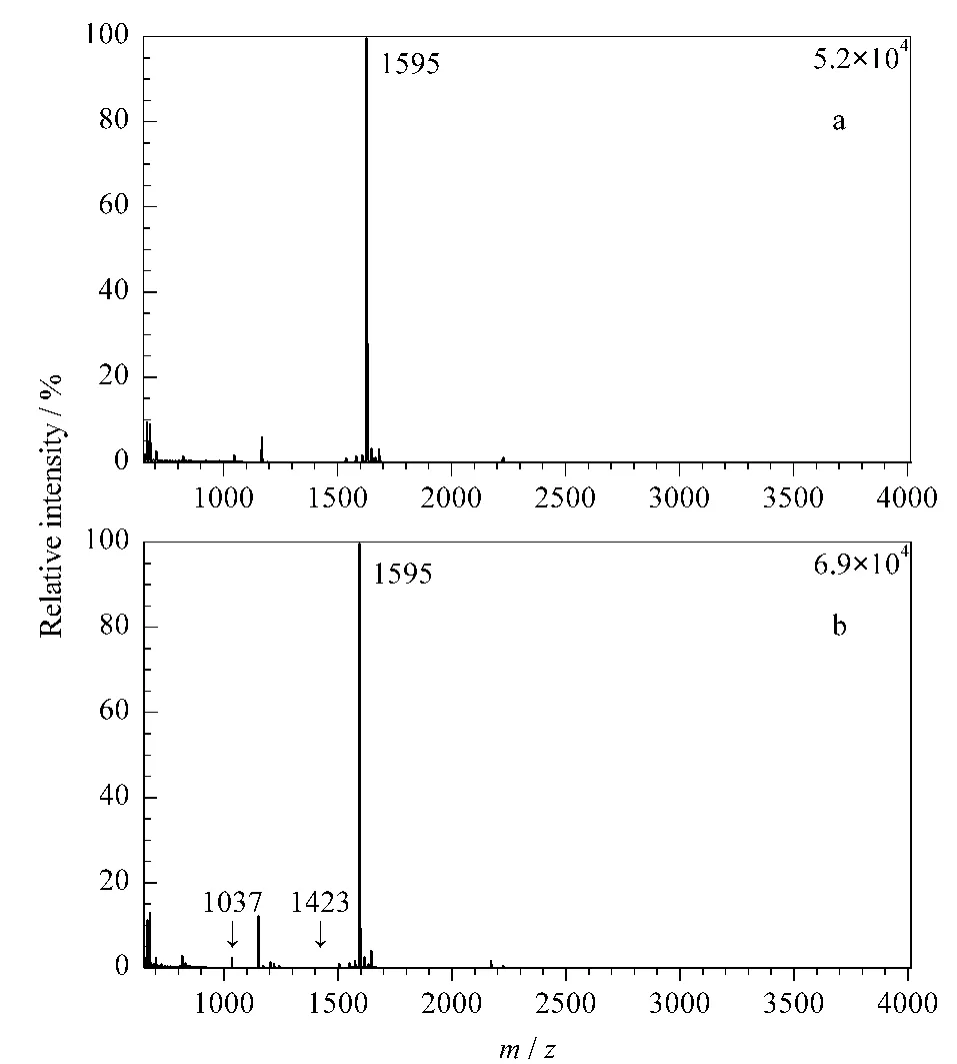
图2 (a)金属标记完成后的Lu-DOTA-SSIIDIYAR与(b)其加入到Ho、Tb盐混合液中并放置24 h后所得的MALDI-TOF质谱图Fig.2 MALDI-TOF MS spectra of(a)Lu-DOTASSIIDIYARand(b)Lu-DOTA-SSIIDIYAR solution added with TbCl3and HoCl3for 24 h
2.2.4 不同金属标记的肽段的色谱及质谱行为
为了考察金属标记是否影响肽段在色谱和质谱中的行为,本实验以经3种不同金属元素标记的合成肽段SSIIDIYAR和AGYTAIVSHR作为样品,等物质的量混合后在HPLC-ESI-LTQ-FT MS上采用选择离子监测技术对其保留时间及色谱峰面积进行考察。3种不同金属标记肽段的保留时间如表3所示,说明带有不同金属标签的肽段在色谱中共洗脱,满足定量要求。3种不同金属标记肽段的总离子流色谱峰面积如表4所示,RSD值小于8%,满足定量要求。

表3 不同金属标记肽段(SSIIDIYAR,AGYTAIVSHR)的保留时间Table 3 R etention times of the labeled peptides(SSIIDIYAR,AGYTAIVSHR)with different metal elements

表4 不同金属标记肽段(SSIIDIYAR,AGYTAIVSHR)的色谱峰面积Table 4 Peak areas of the labeled peptides(SSIIDIYAR,AGYTAIVSHR)with different metal elements
2.3 SIM 技术与MR M技术灵敏度的比较
将等物质的量金属铽标记的肽段SSIIDIYAR和AGYTAIVSHR混合后,分别采用SIM模式和MRM模式质谱(TSQ,Thermo Scientific公司,美国)进行分析。首先对金属标记肽段的所有b、y离子进行全扫描,以选择用于MRM模式的最高离子强度的母子离子对。如图3a和图3b所示,在Tb-SSIIDIYAR的所有子离子中,离子m/z 637.33信号响应最高,而在Tb-AGYTAIVSHR的所有子离子中,离子m/z 682.40信号响应最高,故选择这两对母子离子对与其相应的母离子的SIM质谱信号强度进行比较。
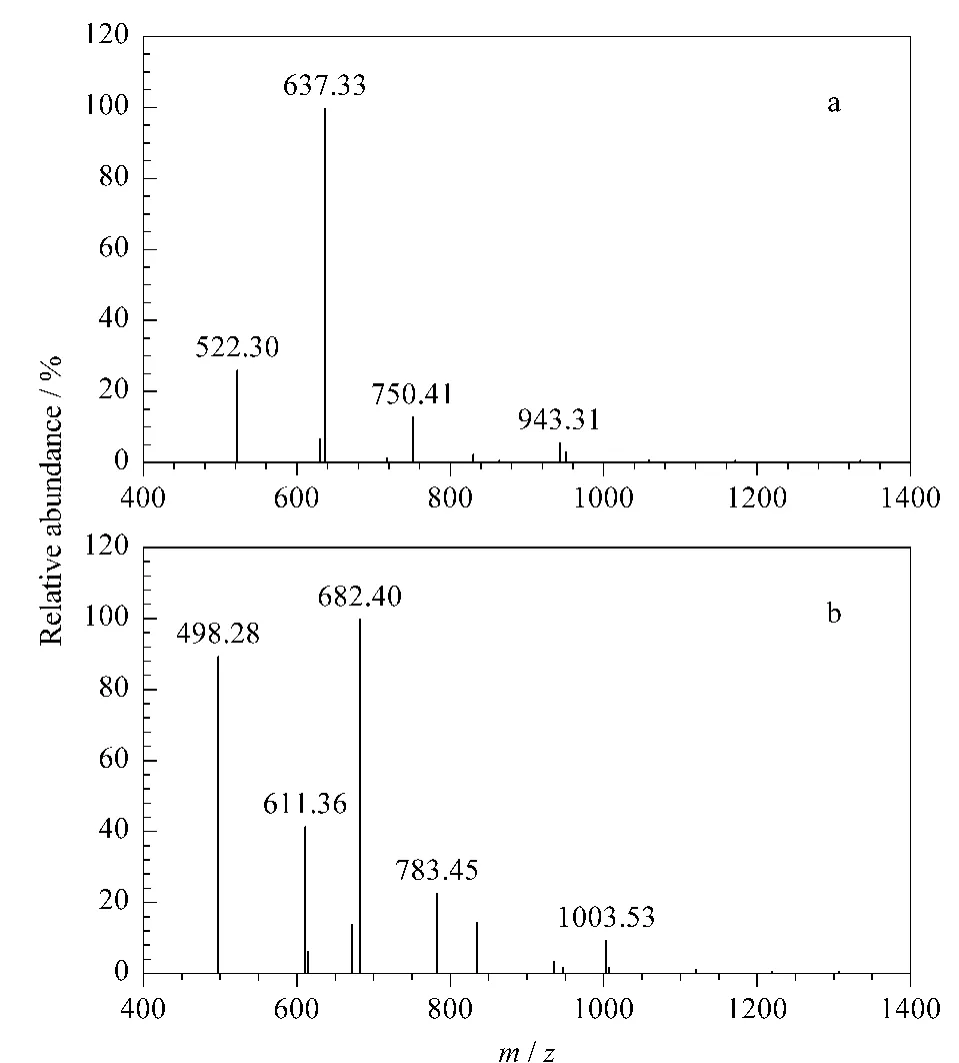
图3 (a)Tb-SSIIDIYAR和(b)Tb-AGYTAIVSHR的串联质谱图Fig.3 MS/MS spectra of(a)Tb-SSIIDIYAR and(b)Tb-AGYTAIVSHR
采用MRM模式质谱对金属标记肽段进行检测。Tb-SSIIDIYAR的子离子m/z 637.33的提取离子流色谱图如图4a所示,其信号强度为2.41×104;Tb-AGYTAIVSHR的子离子m/z 682.40的提取离子流色谱图如图4b所示,其信号强度为1.88×104。
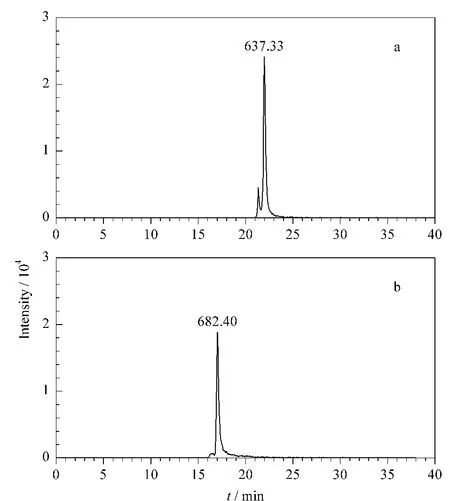
图4 (a)Tb-SSIIDIYAR的子离子m/z 637.33和(b)Tb-AGYTAIVSHR的子离子m/z 682.40的提取离子流色谱图Fig.4 Extracted ion chromatograms of(a)product ion m/z 637.33 of Tb-SSIIDIYAR and(b)product ion m/z 682.40 of Tb-AGYTAIVSHR
将上述混合物进行SIM模式质谱检测,结果如图5所示。Tb-SSIIDIYAR的信号强度为1.62×106,而 Tb-AGYTAIVSHR的信号强度为4.68×106。
比较肽段在SIM模式和MRM模式质谱的信号强度值可知,SIM模式的灵敏度高于MRM模式的灵敏度。所以在简单环境下对目标蛋白进行定量,SIM模式是比较好的选择。
2.4 绝对定量方法建立及在腾冲嗜热菌中的应用
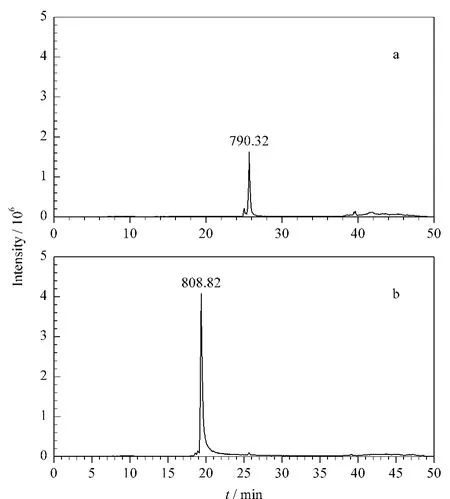
图5 (a)Tb-SSIIDIYAR和(b)Tb-AGYTAIVSHR的选择离子检测色谱图Fig.5 SIM chromatograms of(a)Tb-SSIIDIYARand(b)Tb-AGYTAIVSHR
将不同物质的量(1、5、10、20、50、100、500、1 000 fmol)金属Tb标记的腾冲嗜热菌中烯醇酶蛋白的合成肽段(SSIIDIYAR、AGYTAIVSHR)分别加入到金属Ho标记的1 μg腾冲嗜热菌蛋白酶解液中,体积为 20 μL,共 8个样品,使用 HPLC-ESILTQ-FT MS进行SIM质谱分析。采取genesis积分方法对肽段离子的峰面积进行积分,以金属Tb标记肽段的物质的量和峰面积制作标准曲线。计算发现1 pmol标准肽段的峰面积积分结果明显偏离曲线(R2=0.97),故选择最大上限浓度为500 fmol。最终标准曲线如图6所示,在1~500 fmol范围内标准曲线的线性回归系数R2大于0.99,说明金属标记完成后的标准肽段在1~500 fmol间峰面积与物质的量成良好线性。依据定量限为相对标准偏差小于20%时的工作曲线的最低点这一定义,定量限为1 fmol。重复实验时发现,1 fmol的肽段SSIIDIYAR的峰面积的相对标准偏差为8.74%,而1 fmol的肽段AGYTAIVSHR的峰面积的相对标准偏差为11.31%。即当上样量为1 fmol时,同时满足工作曲线的最低点和RSD<20%,所以该方法的定量限为1 fmol,且两条肽段的线性范围都为1~500 fmol。
以金属Ho标记的腾冲嗜热菌中烯醇酶蛋白酶解肽段(SSIIDIYAR、AGYTAIVSHR)的7次质谱分析峰面积的平均值分别为8 681 588和21 007 452,将峰面积平均值代入两条曲线求得烯醇酶蛋白的浓度,此时烯醇酶蛋白使用特征肽段SSIIDIYAR曲线的定量结果为 52.49fmol,使用特征肽段AGYTAIVSHR的定量结果为48.58 fmol。测得腾冲嗜热菌烯醇酶蛋白的物质的量平均值为50.535 fmol,RSD为5.47%,表明定量结果可信。由于烯醇酶蛋白的相对分子质量为46 286.7,所以腾冲嗜热菌全蛋白中烯醇酶蛋白的含量为2.314 ng/μg。
2.5 绝对定量新方法的准确度
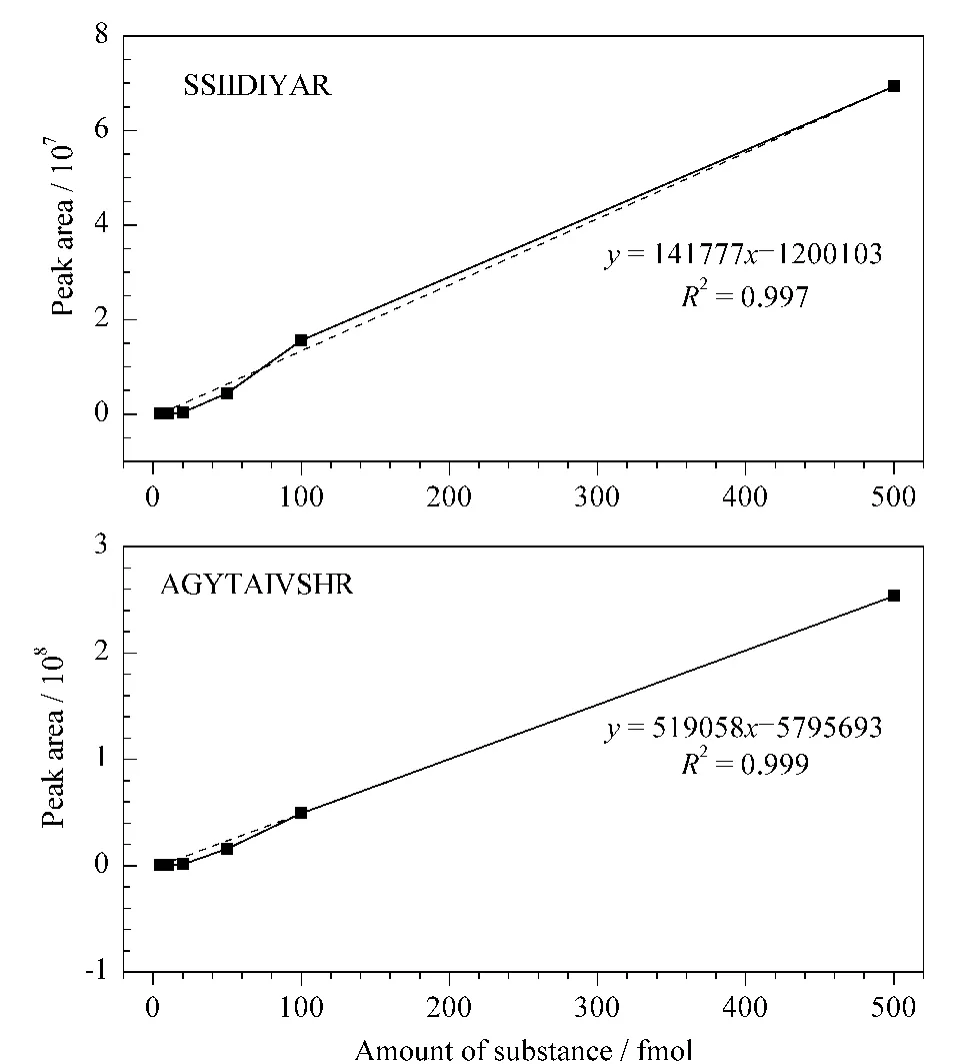
图6 肽段SSIIDIYAR和AGYTAIVSHR的标准曲线Fig.6 Calibration curves of SSIIDIYARand AGYTAIVSHR
将50 fmol金属 Ho标记肽段(SSIIDIYAR、AGYTAIVSHR)加入腾冲嗜热菌全蛋白酶解液中对方法的准确度进行考察。将genesis积分得到的Ho-DOTA-SSIIDIYAR和Ho-DOTA-AGYTAIVSHR的峰面积代入标准曲线,由标准曲线计算 Ho-DOTA-SSIIDIYAR和Ho-DOTA-AGYTAIVSHR的测得量分别为57.89 fmol和59.12 fmol。肽段SSIIDIYAR的回收率=57.89/50×100% =115.78%,肽段AGYTAIVSHR的回收率=59.12/50×100%=118.24%,两条肽段的平均回收率为117.01%。由回收率可知金属标记结合选择离子监测技术具有较高的准确度,表明该方法可以用于蛋白质的定量。
3 结论
本文发展了一种新的蛋白质绝对定量方法,即基于金属标记结合高效液相色谱-SIM质谱技术的蛋白质绝对定量新方法。首先以镧系金属元素铽、钬、镥螯合双功能试剂DOTA-NHS作为质量标签对标准肽段进行标记,然后结合SIM模式进行质谱分析,建立了蛋白质绝对定量的新方法。通过对金属标记适用性的考察,优化了实验条件,并最终将该方法应用于腾冲嗜热菌中烯醇酶蛋白的定量,实验结果表明该方法具有高精密度和准确度,可用于相对比较简单的生物样本中蛋白质的绝对定量分析,提供了一种蛋白质的绝对定量方法的新选择。
[1] Beck M,Schmidt A,Malmstroem J,et al.Mol Syst Biol,2011,7:549
[2] Nagaraj N,Wisniewski J R,Geiger T,et al.Mol Syst Biol,2011,7:548
[3] Ding C,Jiang J,Wei J Y,et al.Mol Cell Proteomics,2013,12(8):2370
[4] Gerber S A,Rush J,Stemman O,et al.Proc Natl Acad Sci,2003,100(12):6940
[5] Ong S E,Blagoev B,Kratchmarova I,et al.Mol Cell Proteomics,2002,1:376
[6] Ross P L,Huang Y L N,Marchese J N,et al.Mol Cell Proteomics,2004,3:1154
[7] Kang U B,Yeom J,Kim H,et al.J Proteome Res,2010,9:3750
[8] Yao X D,Afonso C,Fenselau C,et al.J Proteome Res,2003,2:147
[9] Ye X Y,Luke B,Andresson T,et al.Brief Funct Genomic Proteomic,2009,8(2):136
[10] Whetstone P A,Butlin N G,Corneillie T M,et al.Bioconjugate Chem,2004,15:3
[11] Liu H,Zhang Y,Wang J,et al.Anal Chem,2006,78:6614
[12] Wang X,Zhang Y,Wang X,et al.Anal Methods,2012,4:1629
[13] Wang X,Wang X,Qin W,et al.Analyst,2013,138(18):5309
[14] Rix U,Hantschel O,Dürnberger G,et al.Blood,2007,110(12):4055
[15] Zhu F,Liu H L,Chen B,et al.Chinese Journal of Chromatography(朱峰,刘华良,陈蓓,等.色谱),2013,31(5):473
[16] Zhu L,Ruan L P,Liu H L,et al.Chinese Journal of Chromatography(朱琳,阮丽萍,刘华良,等.色谱),2013,31(7):709
[17] Cheng Z,Zhang R,Liu W H,et al.Chinese Journal of Chromatography(程志,张蓉,刘韦华,等.色谱),2014,32(1):57
[18] Cao P,Mou Y,Gao F,et al.Chinese Journal of Chromatography(曹鹏,牟妍,高飞,等.色谱),2013,31(9):862
[19] Zhu F,Ruan L P,Ma Y J,et al.Chinese Journal of Chromatography(朱峰,阮丽萍,马永建,等.色谱),2014,32(1):13

