用于人血浆中蛋白质分离的在线阵列式二维常规柱液相色谱系统的建立
黄 志, 洪广峰, 高明霞, 张祥民*
(1.复旦大学化学系,上海200433;2.复旦大学生物医学研究院,上海200032)
寻找疾病分子标记物是疾病蛋白质组学极为重要的研究内容,临床诊断中采用的许多疾病分子标记物都是糖蛋白[1,2]。血浆是临床医学中最为普遍的检测样本,因而成为目前蛋白质组学研究的一个热点对象,但当前对血浆样品进行疾病标志物的规模化筛选方法还不成熟,这主要是由于血浆样品中蛋白质浓度范围非常广,达到10个数量级,其中22种高丰度蛋白质占了整个蛋白质总量的99%,而中低丰度蛋白质所占比例仅为1%[3]。高丰度蛋白质的存在严重干扰了中低丰度蛋白质的鉴定研究,不利于疾病分子标记物的发现[4,5]。目前,主要是采用免疫亲和柱特异性结合目标蛋白质的方法来去除血浆中的一些高丰度蛋白质[6-9]。虽然这种方法特异性很高,但是研究发现,在这个过程中一些低丰度蛋白质也会被除去,从而可能会丢失一些潜在的疾病分子标记物[9]。另外,目前由于免疫亲和柱能够特异性去除的高丰度蛋白质种类有限,且抗体的制备费用很高,因此免疫亲和柱特别是可同时去除多种高丰度蛋白质的免疫亲和柱的使用很有限。
蛋白质组学的色谱分离主要是基于蛋白质或肽段在色谱柱上有不同的保留行为而得以实现的。马成等[10]利用两性亲水作用色谱(ZIC-HILIC)材料制备亲水富集柱,结合碱性反相色谱进行了肽段的预分离和高准确度的质谱分析,对人血浆蛋白的糖基化进行了研究,最终在健康人的血浆中鉴定到了299个糖基化蛋白、637个糖基化位点并识别出了31种不同的糖型。将不同的色谱分离模式进行组合可以实现对复杂生物样品的有效分离[11]。相较于免疫亲和柱去除高丰度蛋白质的方法,多维色谱分离去除高丰度蛋白质的方法具有能去除未知高丰度蛋白质的优点。在前期研究中,本课题组[12,13]采用强阴离子交换色谱-反相高效液相色谱(SAXRPLC)离线二维分离系统,在对二维分离梯度进行优化后,实现了血浆蛋白质的有效分离,对其中高丰度蛋白质馏分进行了串联质谱(MS/MS)鉴定,实现了高丰度蛋白质的色谱定位,鉴定得到了68种高丰度蛋白质,为血浆蛋白质组学的深入研究提供了重要思路。
离线多维色谱分离系统以其高效、高分辨率的特点成为蛋白质组学领域不可缺少的分离技术。但目前这种技术的第二维分离一般是单色谱柱-检测器模式,且第二维的分离只有在对前一个第一维馏分分离完之后才能进行下一个馏分的分离,依次进行,直至将第一维所有的馏分分离完毕。这种离线分离模式的通量太低,费时费力,在大规模样品分析中的应用受到了一定的限制。此外,这种技术在对第一维馏分的离线处理过程中,不可避免地会有样品的损失,给后续分离鉴定带来一定的不利影响。因此发展快速、高通量、损失小的蛋白质分离技术成为推动蛋白质组学发展的迫切需要。
在线多维阵列式色谱是一种极具潜力的蛋白质分离技术[14]。本研究针对血浆样品中高丰度蛋白质非常集中的特点,采用蛋白质负载量更大、生物兼容性更好、具有耐压能力的ProPacTMSAX-10强阴离子交换色谱柱(SAX)作为第一维分离柱、采用8根XtimateTMC8反相色谱常规柱作为第二维阵列分离柱,从而搭建了一套阵列式常规柱二维色谱分离平台,对血浆中的蛋白质进行了完整蛋白质水平上的分离,为血浆蛋白质组学更深入的研究提供一种重要的分离分析方法。
1 实验部分
1.1 仪器与试剂
色谱系统为岛津2010A色谱系统(日本岛津公司),馏分收集装置为Probot LC Packing馏分收集装置(美国Dionex公司)。六通进样阀、十通电动切换阀、三通、八通分流器(Valco Instruments公司)。第一维SAX柱为ProPacTMSAX-10柱(250 mm×4.0 mm,10 μm),其与保护柱均购于美国Dionex公司;第二维分离柱为XtimateTMC8柱(250 mm×2.1 mm,粒径为 5 μm,孔径为 30 nm),其与保护柱均购自上海月旭材料科技有限公司。二喹啉甲酸(BCA)染色测定采用Epoch超微量微孔板分光光度计/酶标仪(美国BioTek公司)。
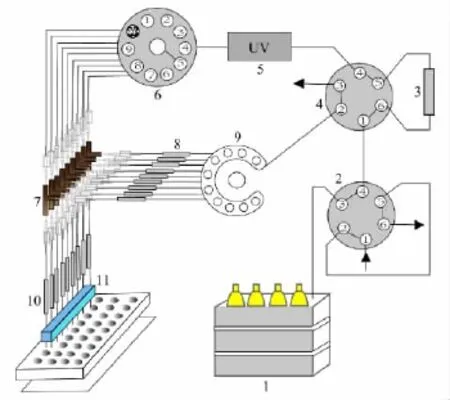
图1 在线阵列式二维常规柱液相色谱系统原理图Fig.1 Schematic diagram of online conventional arraybased 2D liquid chromatographic system1.HPLC gradient pump;2.6-port valve;3.SAX column;4.6-port valve;5.UV detector;6.10-port fraction swith valve;7.3-port valve;8.precolumn array;9.8-channel splitter;10.RP column array;11.8-channel fraction collector.
乙腈(ACN,HPLC纯,德国 Merck公司),三氟乙酸(TFA,HPLC纯)、三羟甲基氨基甲烷(Tris)(美国 Sigma公司);蛋白质定量试剂盒 Quick StartTMBradford protein assay(美国Bio-Rad公司);BCA蛋白质浓度测定试剂盒(中国上海碧云天生物技术有限公司);实验中所用水为Millipore纯水系统(美国Millipore公司)处理后的高纯水;其他化学试剂为国产分析纯试剂。
1.2 血浆及处理
血浆来源于上海华山医院检验科5名健康人的乙二胺四乙酸(EDTA)抗凝血浆。血浆经2 000 g、4℃条件下离心15 min,取上清液,分装,于-80℃下保存待用。血浆总蛋白通过Bradford法定量,浓度为74.67 mg/mL。
1.3 系统组成
阵列式二维常规柱色谱分离系统如图1所示,由1台四元梯度色谱泵(1)、1个配有2 mL进样环的六通道进样阀(2)、1个液相六通阀(4)、1个十通道电动切换阀(6)、1个八通道分流器(9)、8个Valco三通(7)、1根强阴离子交换色谱柱(3)、8根常规反相保护柱(8)、8根常规反相色谱柱组成的阵列色谱柱(10)、1台紫外检测器(5)及1个馏分收集仪(11)组成。其中,配有2 mL进样环的六通道进样阀(2)的1号孔为进样口,3号孔与四元色谱泵(1)相连,4号孔与液相六通阀(4)的1号孔相连,液相六通阀(4)的3号孔与废液瓶相通,6、5号孔分别与第一维SAX色谱柱(3)进口、出口端相连,4号孔与紫外检测器(5)的进口端相连,以构成系统的第一维SAX进样分离系统。紫外检测器(5)的出口端与十通阀(6)的进口端相连,十通阀(6)的1号孔与废液瓶相通,10号孔封闭,2~9号孔分别与8个Valco三通(7)的一个端口相连,Valco三通(7)的另一个端口直接与阵列RPLC分析柱(10)的进口端相连,8个Valco三通(7)的第三个端口与8根反相保护柱(8)相连,八通道分流器(9)的8个端口与8根反相保护柱(8)相连接;液相六通阀(4)的2号孔与十通道分流器(9)的另一端口相连,以实现第一维SAX馏分到第二维反相色谱柱的转移;阵列色谱柱(10)的出口端与馏分收集器(11)相连,构成第二维阵列RPLC馏分收集部分。
1.4 血浆的SAX分离
第一维SAX分离在岛津LC-2010A色谱系统上进行,此时液相六通阀(4)的1号孔和6号孔相连。流动相A为10 mmol/L Tris-HCl,pH 8.0;流动相B为10 mmol/L Tris-HCl(含0.5 mol/L NaCl),pH 8.0。流速为0.5 mL/min。检测波长为215 nm。血浆用流动相A稀释4倍,于2 000 g、4℃下离心15 min,再经0.22 μm微孔滤膜过滤后进样,进样量为50 μL。梯度洗脱程序:0~5 min,0%B;5~15 min,0%B~10%B;15~45 min,10%B~26%B;45~70 min,26%B~40%B;70~90 min,40%B ~67%B;90~90.1 min,67%B ~100%B;90.1~100 min,100%B;100~100.1 min,100%B ~0%B;100.1~130 min,0%B。将SAX分离得到的馏分通过十通阀(6)的2~9号孔依次切换转移到第二维8根反相保护柱(8)上,馏分的收集时间:反相柱1为0~25 min,反相柱2为25~40 min,反相柱3为40~55 min,反相柱4为55~70 min,反相柱5为70~80 min,反相柱6为80~90 min,反相柱7为90~100 min,反相柱8为100~130 min。
1.5 SAX馏分的阵列式第二维反相色谱在线分离
第二维RPLC分离在岛津LC-2010A色谱系统上进行,采用Probot LC Packing装置进行馏分收集,此时液相六通阀(4)的1号孔和2号孔相连,十通阀(6)切换至10号孔。流动相A为5%ACN-95%H2O-0.1%TFA;流动相 B为 95%ACN-5%H2O-0.1%TFA。流速为1.6 mL/min。第二维分离的梯度洗脱程序:0~5 min,0%B;5~15 min,0%B~25%B;15~25 min,25%B~33%B;25~60 min,33%B ~40%B;60~80 min,40%B ~54%B;80~85 min,54%B~67%B;85~85.1 min,67%B~100%B;85.1~95 min,100%B;95~95.1 min,100%B~0%B;95.1~110 min,0%B。将馏分收集于96孔板上,收集时间为1 min/孔,每孔中馏分体积为200 μL。
1.6 馏分的BCA蛋白质定量
按照BCA蛋白质定量试剂盒说明配制BCA染色液,向收集了第二维馏分的96孔板中加入100 μL BCA染色液,于37℃下反应30 min后,在562 nm检测波长下,用Epoch超微量酶标仪进行定量检测。
2 结果与讨论
2.1 阵列式二维常规柱色谱分离系统的工作原理
考虑到样品中蛋白质的复杂性以及传统的二维常规柱色谱分离系统的有限通量,本研究提出了一种新的分离策略,即在第二维采用多通道反相色谱分离模式,并将各段分离得到的馏分收集到96孔板上,以便后续蛋白质鉴定的研究。这种分离策略既具有多维液相色谱的高分辨又具备了阵列式色谱的高通量的特点。
本文中以1根SAX柱(3)作为分离系统的第一维,再将所得馏分通过第二维8根阵列式反相色谱柱(10)进行分离,第一维和第二维通过第二维的反相预柱(8)连接。通过十通阀(6)的切换,第一维的SAX分离可以连续逐一地与第二维的每一个通路相连接,这样第一维各段馏分都被相应地独立转移到第二维反相预柱(8)上,并得以在线富集(见图1)。为了能使第二维8根阵列式反相分析柱(10)能同时进行分离,我们使用了1个八通道的分流器(9),第二维的流动相通过分流器后被分成8个支路流经反相预柱,预柱所富集的蛋白质被同时冲洗进入到阵列式反相分析柱(10)得以分离。
为了能够同时收集第二维8个通道反相分离的馏分,我们对单通道馏分收集装置进行了馏分收集接口的改装(见图2),以用于并行式收集。接口用PEEK材料微加工制作,上部线性等间距排列有8个孔道,接口的上端与阵列反相柱相连,下端与点样针(4.7 cm,500 μm i.d.×2 mm o.d.)相接。点样针阵列间距为9 mm,末端位于96孔板上方2 cm。

图2 8通道馏分收集仪接口实物图Fig.2 Photograph of an 8-channel fraction collector interface
采用阵列式二维常规柱色谱分离系统进行分析,使复杂样品的整个分离时间大幅缩短(为单柱分离的1/8)。本系统第二维阵列反相柱分离是同时独立进行的,其在大幅提高分离通量的同时,也无需考虑第二维仅用1根反相柱时所出现的分离速度与分离效率间平衡的问题,因此可以提高系统分离复杂样品时的通量和总峰容量。此外,BCA蛋白质染色法具有准确、便捷的特点,因而被用于分析96孔板中收集到的馏分,以进行血浆样品中较高丰度蛋白质的快速定位分析。
2.2 血浆蛋白质的第一维SAX分离
离子交换色谱利用被分离组分与固定相之间发生离子交换的能力差异实现分离,在蛋白质组学研究中得到了广泛的应用。本课题组曾对强阴离子交换柱(SAX)和弱阴离子交换柱(WAX)的分离能力进行了比较[15],发现:相较于WAX 分离,SAX 具有更大的蛋白质负载量,所用流动相的pH条件更接近于生理pH,能减少部分蛋白质在酸性条件下的损失,因此本研究采用SAX作为第一维分离柱。本系统第一维SAX柱和第二维反相预柱相连,分离过程中相同流速下系统压力远高于单一SAX柱分离过程,而TSKgel SuperQ-5PW柱所能承受的最大压力为2×106Pa,在不更换SAX柱、保证分离效果的情况下降低流动相流速势必要大幅延长分离时间,因此最终采用耐压能力更高的ProPacTMSAX-10柱为第一维分离柱,在不断优化梯度洗脱条件后,确定了130 min的洗脱条件,由图3可见血浆样品在第一维上得到了较好的分离。根据色谱峰的强度变化依次将馏分转移到第二维预柱上进行在线富集。

图3 血浆蛋白质的第一维SAX分离色谱图Fig.3 Chromatogram of human plasma proteins by the first dimensional SAXColumn:ProPacTMSAX-10(250 mm ×4.0 mm,10 μm).Mobile phase A:10 mmol/L Tris-HCl,pH 8.0;mobile phase B:10 mmol/L Tris-HCl containing 0.5 mol/L NaCl,pH 8.0.Flow rate:0.5 mL/min.Loading amount:700 μg of plasma proteins.UV detection wavelength:215 nm.Gradient:0-5 min,0%B;5-15 min,0%B-10%B;15-45 min,10%B-26%B;45-70 min,26%B-40%B;70-90 min,40%B-67%B;90-90.1 min,67%B-100%B;90.1-100 min,100%B;100-100.1 min,100%B-0%B;100.1-130 min,0%B.
2.3 血浆蛋白质的第二维阵列式反相色谱分离
血浆蛋白质经第一维SAX分离的馏分在第二维反相预柱上得以保留、富集,通过液相六通阀(4)切换,第二维的流动相通过分流器(9)后分成8个支路将反相预柱上的蛋白质反冲至阵列式反相分析柱上进行分离,这个过程既能避免离线二维色谱分离系统中第一维馏分冻干所带来的损失,又具有高通量的优点。本课题组曾利用Jupiter C4反相柱(250 mm ×4.6 mm,粒径 5 μm,孔径 30 nm)在 1 mL/min流速下进行血浆的第二维分离,得到了较好的实验结果[12,13]。而本实验中,由于后续收集馏分采用96孔板,其单孔体积为360 μL,如果仍采用4.6 mm内径的Jupiter C4反相柱,采样时间仅为20 s/孔,不利于馏分收集仪的准确定位收集,因此我们采用了2.1 mm内径规格的XtimateTMC8反相柱作为第二维阵列分析柱,各通道流速均为0.2 mL/min,馏分收集仪采样时间为60 s/孔。在Jupiter C4反相柱第二维分离的洗脱梯度基础上,优化并确定了一个110 min的洗脱梯度,对8根阵列式反相色谱柱进行了同步洗脱分离。图4显示较高丰度的蛋白质主要集中在第一维SAX的第3、5、6号馏分中。
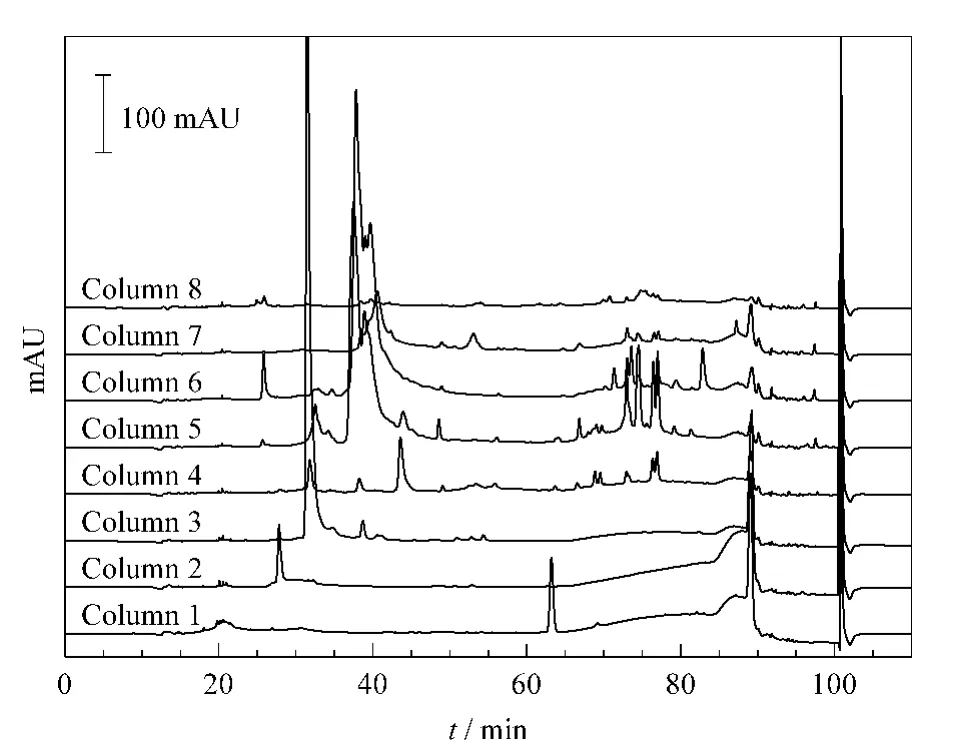
图4 SAX馏分的第二维阵列式反相色谱分离的色谱图Fig.4 Magnified array R PLC chromatograms of SAX fractionsColumn:XtimateTMC8(250 mm ×2.1 mm,5 μm,30 nm).Mobile phase A:5%ACN-95%H2O-0.1%TFA;mobile phase B:95%ACN-5%H2O-0.1%TFA .Flow rate:0.2 mL/min.UV detection wavelength:215 nm.Gradient:0-5 min,0%B;5-15 min,0%B-25%B;15-25 min,25%B-33%B;25-60 min,33%B-40%B;60-80 min,40%B-54%B;80-85 min,54%B-67%B;85-85.1 min,67%B-100%B;85.1-95 min,100%B;95-95.1 min,100%B-0%B;95.1-110 min,0%B.Collecting times of eight fractions from SAX:column 1,0-25 min;column 2,25-40 min;column 3,40-55 min;column 4,55-70 min;column 5,70-80 min;column 6,80-90 min;column 7,90-100 min;column 8,100-130 min.
2.4 血浆反相色谱分离馏分的BCA染色定量
将第二维阵列式反相色谱分离所得的馏分采用BCA染色法进行蛋白定量,获得的染色结果见图5。结果显示:紫色较深处蛋白质浓度较高,为较高丰度的蛋白质。图6为用酶标仪定量测定的96孔板中馏分蛋白含量的绘制图,对比发现:图4与图6的曲线形状大致相同,说明BCA蛋白质染色法适用于本系统馏分中蛋白质的快速定量分析,为后续高丰度蛋白质的快速定位及去除提供了可靠的依据。

图5 血浆蛋白阵列式反相色谱馏分的BCA蛋白质染色图Fig.5 Photographs of BCA assay of the human plasma proteins in the array-based R PLC effluents

图6 血浆蛋白阵列式反相色谱馏分的BCA酶标检测图Fig.6 Plots of BCA assay of the human plasma proteins in the array-based R PLC effluents based on microplate reader detection
3 结论
本文成功建立了一种在线高通量阵列式二维常规柱液相色谱分离系统,并成功应用于血浆中蛋白质在完整蛋白质水平上的分离。相较于传统的单柱分离系统,本文的整体二维系统对复杂样品的分离时间大幅缩短(为单柱分离的1/8),且二维分离之间以及第二维阵列色谱柱之间均相互独立,从而可以提高系统分离复杂样品时的通量和总峰容量。借助BCA蛋白染色法的快速、简便、准确的特点,有助于较高丰度蛋白质的快速定位,为后续蛋白质水平的深入研究奠定了基础。另外,本课题组正在研究将分子印迹、均衡器等新材料运用到上述系统复杂样品的处理过程中,以降低样品的复杂度、提高低丰度蛋白质的鉴定能力,为血浆蛋白质组学和疾病蛋白质组学的深入研究提供一种重要手段。
[1] Wright L M,Kreikemeier J T,Fimmel C J,et al.Cancer Detect Prev,2007,31(1):35
[2] Singhal A,Jayaraman M,Dhanasekaran D N,et al.Crit Rev Oncol Hematol,2012,82(2):116
[3] Tirumalai R S,Chan K C,Prieto D A,et al.Mol Cell Proteomics,2003,2(10):1096
[4] Polaskova V,Kapur A,Khan A,et al.Electrophoresis,2010,31(3):471
[5] Huang L,Harvie G,Feitelson J S,et al.Proteomics,2005,5(13):3314
[6] Gundry R L,White M Y,Nogee J,et al.Proteomics,2009,9(7):2021
[7] Tu C J,Rudnick P A,Martinez M Y,et al.J Proteome Res,2010,9(10):4982
[8] Faulkner S,Elia G,Hillard M,et al.Proteomics,2011,11(11):2329
[9] Ichibangase T,Moriya K,Koike K,et al.Biomed Chromatogr,2009,23(5):480
[10] Ma C,Pan Y T,Zhang Q,et al.Chinese Journal of Chromatography(马成,潘一廷,张琪,等.色谱),2013,31(11):1057
[11] Wu Q,Yuan H M,Zhang L H.Anal Chim Acta,2012,731:1
[12] Zhu S C,Zhang X Y,Gao M X,et al.Chinese Journal of Chromatography(朱绍春,张学洋,高明霞,等.色谱),2011,29(9):837
[13] Zhu S C,Zhang X Y,Gao M X,et al.Proteomics,2012,12(23/24):3451
[14] Gao M X,Guan X,Hong G F,et al.Chinese Journal of Chromatography(高明霞,关霞,洪广峰,等.色谱),2009,27(5):551
[15] Hong G F,Gao M X,Yan G Q,et al.Chinese Journal of Chromatography(洪广峰,高明霞,晏国全,等.色谱),2010,28(2):158

