三角褐指藻和小球藻营养成分的对比分析
王晓燕,邢 欢,钟韵山,宋东辉,徐仰仓
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
三角褐指藻(Phaeodactylum tricornutum)是一种单细胞微藻,生活在近海水域,易养殖,含有丰富的蛋白质、多糖、色素、维生素等营养物质[1].现阶段,三角褐指藻仅作为动物饲料的原料,应用领域较为狭窄[2].三角褐指藻也曾被认为是生产二十碳五烯酸(EPA)[3-4]和生物柴油[5-6]的潜在生物,但过高的加工成本限制了其在该领域的应用.
小球藻(Chlorella vulgaris)也是一种单细胞微藻,同样含有丰富的蛋白质、多糖、色素、维生素、多不饱和脂肪酸等生理活性物质[7],它的保健功效已被人们广泛认识[8-9].目前,小球藻已应用于饲料、环保、食品、保健品、医药等领域.本文比较了小球藻和三角褐指藻营养物质的含量,从营养角度分析了三角褐指藻的开发潜力,旨在使人们充分认识三角褐指藻的营养保健功能.
1 材料与方法
1.1 藻种和培养方法
三角褐指藻(Phaeodactylum tricornutum)由中国科学院海洋研究所王广策研究员馈赠,藻接种在 f/2培养基上,22,℃、1,000,lx光照(光/暗周期为14,h/10,h)下培养.小球藻(Chlorella vulgaris)由本研究室保存,藻接种在BG-11培养基上,25,℃、4,000,lx光照(全光照)下培养.从接种后的第 2天开始,用显微镜观察法对培养液中的微藻细胞进行计数.
1.2 测定方法
1.2.1 蛋白质含量的测定
采用考马斯亮蓝法[10]测定微藻细胞中的蛋白质含量.用牛血清白蛋白制作标准曲线.
1.2.2 总糖含量的测定
采用蒽酮比色法[11].准确吸取藻液 40,mL,5,000,r/min离心 10,min,去除上清液.藻泥冻融破碎3次后,加入 3,mL磷酸缓冲溶液,沸水中加热30,min,取 1,mL加入 0.1,mL硫酸锌溶液,沸水浴5,min后,立即加入亚铁氰化钾溶液 0.1,mL,5,000,r/min离心 10,min,取上清液 1,mL于 4,mL蒽酮中,沸水浴 10,min,冷水迅速冷却至室温,测定620,nm处的吸光度.用葡萄糖制作标准曲线.
1.2.3 游离氨基酸的测定
采用茚三酮显色法[12]测定微藻细胞中的游离氨基酸含量.用亮氨酸制作标准曲线.
1.2.4 不饱和脂肪酸含量的测定
采用气相色谱法.准确称取 80,mg真空冷冻干燥的藻粉于 10,mL螺口玻璃试管中,加入 2,mol/L KOH-CH3OH 2,mL,75,℃水浴中皂化 30,min,冷却至室温,加入 3,mol/L HCl-CH3OH 2,mL,75,℃水浴中甲酯化 15,min,冷却至室温,加入 l mL正己烷和少量的蒸馏水萃取脂肪酸.用 GC-7890Ⅱ型气相色谱仪(日本岛津公司)测定不饱和脂肪酸的含量.色谱条件:色谱柱为强极性柱(长50,m,内径 0.2,mm),柱温 200,℃,检测器为氢火焰离子化检测器(FID),温度 280,℃,载气为氮气,流量 1,mL/min,分流比 50∶1.标准品购于Sigma公司,是由19种脂肪酸甲酯组成的混合物.用面积归一法计算不饱和脂肪酸含量.
1.3 统计分析
通过 SPSS 19.0比较组间差异,采用 One Way ANOVA法中的 LSD比较不同组间的差异性(P<0.05时差异显著).数据为3次重复实验的平均值.
2 结果与分析
2.1 三角褐指藻和小球藻生长速率的比较
三角褐指藻是海水藻,而小球藻是淡水藻.它们的生长环境不同,对培养基、温度等条件的要求也不相同.要比较这两种微藻的生长速率,必须在各自的最优生长条件下比较.为此,首先探索了两种微藻的最佳培养条件:三角褐指藻为 f/2培养基、22,℃、1,000,lx光照(光/暗周期为 14,h/10,h),而小球藻为BG-11培养基、25,℃、4,000,lx光照(全光照).两种微藻都是游离生长的单细胞藻类,其生长速率可由培养液中藻细胞密度的变化来衡量.三角褐指藻和小球藻生长曲线如图 1所示.三角褐指藻细胞增殖最快的时期是在接种后的2~6,d,细胞密度的日增长率在 18.2%~23.3%;6,d后细胞增殖率逐渐变小;12,d后藻细胞停止增殖,此时培养液中的藻细胞密度最大,为 9.6×106,mL-1,与接种初相比,细胞密度增大了4.8倍.小球藻细胞增殖最快的时期是在接种后的2~7,d,细胞密度的日增长率在 14.6%~50.0%;7,d后细胞增殖率逐渐变小;培养 12,d时的细胞密度为2.31×107,mL–1,与接种初相比,细胞密度增大了 6.6倍.由此可见,小球藻的生长速率高于三角褐指藻,平均生长速率是三角褐指藻的2.4倍,说明在相同的时间内,养殖小球藻可获得较多的生物量(P<0.05).在需要通过生物量才能体现效果的领域,如污染环境中重金属的吸附,小球藻的优势要高于三角褐指藻.
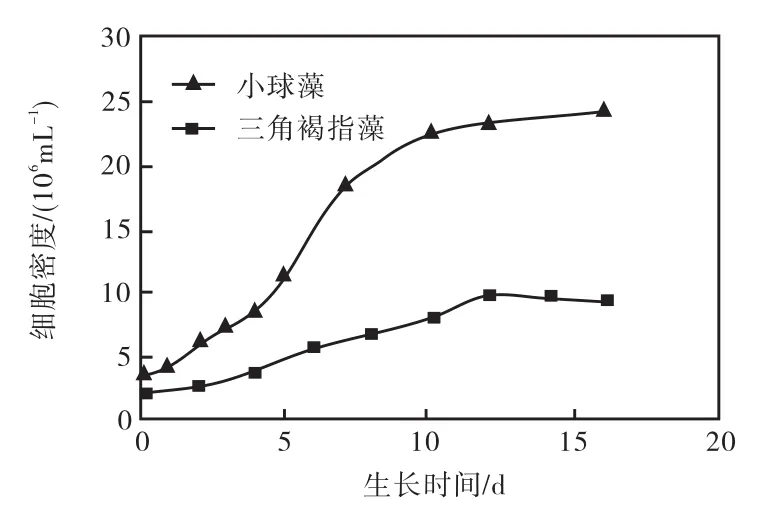
图1 三角褐指藻和小球藻生长曲线Fig.1 Growth curve of Phaeodactylum tricornutum and Chlorella vulgaris
2.2 三角褐指藻和小球藻糖含量的比较
糖含量是衡量食物营养价值高低的重要指标之一.就单个细胞而言,三角褐指藻的糖含量高于小球藻的(图 2),前者是后者的 2.71倍,说明三角褐指藻具有产生较多糖的潜力;但是,能否为人类提供较多的糖,不仅与单细胞的糖含量有关,还与该生物的生物量有关.为此,对两种微藻在 1个生长周期(12 d)内累积的总糖量进行测定,三角褐指藻积累的总糖量达到了 106.6,µg/mL,是同龄小球藻的 1.13倍(图2).结果表明,用相同的时间养殖三角褐指藻获得的糖要多于小球藻的(P<0.05).
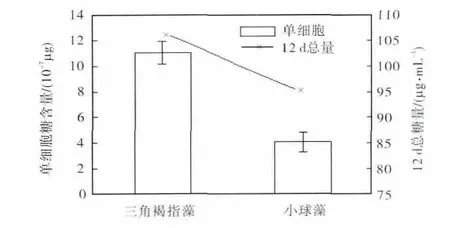
图2 三角褐指藻和小球藻总糖含量比较Fig.2 Comparison of sugar content between Phaeodactylum tricornutum and Chlorella vulgaris
2.3 三角褐指藻和小球藻可溶性蛋白和游离氨基酸含量的比较
蛋白质是细胞的重要结构组分,也是细胞多种功能的执行者,而氨基酸又是构成蛋白质的基本单位,因此蛋白质和氨基酸是衡量食物营养价值的重要指标.检测停滞生长前期藻体内蛋白质、游离氨基酸的含量,结果发现单细胞中三角褐指藻的蛋白质和游离氨基酸含量均高于小球藻,分别为小球藻的 25.3倍和 2.9倍(图 3).在 1个生长周期中,三角褐指藻能形成 8.6,µg/mL的蛋白质和 26.2,µg/mL的游离氨基酸,而小球藻则能形成 0.82,µg/mL的蛋白质和21.7,µg/mL的游离氨基酸,可见三角褐指藻累积的蛋白质和游离氨基酸比小球藻的多(P<0.05).蛋白质和氨基酸的总和代表了人体所能利用的总营养氮.通过计算发现,三角褐指藻的总营养氮是小球藻的1.55倍,说明三角褐指藻能为人类提供更多的营养氮.
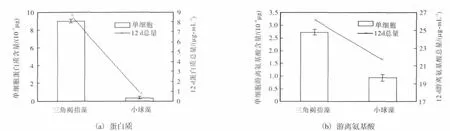
图3 三角褐指藻和小球藻蛋白质和游离氨基酸含量比较Fig.3 Comparison of protein and free amino acids contents between Phaedactylum tricornutum and Chlorella vulgaris
2.4 三角褐指藻和小球藻色素含量的比较
植物细胞中的色素主要有叶绿素和类胡萝卜素,前者又包括叶绿素a和叶绿素b.叶绿素是人体合成血红素的原料之一,类胡萝卜素具有清除人体自由基的功能[13].为此,对三角褐指藻和小球藻的色素含量进行测定,结果如图4所示.
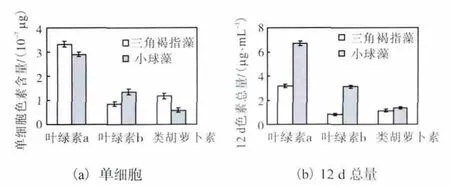
图4 三角褐指藻和小球藻色素含量比较Fig.4 Comparison of pigment content between Phaeodactylum tricornutum and Chlorella vulgaris
单细胞小球藻的叶绿素a、叶绿素b及类胡萝卜素含量分别是三角褐指藻的 87.3%、159%和 49.7%.结果表明,除叶绿素 b外,单细胞小球藻的其他两种色素含量均低于三角褐指藻.1个生长周期后,小球藻中叶绿素a、叶绿素b及类胡萝卜素的累积量分别为三角褐指藻的 210%、383%和 120%.由此可见,尽管单细胞中三角褐指藻的叶绿素 a和类胡萝卜素含量高于小球藻(P<0.05),但因小球藻生长速率高,在1个生长周期后,小球藻中色素的含量均超过了三角褐指藻(P<0.05),但各色素的超出程度不同,类胡萝卜素的高出量最小.因此,仅从色素角度考虑,特别是从叶绿素角度考虑,小球藻的营养价值要高于三角褐指藻.
2.5 三角褐指藻和小球藻不饱和脂肪酸含量的比较
二十碳五烯酸(EPA)(C20∶5)是一种长链多不饱和脂肪酸,在营养强化、防治心血管疾病、减轻炎症等方面起着十分重要的作用[14].采用前述方法测定了两种微藻中EPA的含量,1个生长周期后,三角褐指藻累积了8.12,mg/g的EPA,而小球藻几乎检测不到EPA(表1,图5),说明三角褐指藻的EPA含量远远高于小球藻(P<0.05).前人也报道了类似的结果[15–16].由此可见,在同一时期内,养殖三角褐指藻获得的 EPA要比养殖小球藻多得多.另外,三角褐指藻的棕榈油酸(C16∶1)含量也明显高于小球藻(P<0.05);但小球藻的油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3)、二十碳烯酸(C20∶1)含量却明显高于三角褐指藻(P<0.05)(表 1),说明在累积不饱和脂肪酸方面,两种微藻各有侧重.
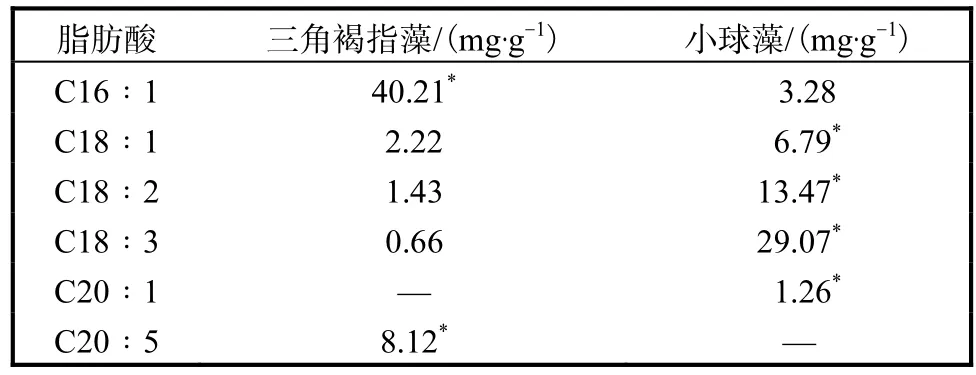
表1 三角褐指藻和小球藻不饱和脂肪酸含量比较Tab.1 Comparison of unsaturated fatty acid content between Phaeodactylum tricornutum and Chlorella vulgaris
图5 三角褐指藻和小球藻脂肪酸气相色谱图Fig.5 Gas chromatogram of fatty acid of Phaeodactylum tricornutum and Chlorella vulgaris
3 讨 论
小球藻含有丰富的蛋白质、多糖、维生素、矿物质和色素等,具有多种保健和药理作用[7,16–17].我国已将小球藻批准为新资源食品[9].小球藻作为营养功效食品已经被人们广泛认识[8].本文以小球藻为参照物,分析了三角褐指藻营养物质的含量.就单个细胞而言,小球藻的叶绿素 b含量高于三角褐指藻.叶绿素 b是天线色素,在细胞中负责光线的吸收和传递[18],较多的叶绿素 b能够吸收较多的光能,从而使植物能够适应强光环境.这可能是小球藻的最佳培养条件中光照度高于三角褐指藻的原因所在.叶绿素 b的含量高,吸收、固定的光能就多,光合作用的产物也多,这些产物能够为生命活动提供更多的能量,因而生长速率也快,最终导致小球藻的生长速率高于三角褐指藻.
单细胞三角褐指藻的多数营养物质含量高于小球藻,说明三角褐指藻具有高效生产营养物质的潜力;但这并不代表人们能够获得较多的营养物质,因为营养物质的总量是由单位细胞中的含量和生物量两个因素决定的.本文检测了 1个生长周期中两种微藻累积的营养物质总量,结果发现三角褐指藻的蛋白质、游离氨基酸、多糖、EPA及棕榈油酸的含量高于小球藻,说明三角褐指藻提供的营养物质总量要比小球藻多.
小球藻的叶绿素 b、油酸、亚油酸、亚麻酸、二十碳烯酸含量高于三角褐指藻.植物中的色素主要包括叶绿素和类胡萝卜素,前者的含量是后者的 3倍,因此,类胡萝卜素比叶绿素更加稀有[19].所以,分析食物的营养价值时,类胡萝卜素的权重要高于叶绿素.另外,油酸、亚油酸、亚麻酸都是高等植物可以合成的不饱和脂肪酸,而高等植物几乎不能合成 EPA,因此 EPA比油酸等不饱和脂肪酸更加稀有.所以,从营养价值的角度考虑,EPA权重要高于油酸等不饱和脂肪酸.综上所述,在同一培养时期,三角褐指藻生产的糖、蛋白质、氨基酸及重要不饱和脂肪酸要多于小球藻,因此它的营养价值不比小球藻低.
尽管三角褐指藻易养殖[1,20–21],有作为提取EPA[3–4]和生物柴油[5–6]的原料的潜力,但因加工成本高还未工业化.目前,唯一利用三角褐指藻的行业是生产动物饲料[2].据统计,世界年销售小球藻干粉2,500吨左右,有人预测[22]今后几年内,小球藻干粉
国际市场总需求量有望上升至 8,000~10,000吨.而本文研究发现,在相同的生长时期内三角褐指藻能够生产出比小球藻更多的营养物质.因此,三角褐指藻的市场竞争力要强于小球藻.如果小球藻干粉的部分市场被三角褐指藻干粉替代,三角褐指藻产业将会获得极大的发展.Draaisma等[23]对2011年欧洲食用油的来源进行了研究,从土地资源、污染物的排放、水资源的消耗等方面分析了养殖三角褐指藻和种植油料作物的经济效益,结果发现前者的养殖效益要高于后者的种植效益.据此,他预测将来欧洲市场的食用油有可能会被三角褐指藻等海洋硅藻油所代替.由此也看出,若三角褐指藻的营养价值被大家认可,则它的开发潜力将是很大的.
[1] 蔡卓平,段舜山. 不同氮浓度下三角褐指藻生长特性和化学组成[J]. 生态环境,2007,16(6):1633-1636.
[2] 岳伟萍. 三角褐指藻作为饲料蛋白质的开发前景研究[J]. 河北渔业,2010(12):13-14.
[3] Otero A,García D,Fábregas J. Factors controlling eicosapentaenoic acid production in semicontinuous cultures of marine microalgae[J]. Journal of Applied Phycology,1997,9(5):465–469.
[4] 吴伟伟,高影影,隆小华,等. 营养盐对三角褐指藻生长及脂肪酸合成的影响[J]. 水产科学,2012,31(9):516-521.
[5] 何峰,傅鹏程,徐春明. 三角褐指藻提取生物柴油的生态响应研究[J]. 石油化工高等学校学报,2011,24(1):1-5.
[6] Lohman E J,Gardner R D,Halverson L,et al. An efficient and scalable extraction and quantification method for algal derived biofuel[J]. Journal of Microbiological Methods,2013,94(3):235-244.
[7] 于贞,王长海. 小球藻培养条件的研究[J]. 烟台大学学报:自然科学与工程版,2005,18(3):206-211.
[8] 孙维宝,李龙囡,张继,等. 小球藻的营养保健功能及其在食品工业中的应用[J]. 食品科学,2010,31(9):323-328.
[9] 中华人民共和国卫生部. 关于批准蛋白核小球藻等 4种新资源食品的公告[J]. 中国食品添加剂,2013(1):227-228.
[10] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein using the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[11] 林炎坤. 常用的几种蒽酮比色定糖法的比较和改进[J]. 植物生理学通讯,1989,25(4):53-55.
[12] 路文静,李奕松. 植物生理学实验教程[M]. 北京:中国林业出版社,2012:59-61.
[13] 李福枝,刘飞,曾晓希,等. 天然类胡萝卜素的研究进展[J]. 食品工业科技,2007,28(9):227-232.
[14] 胡长伟,刘志礼. 富含 EPA 的海洋微藻的规模化生产[J]. 水产科学,2007,26(8):475-477.
[15] Yen H W,Hu I C,Chen C Y. et al. Microalgae-based biorenery:From biofuels to natural product[J]. Bioresource Technology,2013,135:166-174.
[16] 郑雪红,郑爱榕. 气相色谱法分析小球藻脂肪酸的组成[J]. 海洋科学,2012,36(6):22-27.
[17] Lee Y J,Hong Y J,Kim J Y,et al. Dietary Chlorella protects against heterocyclic amine-induced aberrant gene expression in the rat colon by increasing fecal excretion of unmetabolized PhIP[J]. Food and Chemical Toxicology,2013,56:272-277.
[18] Ko S C,Kim D,Jeon Y J. Protective effect of a novel antioxidative peptide purified from a marine Chlorella ellipsoidea protein against free radical-induced oxidative stress[J]. Food and Chemical Toxicology,2012,50(7):2294-2302.
[19] 刘丽娅,陈山,王军,等. 植物天然食用色素的功能及其制备工艺[J]. 食品与发酵工业,2006,32(9):96-100.
[20] 蔡卓平,段舜山,朱红惠. 氮和硅对三角褐指藻细胞增殖的交互作用研究[J]. 水产科学,2013,32(3):125-129.
[21] Acién Fernández F G,Hall D O,Cañizares Guerrero E,et al. Outdoor production of Phaeodactylum tricornutum biomass in a helical reactor[J]. Journal of Biotechnology,2003,103(2):137-152.
[22] 陈晓清,苏育才. 小球藻的应用研究进展[J]. 生物学教学,2012,37(1):8-9.
[23] Draaisma R B,Wijffels R H,Slegers P M,et al. Food commodities from microalgae[J]. Current Opinion in Biotechnology,2013,24(2):169-177.

