人Toll样受体9基因启动子区的生物信息学分析
唐亮,王燕,陈碧峰
1.长沙医学院 基础医学系,湖南 长沙 410219;2.香港中文大学 生物医学院,香港
Toll样受体(Toll-like receptor,TLR)是免疫过程中重要的病原体识别受体,在天然免疫和获得性免疫过程中起重要作用[1]。TLR9属于TLR家族,定位于内体膜上,在序列结构上具有高度的保守性[2]。TLR9广泛表达于机体各处组织,且具有组织特异性。在细胞水平上,TLR9主要表达于抗原提呈细胞,T细胞、单核细胞等中的TLR9表达量很少。不同动物、不同细胞群的表达水平差异较大。研究表明,免疫细胞通过TLR9识别含CpG基序的寡聚脱氧核苷酸(CpG-ODN)[3]。TLR9表达失衡可能导致动物感染性疾病[4]、自身免疫性疾病[5]及肿瘤[6]等。
表观遗传学研究提示CpG岛甲基化在基因表达调控中的重要作用,尤其是启动子区序列甲基化状态对基因的表达影响深远。进一步探讨TLR9基因表达调控,有利于深入了解其在疾病发生中的生物学作用。我们利用生物信息学技术预测了TLR9基因启动子区,获得了基因启动子区的甲基化区域及转录因子结合部位,为进一步研究TLR9基因在疾病患者中的基因调控研究奠定了基础。
1 材料与方法
1.1 材料
在GenBank数据库中检索人(HOMO)和小鼠(MUS)TLR9基因,ID分别为54106和81897,获得Genbank格式文件。
在线核算数据库(http://www.ncbi.nlm.nih.gov/genbank/);序 列 对 比 BLASTN(http://blast.ncbi.nlm.nih.gov/);启动子在线分析软件[Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/);Network Promot⁃er Prediction(http://www.fruitfly.org/seq_tools/promot⁃er.html);Promoter SCAN(http://www-bimas.cit.nih.gov/molbio/proscan/)];转录因子预测软件(P-Match 1.0,http://www.gene-regulation.com/pub/programs.ht⁃ml#match);两序列间保守区域转录因子结合部位预测 软 件(Consite,http://asp.ii.uib.no:8090/cgi-bin/CONSITE/consite/);CpG 岛预测软件(http://cpgis⁃lands.usc.edu/)。
1.2 方法
获得人和小鼠TLR9基因同源序列,确定TLR9基因启动子区,利用上述软件预测TLR9基因启动子。利用P-Match 1.0程序,核心序列相似性设定为0.80,矩阵相似性设定为 0.85,输入 TLR9 基因上游3000 bp序列,搜索转录因子结合部位,获得启动子区转录因子结合位点。利用Consite程序搜索人与小鼠TLR9基因保守区,排除假阳性结合部位。将TLR9启动子区域序列导入CpG岛在线软件进行甲基化预测。
2 结果
2.1 人和小鼠TLR9基因启动子定位
人TLR9基因定位于染色体3p21.3,有2个外显子、1个内含子。转录mRNA的ID为NT_022517,跨越5084 bp。小鼠TLR9基因定位于染色体9F1;9,转录mRNA的ID为NM_031178.2,跨越4279 bp。
2.2 TLR9基因启动子预测结果
通过检索GenBank数据库,对人TLR9基因第一外显子上游3000 bp序列采用3种软件预测分析,得出潜在的启动子结构(表1)。用3种不同的在线软件预测的TLR9基因启动子区域有一定的差异。用Promoter Scan程序未预测到相应的启动子区域,提示可能该启动子缺失保守序列TATA盒。
2.3 TLR9基因启动子区转录因子结合位点分析
采用P-Match 1.0程序,核心序列相似性设定为0.80,矩阵相似性设定为 0.85,输入 TLR9 基因上游3000 bp序列,搜索库中脊椎动物转录因子结合部位数据库,获得启动子区转录因子结合位点共1434个。利用足迹法,采用Consite程序分析人与小鼠TLR9基因保守区域,对比确定保守区域中共有的转录因子有23个(表2)。
2.4 启动子CpG岛预测结果
用CpG岛预测软件分析人TLR9基因启动子,发现该序列存在长度为572 bp(798~1359 bp)的CpG岛,(G+C)含量为 66.4%,CpG 观测值/预测值为0.679。见图1。
3 讨论
启动子是RNA聚合酶识别、结合并开始转录所必需的一段DNA序列。基因启动子DNA的甲基化状态及转录因子结合顺序决定了基因表达的时间、空间及数量等特性,也是基因表达调控的重要组成部分。现阶段采用实验方法检测基因启动子CpG岛和转录因子结合位点的难度较大。基于生物信息学技术,采用预测软件,以理论预测的方法可以有效、快速地获得基因的结构和状态。
然而,基于各种算法的在线预测软件对启动子区、CpG岛及转录因子结合位点的预测并不完全可靠。启动子的预测算法有多种。Promoter 2.0是基于启动子区转录信号,如TATA盒、CAAT盒、GC盒等位置和距离的一类算法的预测软件,而Promoter Scan是基于转录因子结合部位分布密度与TATA盒的权重矩阵而开发的预测软件。不同的算法有不同的预测结果,且存在假阳性,须综合考虑。
在转录因子结合位点的预测中,程序只能针对已知位点进行预测,对未知的、新的转录因子结合位点则无法分析。从人TLR9基因启动子区预测到与小鼠同源的23个转录因子结合位点,提示TLR9基因启动子在进化上高度保守,为今后进行异种转基因及相关实验提供了参考。

表1 TLR9基因启动子预测结果
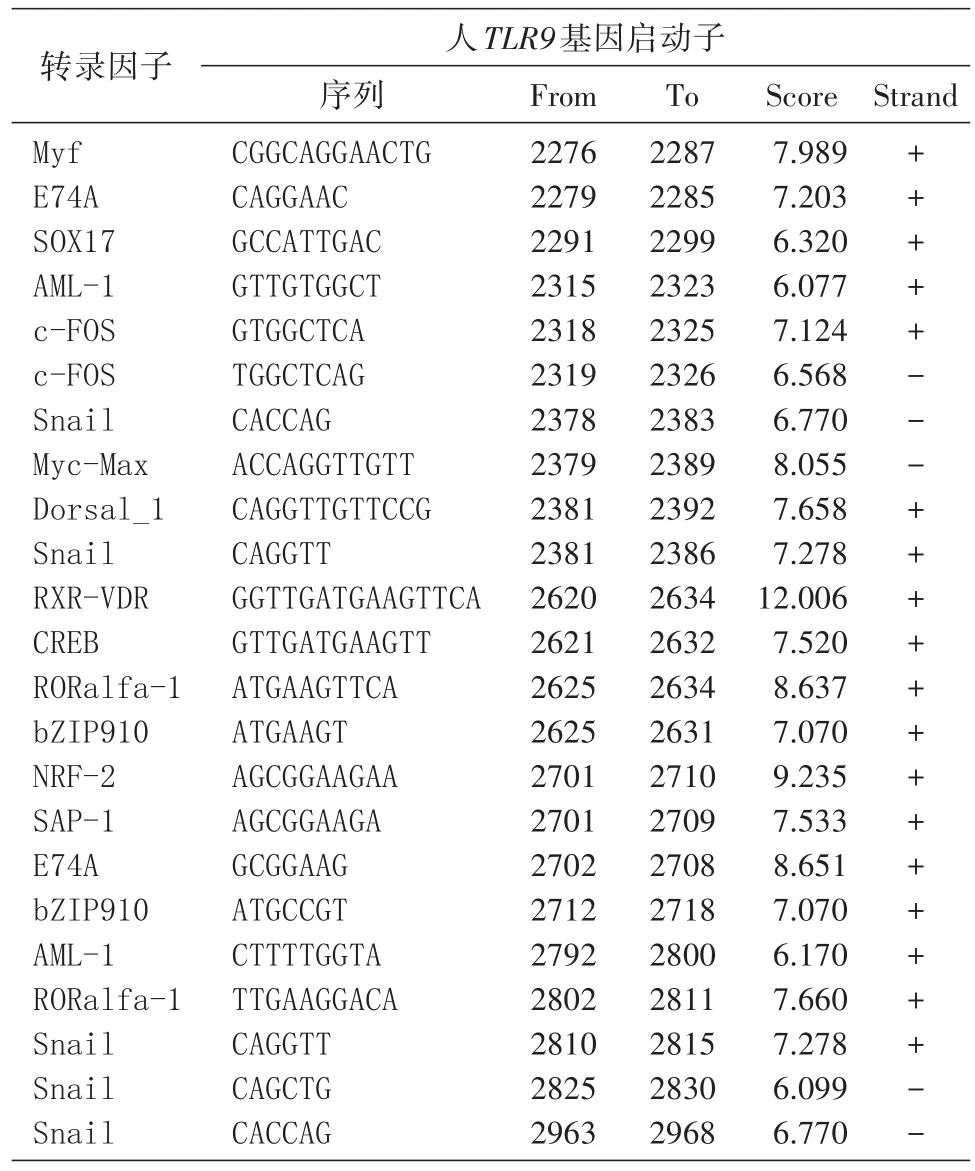
表2 人TLR9基因启动子区转录因子结合位点预测结果

图1 人TLR9基因启动子CpG岛分析结果
在哺乳动物中,DNA甲基化位点主要发生在CpG二核苷酸胞嘧啶的第5位碳原子上[7]。CpG以散在和集聚(CpG岛)两种形式存在。DNA的甲基化不仅影响基因本身的表达,而且这种影响能够遗传下去。而TLR9基因启动子区存在572 bp的CpG岛,预示着此段基因序列可能与感染性疾病、自身免疫病及肿瘤等发生有关,但此结论需要进一步的实验验证。
[1] 杜毓,房兴堂,陈宏,等.TLR9基因遗传多态性与疾病关系的研究进展[J].科技信息,2009,9:31-32.
[2] 李琰,郑世民,郑琪,等.Toll样受体9及其与动物疾病的研究进展[J].细胞与分子免疫学杂志,2009,25(12):1214-1216.
[3] Hashimoto M,Asahina Y,Sano J,et al.Cloning of canine Toll-like receptor 9 and its expression in dog tissues[J].Vet Immunol Immunop,2005,106:159-163.
[4] Wu C C,Sabet M,Hayashi T,et al.In vivo efficacy of a phosphodiester TLR-9 aptamer and its beneficial effect in a pulmonary anthrax infection model[J].Cell Immunol,2008,251:78-85.
[5] Rifkin I R,Leadbetter E A,Busconi L,et al.Toll-like recep⁃tors,endogenous ligands,and s ystemic autoimmune disease[J].Immunol Rev,2005,204:27-42.
[6] Rayburn E R,Wang W,Zhang R,et al.Experimental thera⁃py for colon cancer:anti-cancer effects of TLR9 agonism,combination with other therapeuticmodalities,and dependence upon p53[J].Int J Oncol,2007,30:1511-1519.
[7] 邱烈.CpG岛甲基化异常的致癌作用[J].检验医学与临床,2007,4(8):746-748.

