皮状丝孢酵母同步利用葡萄糖/木糖的糖转运动力学
胡翠敏,王 倩,龚志伟,杨晓兵,靳国杰,沈宏伟,赵宗保
(1.中国科学院 大连化学物理研究所 生物技术部,大连 116023;2.天津大学 化工学院,天津 300072)
近年来,利用木质纤维素生产微生物油脂受到广泛关注[1-3],微生物油脂技术对缓解生物柴油规模化生产原料短缺的瓶颈具有重要意义。由于木质纤维素水解产物中同时含有葡萄糖和木糖,高效转化利用葡萄糖和木糖对生物质生物转化过程的经济性具有重要影响。然而,葡萄糖通常为微生物偏好底物,对木糖利用存在抑制作用。如何克服葡萄糖效应,实现五、六碳糖高效共利用,成为当前生物炼制研究的热点之一[4-6]。
跨膜运输是糖分子生物转化的第一步,在某些情况下是限速步骤[7]。酵母菌最常见的2种糖跨膜运输机制为协助扩散和质子/糖同向运输[8-10]。在酿酒酵母Saccharomyces cerevisiae中,已发现20种不同己糖转运子均采用协助扩散机制[11]。虽然质子/糖同向运输体系在S.cerevisiae中尚未发现,但多数葡萄糖苷类物质依赖质子同向运输体系[12-13]。酿酒酵母没有木糖特异的转运子,因此木糖跨膜运输借助己糖转运系统实现,但转运速率远低于葡萄糖[6]。在 S.cerevisiae中表达来源于 Arabidopsis thaliana的2个转运子,提高了木糖转化率,但重组菌株仍然存在葡萄糖效应[6]。葡萄糖抑制木糖转运,导致葡萄糖优先利用,推测木糖跨膜运输是木糖利用的限速步骤之一[14-15]。
Hu等[16]研究发现皮状丝孢酵母 Trichosporon cutaneum能同步利用葡萄糖和木糖生产油脂,进一步研究该酵母利用葡萄糖和木糖的混合糖时没有底物偏好性,对探索消除葡萄糖效应的方法以及纤维素生物能源的生产有重要价值。2-脱氧葡萄糖(2-DOG)由于不易被代谢,且通常与葡萄糖共用转运载体,常作为葡萄糖类似物以考察葡萄糖转运规律[17-18]。笔者以2-DOG 为底物,考察皮状丝孢酵母单糖跨膜运输特性,以期揭示葡萄糖和木糖同步利用的机制。
1 材料和方法
1.1 化学试剂
2-脱氧葡萄糖,Acros公司;N,N'-二环己基碳化二亚胺 (DCC)、羰基氰化物间氯苯腙 (CCCP),Sigma公司;4-硝基苯酚 (4-NP)、叠氮化钠,国药集团。其他试剂均为分析纯。
1.2 实验方法
1.2.1 菌悬液制备
将-80℃保存的皮状丝孢酵母AS 2.571(中国普通微生物菌种保藏管理中心)在新鲜YEPD(yeast extract、peptone、dextrose)斜面 (葡萄糖 20 g/L,酵母粉10 g/L,蛋白胨10 g/L,琼脂15 g/L)上活化,取一环接种于装有50 mL液体YEPD的250 mL三角瓶中,于30℃、200 r/min摇床中培养24 h,然后取0.5 mL二次转接于同样的培养基,于30℃、200 r/min摇床中培养 18 h。8 000 r/min离心5 min,用0.1 mol/L KH2PO4溶液 (pH 4.6)洗涤2遍[19],并重悬于该溶液至细胞质量浓度为10 g/L(以细胞干质量计),于30℃、200 r/min培养30 min后置于0℃备用。
1.2.2 转运实验操作及试样制备
取0℃保存的菌悬液1 mL与底物一起于30℃平衡10 min,加入200 μL底物与菌悬液混合开始反应,混匀,取1 mL菌液用0.45 μm真空膜快速(耗时60 s)过滤,用3.0 mL冰水洗涤菌体,将菌体连同滤膜转移到1 mL水中,微波处理并迅速冷却(800 W,1 min/次,2次),再加入1 mL水混匀,离心取上清液备用。为了排除细胞对底物的非特异性吸附,采用菌体和底物均在0℃平衡,混合后迅速过滤,按照上述方法测定细胞吸附底物的量。
①葡萄糖和木糖对2-DOG跨膜运输的影响。将葡萄糖或木糖与2-DOG混合,同时作为底物考察其对2-DOG跨膜运输的影响。
②转运抑制作用考察。反应开始前2 min向菌液添加不同浓度的转运抑制剂(叠氮化钠,DCC,CCCP或4-NP),取叠氮化钠水溶液或其他3种化合物95%乙醇溶液(乙醇在反应混合物中的体积分数低于1%)10 μL,然后添加 190 μL 浓度为 0.475 mmol/L的2-DOG开始反应,对照组分别添加10 μL水和10 μL 95%乙醇,考察它们对2-DOG转运的影响。
③pH对2-DOG转运的影响。用 KH2PO4和K2HPO4配制不同pH的缓冲液,浓度为0.1 mol/L。细胞悬液用缓冲液洗涤1遍并重悬于该缓冲液,2-DOG浓度为0.5 mmol/L,考察pH对2-DOG转运的影响。
1.2.3 试样分析及数据处理
胞内糖浓度采用离子色谱分析,实验条件为PA10色谱柱和PA10保护柱,ED50电化学检测器,流动相为18 mmol/L NaOH,流速1.0 mL/min,柱温30℃。在此条件下,2-DOG、葡萄糖和木糖的保留时间分别为7.2、11.4和12.9 min。细胞干质量的测定方法参照文献[20]。数据处理采用软件Origin 8.0。数据为2个试样的平均值,误差线表示标准偏差。
2 结果与讨论
测定糖分子跨膜运输速率的方法受到多重因素影响,主要包括:试样前处理过程的可重复性,进入细胞后的代谢过程以及细胞转运活性的稳定性[19]。尽量缩短转运时间并采用不能被微生物代谢的类似物2-DOG,避免了代谢过程的影响。将细胞悬液于冰上保存,采取终点法记录转运及过滤的总时间,用于计算糖转运速率。通过采取上述措施,发现实验数据的重复性较好,为测定皮状丝孢酵母单糖跨膜运输特性打下了基础。
2.1 2-DOG转运动力学
实验结果表明,2-DOG跨膜运输速率在初始50 s内保持稳定,所以实验选取30 s作为转运时间来考察。2-DOG转运动力学如图1所示。由图1可知:2-DOG跨膜运输符合米氏动力学方程,经非线性回归计算,表观米氏常数Km为0.19 mmol/L,最大速率Vmax为14.1 nmol/(min·mg)。饱和米氏动力学曲线表明是有载体介导的转运机制[21]。Eadie-Hofstee曲线呈线性,说明在此条件下可能仅存在1个2-DOG转运体系。

图1 2-DOG转运动力学(插图为E-H曲线)Fig.1 Kinetics of 2-DOG transport(Inset,the E-H plot)
2.2 葡萄糖和2-DOG转运的关系
考察葡萄糖对皮状丝孢酵母2-DOG转运活性的影响,结果见图2。由图2可知:在没有添加葡萄糖的条件下,2-DOG浓度为 0.1 mmol/L和 0.4 mmol/L所得到的2-DOG转运速率分别为(4.8±0.1)和(9.3±0.3)nmol/(min·mg)。随着葡萄糖浓度升高,2-DOG转运速率降低。据图2数据计算,当2-DOG浓度为0.1 mmol/L、葡萄糖浓度达到0.28 mmol/L时,2-DOG转运速率降低50%;2-DOG浓度升高到0.4 mmol/L时,2-DOG转运速率降低50%所需葡萄糖浓度为0.65 mmol/L。由Dixon曲线可知,葡萄糖竞争性抑制2-DOG转运,表观抑制常数Ki为0.26 mmol/L,表明葡萄糖和2-DOG共用一个转运体系,并且该转运体系对两者的亲和力相近。
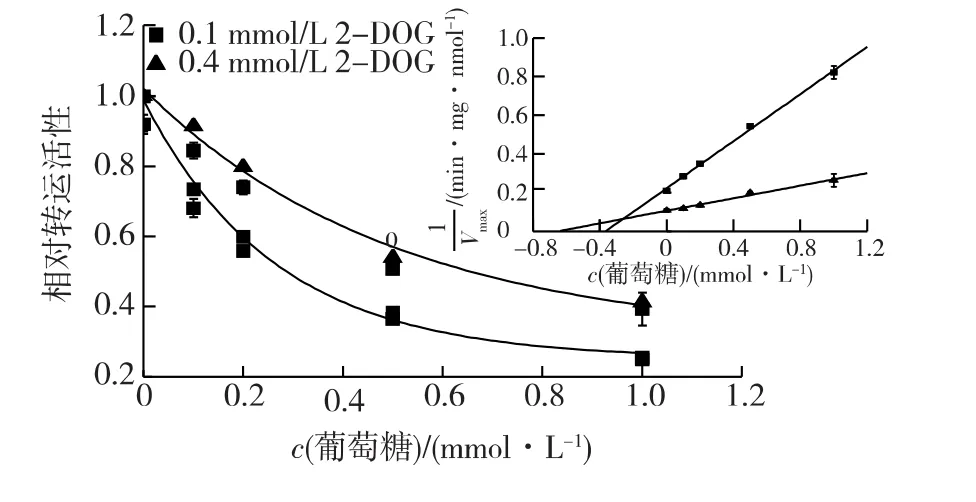
图2 葡萄糖对2-DOG转运的影响(插图为Dixon图)Fig.2 Effects of glucose-mediated inhibition on 2-DOG transport(Inset,Dixon plot)
2.3 木糖对2-DOG转运的影响
将木糖与2-DOG同时作为底物考察皮状丝孢酵母转运两者的规律,结果见图3。由图3可知:当2-DOG浓度分别为0.1和0.5 mmol/L时,没有木糖的情况下,2-DOG转运速率分别为(4.1±0.1)和(8.4±0.2)nmol/(min·mg);添加1 mmol/L木糖后,2-DOG转运速率分别降低16%和3%。当底物中2-DOG浓度为0.1 mmol/L时,转运速率降低50%需要木糖12.7 mmol/L;底物中2-DOG浓度为0.5 mmol/L时,转运速率降低50%需要木糖20.5 mmol/L。由图3还可知,木糖也竞争性抑制2-DOG转运,表明木糖和2-DOG共用同一个转运体系。木糖对2-DOG转运的表观抑制常数Ki为10.3 mmol/L,远大于葡萄糖对应的表观抑制常数,说明该转运系统对木糖的亲和力远低于葡萄糖。
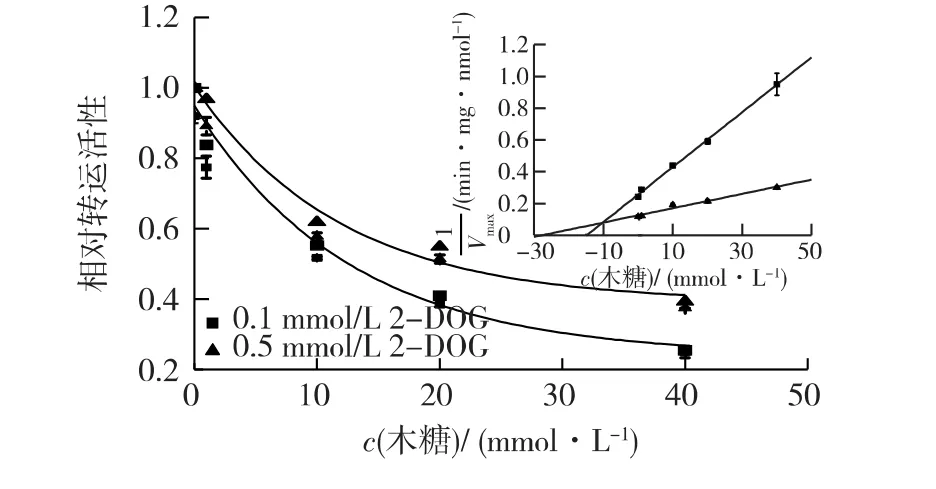
图3 木糖对2-DOG转运的影响(插图为Dixon图)Fig.3 Effects of xylose-mediated inhibition on 2-DOG transport(Inset,Dixon plot)
进一步检测发现,胞内积累2-DOG的同时也积累了大量木糖。由于胞内2-DOG浓度高于胞外,推测2-DOG为主动运输过程。假设1.0 mg细胞干质量相当于2.0 μL胞内水分[22],计算所得数据如表1所示。由表1可知:木糖和2-DOG同时运输到胞内,并且底物中木糖浓度越高,胞内2-DOG浓度越低,胞内木糖浓度也越高。当底物中木糖浓度为40 mmol/L时,胞内木糖浓度高达2-DOG浓度的18倍。此现象说明,虽然转运蛋白对木糖的亲和力较低,但是木糖可能具有更高的Vmax[23]。由于发酵过程中底物远远过量,其跨膜运输以较高速率进行。葡萄糖转运速率接近2-DOG转运的最大速率Vmax,即14.1 nmol/(min·mg),而木糖转运速率可能更高。由发酵实验结果计算得知,当培养基中葡萄糖和木糖浓度比为1∶1时,消耗速率分别为0.28 g/(L·h)和0.29 g/(L·h)[16],比消耗速率分别为 1.1 和1.4 nmol/(min·mg)。所以,葡萄糖和木糖跨膜运输很可能不是限速步骤,因此发酵过程中2种底物的利用没有明显偏好性。
毕赤酵母Pichia heedii在利用葡萄糖和木糖时存在明显的葡萄糖效应[24],木糖跨膜运输完全被葡萄糖抑制,但木糖不影响葡萄糖跨膜运输。所以,木糖与葡萄糖共运输,以及木糖抑制葡萄糖转运是葡萄糖和木糖同步利用的前提条件。
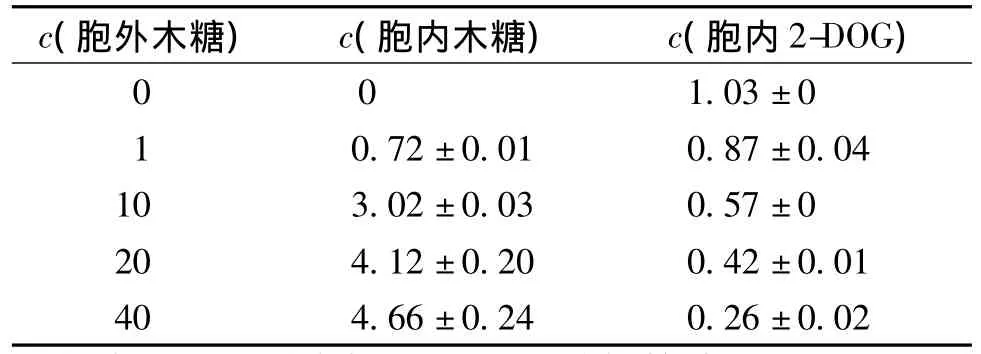
表1 胞内2-DOG和木糖浓度分析Table 1 Intracellular 2-DOG and xylose concentration at different extracellular xylose levels mmol·L -1
2.4 代谢抑制剂和pH对2-DOG转运的影响
质子导体和代谢抑制剂能够抑制质子梯度的形成,从而抑制质子/糖同向运输。考察4种抑制剂对皮状丝孢酵母转运糖特性的影响,结果见表2。由表2可知:4种抑制剂均对2-DOG转运存在明显抑制作用,抑制能力从强到弱的顺序为CCCP、叠氮化钠、4-NP和 DCC。其中,CCCP浓度为 0.05 mmol/L就能抑制2-DOG转运活性的91%。2-DOG对代谢抑制剂的敏感性表明存在以质子梯度为动力 的 糖 主 动 运 输 过 程[25]。 在 Hansenula polymorpha[26-27], Kluyveromyces marxianus[28]和Rhodotorula gracilis[29]等酵母中也发现了同样的转运机制。S.cerevisiae中发现的主动运输过程也都属于质子同向运输体系[25,30]。

表2 抑制剂对2-DOG转运的影响Table 2 Effects of inhibitors on 2-DOG transport
质子同向运输体系运输糖分子的过程对外界pH变化非常敏感[31-32]。图4为pH对运输分子的影响结果。由图4可知:当以0.5 mmol/L 2-DOG为底物时,pH由8降低到4.6,转运速率逐步增大;pH为 4.6时,转运速率为 (7.5±0.1)nmol/(min·mg)。结果符合一般的质子/糖同向运输机制,即质子梯度是主动运输过程的主要推动力[26,33]。当 pH 为8时,暗示存在其他转运体系,而质子同向运输体系在酸性条件下起主要作用。
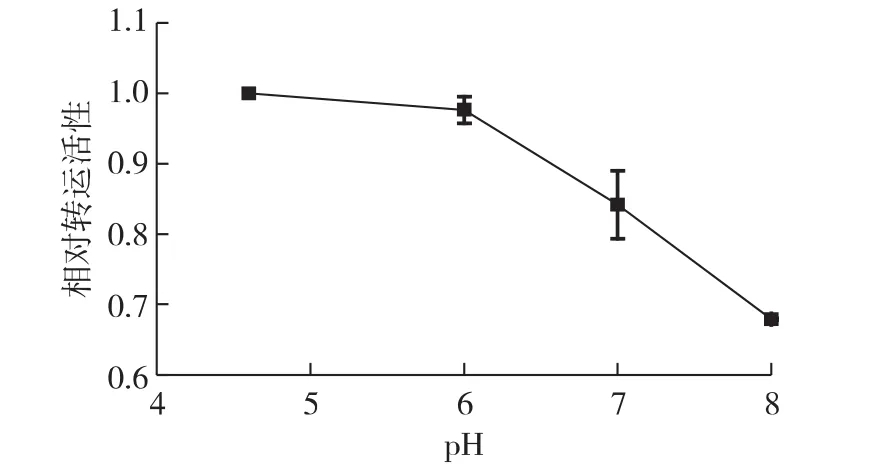
图4 外界pH对2-DOG转运的影响Fig.4 Effect of external pH on 2-DOG transport
3 结论
在油脂酵母T.cutaneum中,葡萄糖和木糖与2-DOG共用同一个转运系统,经验证为质子/糖同向运输体系。该酵母中,葡萄糖和木糖同步跨膜进入胞内,与以往报道的葡萄糖效应菌株不同。分离获得该转运体系的相关基因,对阐明同步利用机制、改造工业菌株以及木质纤维素高效转化有重要意义。
[1] 赵宗保.加快微生物油脂研究为生物柴油产业提供廉价原料[J].中国生物工程杂志,2005,25(2):8-11.
[2] Huang C,Chen X F,Xiong L,et al.Single cell oil production from low-cost substrates:the possibility and potential of its industrialization[J].Biotechnol Adv,2013,31(1):129-139.
[3] Tao J,Dai C C,Yang Q Y,et al.Production of biodiesel with acid hydrolysate of Populus euramevicana CV leaves by Rhodotorula glutinis[J].Int J Green Energy,2010,7(4):387-396.
[4] Gong Z W,Shen H W,Wang Q,et al.Efficient conversion of biomass into lipids by using the simultaneous saccharification and enhanced lipid production process[J].Biotechnol Biofuels 2013,6:36.
[5] Ha S J,Galazka J M,Kim S R,et al.Engineered Saccharomyces cerevisiae capable of simultaneous cellobiose and xylose fermentation[J].PNAS,2011,108(2):504-509.
[6] Hector R E,Qureshi N,Hughes S R,et al.Expression of a heterologous xylose transporter in a Saccharomyces cerevisiae strain engineered to utilize xylose improves aerobic xylose consumption[J].Appl Microbiol Biotechnol,2008,80(4):675-684.
[7] Ligthelm M E,Prior B A,Dupreez J C,et al.An investigation of D-(1-C-13)xylose metabolism in Pichia stipitis under aerobic and anaerobic conditions[J].Appl Microbiol Biotechnol,1988,28(3):293-296.
[8] Fuhrmann G F,Volker B.Regulation of glucose transport in Saccharomyces cerevisiae[J].J Biotechnol,1992,27(1):1-15.
[9] Romano A H.Facilitated diffusion of 6-deoxy-D-glucosein Bakers' yeast:evidence against phosphorylation-associated transport of glucose[J].J Bacteriol,1982,152(3):1295-1297.
[10] Hauer R,Hofer M.Evidence for interactions between the energydependent transport of sugars and the membrane potential in the yeast Rhodotorula gracilis(Rhodosporidium toruloides)[J].J Membr Biol,1978,43(4):335-349.
[11] Leandro M J,Fonseca C,Goncalves P.Hexose and pentose transport in ascomycetous yeasts:an overview[J].FEMS Yeast Res,2009,9(4):511-525.
[12] Cassio F,Leao C,Van Uden N.Transport of lactate and other short-chain monocarboxylates in the yeast Saccharomyces cerevisiae[J].Appl Environ Microbiol,1987,53(3):509-513.
[13] Stambuk B U,Silva M A,Panek A D,et al.Active alphaglucoside transportin Saccharomycescerevisiae[J].FEMS Microbiol Lett,1999,170(1):105-110.
[14] Kilian S G,Vanuden N.Transport of xylose and glucose in the xylose-fermenting yeastPichia stipitis[J].ApplMicrobiol Biotechnol,1988,27(5/6):545-548.
[15] Cirillo V P.Relationship between sugar structure and competition for the sugar transport system in Bakers'yeast[J].J Bacteriol,1968,95(2):603-611.
[16] Hu C M,Wu S G,Wang Q,et al.Simultaneous utilization of glucose and xylose for lipid production by Trichosporon cutaneum[J].Biotechnol Biofuels,2011,4:25.
[17] Hansen P,Gulve E,Holloszy J.Suitability of 2-deoxyglucose for in vitro measurement of glucose transport activity in skeletal muscle[J].J Appl Physiol,1994,76(2):979-985.
[18] Van Steveninck J.Transport and transport-associated phosphorylation of 2-deoxy-D-glucose in yeast[J].Biochim Biophys Acta Biomembr,1968,163(3):386-394.
[19] Barnett J A,Sims A P.Some physiological observations on uptake of D-glucose and 2-deoxy-D-glucose by starving and exponentially-growing yeasts[J].Arch Microbiol,1976,111(1/2):185-192.
[20] Hu C M,Zhao X,Zhao J,et al.Effects of biomass hydrolysis byproducts on oleaginous yeast Rhodosporidium toruloides[J].Bioresour Technol,2009,100(20):4843-4847.
[21] Briczinski E P,Phillips A T,Roberts R F.Transport of glucose by Bifidobacterium animalis subsp.lactis occurs via facilitated diffusion[J].Appl Environ Microbiol,2008,74(22):6941-6948.
[22] Meredith S A,Romano A H.Uptake and phosphorylation of 2-deoxy-D-glucose by wild-type and respiration-deficient Bakers'yeast[J].Biochim Biophys Acta,1977,497(3):745-759.
[23] Lucas C,van Uden N.Transport of hemicellulose monomers in the xylose-fermenting yeast Candida shehatae[J].Appl Microbiol Biotechnol,1986,23(6):491-495.
[24] Does A L,Bisson L F.Characterization of xylose uptake in the yeasts Pichia heedii and Pichia stipitis[J].Appl Environ Microbiol,1989,55(1):159-164.
[25] Hollatz C,Stambuk B U.Colorimetric determination of active alpha-glucoside transport in Saccharomyces cerevisiae[J].J Microbiol Methods,2001,46(3):253-259.
[26] Viigand K,Alamae T.Further study of the Hansenula polymorpha MAL locus:characterization of the alpha-glucoside permease encoded by the HpMAL2 gene[J].FEMS Yeast Res,2007,7(7):1134-1144.
[27] Karp H,Alamae T.Glucose transport in a methylotrophic yeast Hansenula polymorpha[J].FEMS Microbiol Lett,1998,166(2):267-273.
[28] Gasnier B.Characterization of low-and high-affinity glucose transports in the yeast Kluyveromyces marxianus[J].Biochim Biophys Acta Biomembr,1987,903(3):425-433.
[29] Hofer M,Misra P C.Evidence for a proton/sugar symport in the yeast Rhodotorula gracilis(glutinis)[J].Biochem J,1978,172:15-22.
[30] Stambuk B U,de Araujo P S.Kinetics of active alpha-glucoside transport in Saccharomyces cerevisiae[J].FEMS Yeast Res,2001,1(1):73-78.
[31] Nobre A,Lucas C,Leao C.Transport and utilization of hexoses and pentoses in the halotolerant yeast Debaryomyces hansenii[J].Appl Environ Microbiol,1999,65(8):3594-3598.
[32] Janda S,Kotyk A,Tauchova R.Monosaccharide transport systems in the yeast Rhodotorula glutinis[J].Arch Microbiol,1976,111(1):151-154.
[33] Harold F M.Chemiosmotic interpretation of active-transport in bacteria[J].Ann New York Acad Sci,1974,227:297-311.
[34] Katahira S,Ito M,Takema H,et al.Improvement of ethanol productivity during xylose and glucose co-fermentation by xyloseassimilating S.cerevisiae via expression of glucose transporter Sut1[J].Enzyme Microbial Technol,2008,43:115-119.

