大肠杆菌碳分解代谢抑制及混合C源共利用的研究进展
张 旭,李宜奎,祁庆生
(山东大学 微生物技术国家重点实验室,济南 250100)
大肠杆菌利用环境中的碳水化合物作为生长代谢的C源和能源时,需要经过两层同轴心的外膜和内膜(细胞质膜)将其从细胞外转运到细胞质内。以大肠杆菌偏好的C源和能源——葡萄糖为例(图1),大肠杆菌先通过位于外膜上的非特异性的OmpC、OmpF和LamB孔蛋白以自由扩散的方式将细胞外的糖分子运输到周质空间[1];而后通过激活内膜上特异性的糖转运系统以主动运输的方式将周质空间的糖分子运送到细胞内。葡萄糖专一性的磷酸烯醇式丙酮酸(PEP)依赖的磷酸转移酶系统(PTSGlc)是大肠杆菌将周质空间内的葡萄糖转运到细胞质内的主要运输途径[1-3]。PTSGlc由 4 个蛋白 EI(ptsI)、HPr(ptsH)、EIIAGlc(crr)、EIIBCGlc(ptsG)组成,这些蛋白参与胞内PEP与周质空间内葡萄糖间的磷酸级联传递,并同时将葡萄糖内质化。可溶性的EI和HPr蛋白是非底物专一性的,是所有磷酸转移酶系统中共有组分,负责将胞内PEP的磷酸基团传递给糖专一性的可溶性蛋白EIIAGlc和EIIBGlc;糖专一性的膜整合蛋白EIICGlc(和EIIDGlc)负责识别糖分子,并接受EIIBGlc的磷酸,同时将周质空间内的糖分子磷酸化和内质化。其他的糖特异性PTS蛋白,如甘露糖专一性的EIIABMan和EIICDMan,也具有亲和转运葡萄糖的能力[1,4]。另外,半乳糖的2种非PTS运输载体GalP和MglBAC同样具有亲和、转运葡萄糖的能力,前者为糖与H+同向运输载体,后者为 ABC(ATP-binding cassette transporter,ABC)运输载体;通过这2个转运系统内质化的葡萄糖需要进一步经过Glk(glk)催化并以ATP为磷酸供体将葡萄糖磷酸化为葡萄糖-6-磷酸,以进入糖酵解途径[5]。
PTSGlc不仅是葡萄糖转运的主要途径,而且在细胞内全局信号调节中也起关键作用。当环境中存在葡萄糖和其他C源时,PTSGlc调控细胞优先吸收利用葡萄糖,然后再利用其他C源。笔者总结了葡萄糖存在时的碳分解代谢抑制作用,并讨论了如何通过代谢工程改造使得大肠杆菌能够同时利用多种混合C源。
1 碳分解代谢抑制作用
C源的高效利用对于微生物在竞争的自然环境下维持生存是十分重要的。为了有效地利用C源,细菌在不断的进化中获得了一种自身调节机制,即选择性优先利用能够供自身快速生长的C源(如葡萄糖),抑制次要C源转运和代谢所需酶的合成和激活,这个现象被定义为碳分解代谢抑制(carbon catabolite repression,CCR)。该机制导致了C源的先后利用,从而引起细菌的二次生长现象。在大肠杆菌中,CCR参与细胞内cAMP(cyclic AMP)、腺苷酸环化酶(adenylate cyclase,AC)、代谢激活蛋白(CAP)和 PTSGlc中 EIIAGlc间的信号调节[6]。
其中,对碳分解代谢抑制影响最大的2个因素分别是cAMP-cAMP受体蛋白(CRP)的转录调控作用和诱导物阻遏作用,这2种作用机制都是以PTSGlc组分中EIIA的磷酸化水平为调节信号。此外,胞质中PEP/PYR比率以及一些专一性的转录调控因子也参与碳分解代谢抑制作用的发生(图1)。
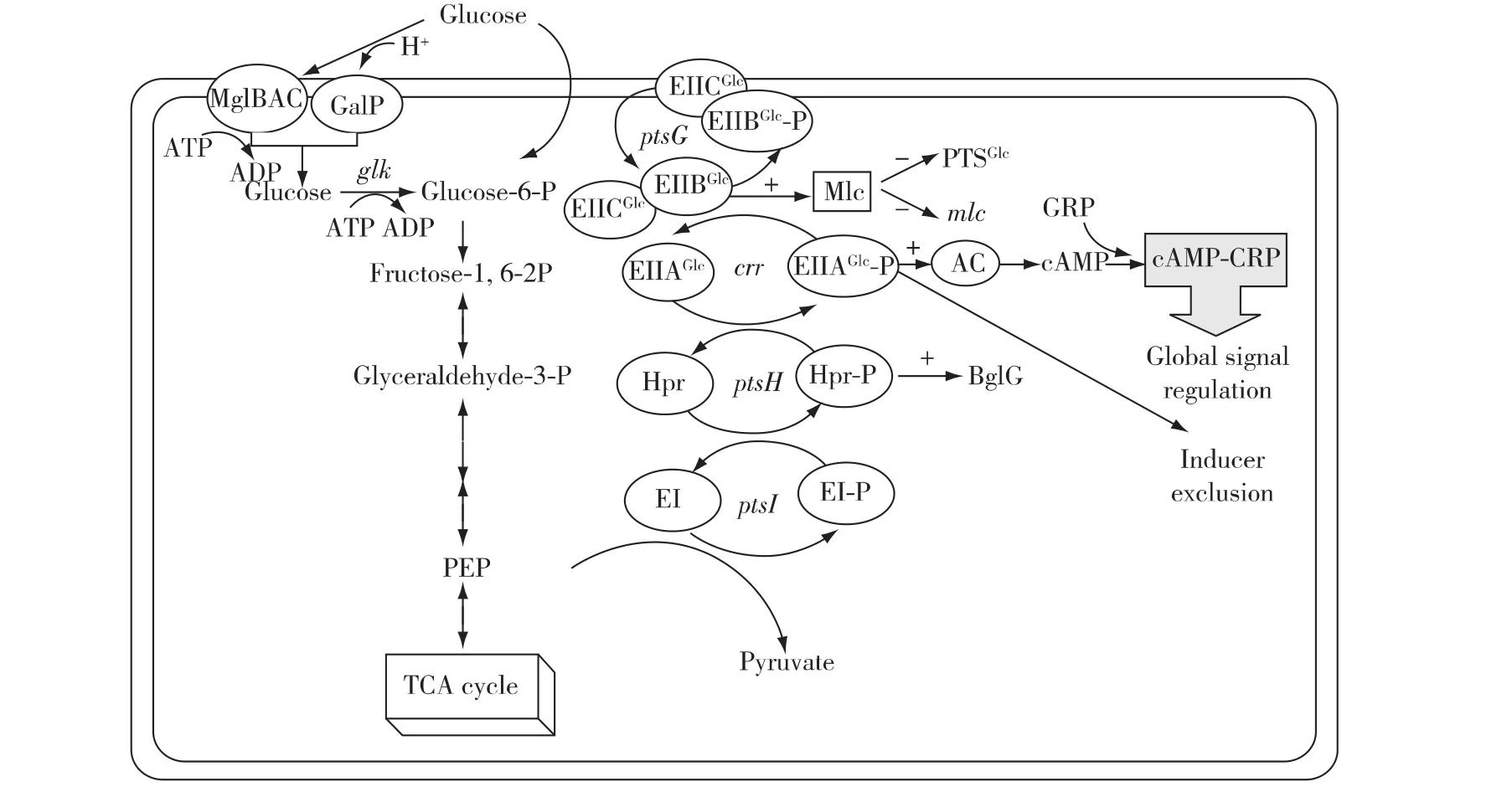
图1 大肠杆菌的PTSGlc参与的葡萄糖转运及碳分解代谢抑制作用Fig.1 Glucose transport system and carbon catabolite repression related with PTSGlcin Escherichia coli
1.1 cAMP-CRP 信号调节
在大肠杆菌中,CAP能够激活一百多个启动子的表达,同时对一些基因的转录起抑制作用[7]。CAP需要先与其变构调节因子cAMP形成复合物才能有效地结合到目标基因启动子区域的操纵序列上,因此CAP的全局信号调控取决于胞内的cAMP浓度。cAMP是由AC催化生成的,AC的活性又依赖于磷酸化的EIIAGlc(EIIAGlc-P)。除了调控碳分解代谢相关基因,CAP还直接参与调控许多其他胞内过程,如全局调控因子(FIS)的表达[8]、三羧酸循环(TCA)和呼吸作用[9-10]、渗透调节[11]、生物膜形成[12]、氮的同化[13]和小的非编码 RNAs(如 Spot42和 CyaR RNAs)[14]等。
当大肠杆菌以葡萄糖或其他PTS糖类为C源生长时,胞内PEP浓度较高且EIIAGlc大多以非磷酸化状态存在,降低培养基中葡萄糖浓度可以使EIIAGlc磷酸化程度提高,而EIIAGlc-P与AC的羧基区域结合并激活AC的酶活性[15-16]。AC的激活使得胞内 cAMP水平提高,cAMP与其受体蛋白(cAMP receptor protein,CRP)结合形成 cAMP-CRP复合物,并激活许多分解代谢相关的基因和操纵子(如乳糖、蜜二糖、甘油和麦芽糖等的分解代谢)。也就是说,优势C源存在降低了细胞内的cAMPCRP水平,使得次级C源的利用能力降低从而起到抑制作用。Inada 等[17]和 Deutscher等[18]认为cAMP-CRP介导的分解代谢基因的调控主要是在生长延迟期发挥作用,而后的CCR是由诱导物阻遏调节的。
1.2 诱导物阻遏
诱导物阻遏(inducer exclusion)是一种C源的代谢抑制另一种C源吸收利用的现象。在大肠杆菌中,PTSGlc中非磷酸化形式的EIIAGlc是导致诱导物阻遏作用的关键信号。以大肠杆菌lac操纵子的经典模型为例[16,19],当培养基中同时存在葡萄糖和乳糖2种C源时,葡萄糖被优先利用,此时,磷酸基团在PTSGlc蛋白间进行级联传递,PEP和EIIAGlc-P浓度都很低,而非磷酸化的EIIAGlc与乳糖透性酶LacY(乳糖:H+同向转运载体)结合使之失活,将导致胞外的乳糖无法转运进胞内,使得乳糖分解代谢基因(lac操纵子)表达所需的诱导剂(异乳糖)无法生成,进而抑制了乳糖的吸收和利用。当葡萄糖被耗尽只剩下乳糖为唯一C源时,EIIAGlc主要以磷酸化形式存在,对LacY的阻遏作用被解除,使乳糖能够被转运进入胞内。
有趣的是,Postma等[19]发现,当培养基中还存在与乳糖相同类型的C源时,EIIAGlc与LacY的相互作用会被加强,这说明或许还存在其他调控作用。此外,有研究调查了大肠杆菌全基因组并发现EIIAGlc与若干非PTSC源转运相关蛋白都存在共有序列[20],包括麦芽糖转运蛋白(MalFGK2)、乳糖渗透酶蛋白(LacY)、蜜二糖渗透蛋白(MelB)和蜜三糖渗透蛋白(RafB)等,这说明EIIAGlc可能通过诱导物阻遏作用影响更多C源的吸收和利用。
最终的CCR现象往往是由这2种机制共同作用的综合结果。乳糖的吸收受EIIAGlc-P抑制的同时,lac的启动子还受CAP的激活[18]。当葡萄糖吸收完全,EIIAGlc-P的抑制作用解除,且细胞内的CAP水平提高。乳糖对lac操纵子诱导作用得以恢复,这是诱导物阻遏作用的解除以及CAP使得lac操纵子转录水平加强两方面综合作用的结果[5]。
1.3 PEP/PYR比率的影响
大肠杆菌中,引起碳分解代谢抑制作用的主要因素是非磷酸化形式的EIIAGlc。依赖于PTS途径进行转运的碳水化合物的内质化过程会提高非磷酸化形式的EIIAGlc水平,但不是唯一因素。Hogema等[21]发现,大肠杆菌以非PTS糖类为C源时也会提高非磷酸化形式的EIIAGlc。以葡萄糖-6-磷酸为例,该糖的转运和第一步代谢反应不参与EIIAGlc的脱磷酸作用,糖酵解过程的后几步反应才是关键。他们对PEP和丙酮酸(pyruvate,PYR)进行了定量监测,发现它们与EIIAGlc蛋白磷酸化水平有直接关系,结果表明:当PEP/PYR比率降低时,EIIAGlc-P发生脱磷酸化作用,且这2个现象往往同时发生。因此,PEP/PYR的比率可能直接导致不同C源间的碳代谢抑制,反之该比率也受 C源新陈代谢的影响[22]。
1.4 DgsA(Mlc)转录调节因子
除了这2种以EIIAGlc磷酸化水平为信号的调控外,E.coli中还存在一些PTSGlcC源分解代谢基因的转录调控因子,这些转录调控因子包含有PTSGlc调节域。DgsA(或Mlc)被认为是一个转录水平的双重调节因子[23],它能调控自身 mlc基因、PTSGlc关键基因ptsHI、ptsG和manXYZ(编码甘露糖的 PTS转运,也能亲和转运若干其他己糖,如葡萄糖)[20,24-25]的表达。
Mlc的抑制作用和cAMP-CRP的激活作用直接与PTSGlc组分的磷酸化水平相关。C源底物对PTSGlc途径的激活导致EIIBCGlc和EIIAGlc主要为非磷酸化形式。此时EIIBCGlc与Mlc结合并将Mlc与其所结合的DNA隔离开,于是Mlc得以表达并能够抑制PTSGlc基因的表达,并降低葡萄糖的转运速率[26]。而后Nam等[26]给出了EIIBCGlc-Mlc复合体的晶体结构:Mlc四聚物与4个膜整合蛋白EIIBCGlc结合的复合体结构,从而进一步揭示了Mlc的作用机制。
大肠杆菌以葡萄糖或其他能被快速利用的PTSC源(如N-acetyglucosamine和甘露糖等)为底物生长时不受Mlc的抑制,非PTSC源(如乳糖、麦芽糖和蔗糖)也不受影响。而麦芽糖(非PTS糖)在一定程度上受Mlc抑制,这可能与细胞内葡萄糖和葡萄糖-1-磷酸的浓度有关[16,19,25]。除 CRP 外,基因mlc几乎不受其他因子的调控,Decker等[27]证实该调控过程为转录后调控。
2 CCR对E.coli混合C源利用的影响
大肠杆菌中调控CCR作用的若干途径组成了一个复杂的网络,其目的主要是:①从混合的生长介质中优先利用能够对自身快速代谢的C源;②根据细胞自身的代谢能力限制对于C源的吸收利用,避免负担过重和能源浪费。CCR是一个较复杂的调控过程,在不同的多C源组合中,大肠杆菌的C源利用顺序以及利用速率不同。总的来说是从2个角度进行调节:一是不激活次要C源的利用,二是抑制次要C源的利用。混合C源成分不同,C源的代谢顺序、CCR现象形成机制以及缓解CCR影响的方法都存在差异。不论是哪种或哪几种机制引起CCR作用,几乎都与PTS途径密切相关,因此针对不同的机制,对PTS进行定向改造可以有效地缓解CCR作用(表1)。
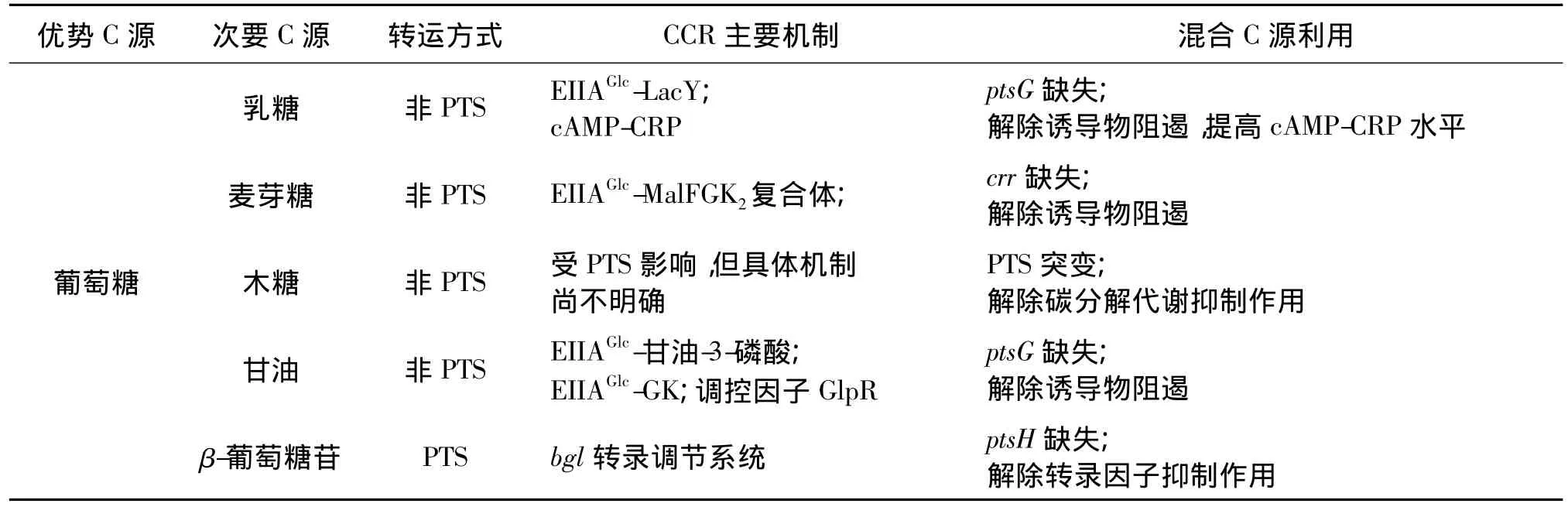
表1 大肠杆菌中常见混合C源分解代谢抑制特点及解除方法Table 1 Feature and remove method common of carbon mixture catabolite repression in Escherichia coli
2.1 葡萄糖和乳糖
葡萄糖对乳糖的诱导物阻遏作用是受非磷酸化的EIIAGlc激活的。LacY蛋白结合底物中的乳糖后发生某种构象的改变,才能与EIIAGlc发生随后的作用。这种只有在乳糖存在时才发生的EIIAGlc-LacY的条件性结合作用,实际上避免了当非PTS糖类不存在时对 PTS 组分的浪费[17]。Hogema 等[28]在通过添加外源的cAMP激活lac基因的表达来抵抗葡萄糖对乳糖的抑制作用,结果发现菌体的生长受到抑制,这说明大肠杆菌能够耐受一定程度上的lac调控,而CCR作用的排除反而有可能对生长带来不利。
在葡萄糖和乳糖混合物中,β-半乳糖苷酶的表达往往被抑制。Deutscher等[18]分别通过在培养基中添加异丙基-硫代β-半乳糖苷(IPTG)、缺失crr基因或过表达LacY的方法,均消除该抑制现象。一些结果还表明在大肠杆菌中,葡萄糖对乳糖利用的抑制作用更主要是受cAMP-CRP水平的影响。
2.2 葡萄糖和麦芽糖
大肠杆菌利用麦芽糖时需要malE编码的麦芽糖结合蛋白和多亚基的ABC转运蛋白MalFGK2[29-31],该蛋白是由可溶性的MalK亚基与透性酶的2个膜结合亚基MalF和MalG紧密结合而形成[32-33]。麦芽糖结合蛋白(maltose binding protein,MBP)携带麦芽糖与MalFGK2结合,MalK激活ATP水解提供能量并将麦芽糖转运到细胞内[34-36]。麦芽糖和葡萄糖共存时,非磷酸化的EIIAGlc结合到麦芽糖转运蛋白MalF和MalG亚基上阻碍麦芽糖进入胞质[37-39]。已有研究证明了EIIAGlc和目标蛋白结合位点的生物化学特性,Chen等[40]借助X线和晶体学知识首次给出了E.coli中EIIAGlc和麦芽糖转运蛋白复合体的晶体结构,是首次以蛋白质晶体结构揭示了CCR的机制。
2.3 葡萄糖和木糖
葡萄糖和木糖是木质纤维素水解液的主要成分。木糖有独立于葡萄糖的转运和分解代谢途径。通过大肠杆菌PTS途径的突变(ptsIHcrr/ptsG)能明显解除葡萄糖和木糖混合发酵时的二次生长现象。有研究将大肠杆菌PTS-Glc+突变菌株[41]培养于均为1 g/L的葡萄糖、阿拉伯糖和木糖混合C源中,结果葡萄糖和阿拉伯糖首先被同时消耗,而木糖的利用被抑制直至葡萄糖和阿拉伯糖耗尽[42]。
葡萄糖和木糖是木质纤维素水解液的主要成分,解除碳分解代谢抑制的大肠杆菌工程菌株可用于以木质纤维素水解液为原料生产乙醇、乳酸和琥珀酸等生物产品。
但是,大肠杆菌中葡萄糖与木糖间的代谢抑制机制尚不明确,目前葡萄糖和木糖高效共利用的很多研究仍以酵母菌为宿主。尽管微生物利用混合C源发酵的研究进展不断被报道,要想将木质纤维素原料更广泛地用于微生物的生产发酵还需要进一步努力。
2.4 葡萄糖和甘油
EIIAGlc与甘油激酶(glycerol kinase,GK)结合阻碍甘油-3-磷酸的产生,甘油-3-磷酸是甘油进入细胞和分解代谢基因表达的诱导剂[43]。而 Holtman等[43]研究认为,比起 EIIAGlc的阻遏作用,果糖-1,6-二磷酸(FBP)对甘油激酶的构象的影响才是引起葡萄糖对甘油代谢抑制作用的最主要因素。此外,一些调控因子(如GlpR)也在一定程度上参与了CCR 过程[44-46]。
2.5 葡萄糖和 β-葡萄糖苷
在大肠杆菌中,有许多PTS底物的分解代谢受转录调节因子调控。bgl感应系统调节β-葡萄糖苷的代谢抑制作用。该系统包括一个膜结合的糖感应器/透性酶和一个调控糖代谢基因表达的抗转录终止因子[47]。bgl操纵子包括 bglG、bglF和 bglB 3个基因;BglG是1个抗转录终止因子,其活性受BglF调控;BglF是催化β-葡萄糖苷磷酸化和内质化的PTS透性酶。当存在β-葡萄糖苷为唯一C源时,BglF将磷酸基团传递给β-葡萄糖苷并将其内质化,而HPr可以将部分磷酸基团传递给BglG使其处于激活状态,从而能够抗 bgl转录终止[15,48]。当葡萄糖和β-葡萄糖苷共存时,HPr将磷酸基团高效地传递给EIIAGlc以供葡萄糖的高效吸收,BglG处于非磷酸化状态(非激活状态),基因bgl的转录被提前终止而无法正常表达β-葡萄糖苷转运蛋白BglF,β-葡萄糖苷的吸收受到抑制。PTS途径中编码HPr的ptsH基因的缺失可以使葡萄糖和β-葡萄糖苷被共同利用。
3 混合C源共利用在工程大肠杆菌中的应用
生物质资源包括农作物、树木等植物及其残体、畜禽粪便和有机废弃物,其中纤维素类物质占其总量的80%以上。这些生物质的水解产物是若干单糖的混合物,包括葡萄糖、阿拉伯糖和木糖等。在利用生物质原料进行生物制造过程中面临一个非常重要的问题,即在葡萄糖内质化的过程中,除葡萄糖以外的C源代谢过程受到消除碳分解代谢抑制作用,共利用水解液中多种C源的方法将会在生物产品的生产中占有优势,既能缩短发酵时间又能提高目的产物的产率[3,49-51]。大肠杆菌含有许多糖转运及其代谢途径,具有利用多种C源的能力。为了使葡萄糖和木糖能够被共利用,同时利用混合糖进行生物制造,就需要对大肠杆菌的代谢途径进行工程改造。主要的方法[52]包括:①消除碳分解代谢抑制,②增强葡萄糖的转运能力,③增加戊糖磷酸途径的活性,④减少不必要的副产物途径对C源的浪费。
最早利用大肠杆菌生产乙醇的研究开始于引入外源的pdcZm和adhBZm[53]。Cordaro 等[54]用磷霉素筛选出不能转运PTS糖的突变菌株,并发现这些突变大多发生在ptsI基因。接下来在这些突变株中筛选出1株糖耗速率快且能共利用葡萄糖、阿拉伯糖和木糖(初始质量浓度均各30 g/L)的菌株进行发酵,结果表明与亲本菌株相比,乙醇产量提高了20%。而后ptsG缺陷型菌株被应用于混合C源发酵生产乙醇的研究中[55]。ptsG的缺失既解除了CCR作用,又能在很大程度上降低乙酸的积累,而且糖耗尽的时间仅为野生型的一半[56]。在该突变株中转入过表达pdcZm和adhBZm'的质粒,以LB培养基中添加各4 g/L的葡萄糖和木糖为发酵培养基得到的乙醇为35 g/L,比野生型提高了0.6%。随后有研究在PTS-Glc-菌株中用连续培养的方法筛选出PTS-Glc+突变株[41],发现当其生长于葡萄糖、阿拉伯糖和木糖各1 g/L的混合C源中时,不但糖耗速率加快,且发酵结束时发酵液中没有乙酸积累。Nichols等[55]构建了大肠杆菌工程菌株 FBR16(W3110ΔptsGΔpflΔfrdABCD,并在质粒上过表达来自运动发酵单胞菌的pdc和adhB基因),发现它能够从混合糖溶液中稳产乙醇。厌氧发酵70 h(质量分数 3.7% 葡萄糖、3.6% 木糖和 1.9% 阿拉伯糖),乙醇平均产量为(0.75 ±0.01)g/(L·h),产率为0.51 g/g。这些基因工程改造大肠杆菌能够共利用混合C源,使得以木质纤维素水解液为原料生产乙醇成为可能。
L-乳酸是许多工业应用中的化学前体[57],可以通过在缺失大肠杆菌丙酮酸甲酸裂解酶(PFL)和乳酸脱氢酶(LDH)编码基因的双基因突变菌株中转入来自牛链球菌的乳酸脱氢酶基因来生产。为了同时利用多种C源生产乳酸,在该工程菌中进一步敲除了ptsG基因。各以50 g/L的葡萄糖和木糖混合C源最终发酵得到乳酸产率为0.77 g/g,相比野生型提高了 60%[58]。随后 Eiteman 等[59]在发酵培养基中同时接入2种菌株E.coli ALS1073(pflB glk ptsG manZ)(只利用木糖)和 E.coli ALS1074(pflB xylA)(只利用葡萄糖)以同时利用葡萄糖和木糖来生产乳酸。与以往的方法不同,这个策略虽然没有从遗传改造角度解除CCR作用,但完全避免了同一细胞不同C源间的分解代谢抑制作用对双C源共利用的影响。
为了高效共发酵混合C源生产聚羟基脂肪酸酯(PHA),Li等[60]构建了解除 CCR 作用的 PTS 突变型大肠杆菌菌株。E.coli LR1010(引入phaCRe和 phaABRe基因)能够共利用葡萄糖和木糖并积累短链PHA,而E.coli LR1120(引入 phaC1 基因)和 LR1110(PTS-,并引入phaC1基因)则能积累中长链PHA,LR1110还能共利用葡萄糖和脂肪酸。半定量逆转录聚合酶链式反应(semi-quantitative reversetranscriptase-polymerase chain reaction,semi RT-PCR)结果表明,PTS途径的改造解除了对fad基因的抑制作用。
琥珀酸被认为是一种关键的平台化学制剂,具有许多工业用途。以野生型大肠杆菌为发酵菌株时存在明显的碳代谢抑制现象,不利于混合C源的高效利用以积累琥珀酸。Wang等[61]首次以玉米秸秆水解液为原料利用代谢工程E.coli生产琥珀酸,在野生型大肠杆菌W1485中敲除了ptsG、ldhA和pflB,并转入过表达磷酸烯醇式丙酮酸羧化酶基因(ppc)的质粒,最终得到了SD121菌株。以玉米秸秆水解液为底物(初始糖质量浓度为44 g/L),以SD121为发酵菌株,在3 L厌氧发酵罐里发酵84 h,琥珀酸最终产量为36.55 g/L,产率为0.83 g/g(以混合糖计)。在有氧-厌氧双阶段发酵中,琥珀酸最终产量为 57.81 g/L,产率为 0.87 g/g糖混合物。比起模式化的混合C源,利用玉米秸秆水解液得到了更高的琥珀酸产量。这也说明以可再生生物质水解液为原料生产琥珀酸具有很好的应用前景。
目前,利用代谢工程改造大肠杆菌以混合C源为底物进行生物制造的方法正在日趋成熟,除了上述几种产物,氨基酸和木糖醇等产品也可以通过类似的方法得以高效积累。随着基因工程和发酵技术的发展,利用大肠杆菌工程菌株生产化学产品的效率逐渐提高。虽然木质纤维素水解液目前不一定是积累某一代谢产物的最佳原料,但却是一种通过生物学手段使可再生生物质资源得以再循环的有效方法,有着重要的研究意义。
4 展望
近年来,大肠杆菌在混合双C源中的代谢抑制机制日渐明晰,对双C源高效共利用的方法也趋于成熟,但是2种以上C源同时存在时,大肠杆菌对C源的层级利用顺序还没有一个系统的研究。或许将来可以将不同双C源共利用的手段联合起来,以应用于更多C源混合物的共利用中。从现有的许多研究进展中看到,为了解除CCR作用,对菌株进行改造是一个有效的方法,而获得1个PTS-Glc+突变型菌株是关键。目前,主要有3种方法:①对PTS-菌株在连续培养基中进行适应性筛选,筛选培养出既能高效吸收葡萄糖又能同时利用其他C源的菌株;②在PTS-菌株中将非PTS途径的GalP原启动子替换成强启动子,或直接将大肠杆菌的galP和glk替换成能高效表达的来自Z.mobilis的同源基因;③在三重突变株(mgsA pgi ptsG)中过表达crp,从cAMP-CRP水平和诱导物阻遏2个方面的解除CCR作用。或许可以将不同双C源共利用的手段联合起来,应用于更多C源混合物的共利用中。随着研究者对参与碳分解代谢过程和特定生物合成途径相关基因的转录组学特性的逐步揭示及其在遗传改造中的应用,对于CCR与PTS相互关系的认识逐渐全面和深入。然而,为了扩大对细胞内过程更全方面的认识,今后还需要对这些改造菌株的蛋白质组学、代谢组学等特性进行更深入的分析和探究。
[1] Gosset G.Improvement of Escherichia coli production strains by modification of the phosphoenolpyruvate:sugar phosphotransferase system[J].Microb Cell Fact,2005,4(1):14.doi:10.1186/1475-2859-4-14.
[2] Ferenci T.Hungry bacteria:definition and propertiesofa nutritional state[J].Environ Microbiol,2001,3(10):605-611.
[3] Gosset G.Production of aromatic compounds in bacteria[J].Curr Opin Biotechnol,2009,20(6):651-658.
[4] Saier M H,Jr T M Ramseier,Reizer J.Regulation ofcarbon utilization[C]∥Neidhardt F C,Curtiss III R,Ingraham J L,et al.Escherichia coliand Salmonella:cellularand molecular biology.Washington:ASM Press,1996:1325-1343.
[5] Brückner R,TitgemeyerF.Carbon catabolite repression in bacteria:choice ofthe carbon source and autoregulatory limitation of sugar utilization[J].FEMS Microbiol Lett,2002,209(2):141-148.
[6] Busby S,Ebright R H.Transcription activation by catabolite activator protein(CAP)[J].J Mol Biol,1999,293(2):199-213.
[7] Nasser W,Schneider R,Travers A,et al.CRP modulates fis transcription by alternate formation of activating and repressing nucleoprotein complexes[J].J Biol Chem,2001,276(21):17878-17886.
[8] Gama-Castro S,Salgado H,Peralta-Gil M,et al.RegulonDB version 7.0:transcriptional regulation of Escherichia coli K-12 integrated within genetic sensory response units(Gensor Units)[J].Nucleic Acids Res,2011,39(1):D98-D105.
[9] Keseler I M,Collado-Vides J,Santos-Zavaleta A,et al.EcoCyc:a comprehensive database of Escherichia coli biology[J].Nucleic Acids Res,2011,39(1):D583-D590.
[10] Landis L,Xu J,Johnson R C.The cAMP receptor protein CRP can function as an osmoregulator of transcription in Escherichia coli[J].Genes Dev,1999,13(23):3081-3091.
[11] Jackson D W,Simecka J W,Romeo T.Catabolite repression ofEscherichia coli biofilm formation[J].J Bacteriol,2002,184(12):3406-3410.
[12] Mao X J,Huo Y X,Buck M,et al.Interplay between CRP-cAMP and PII-Ntr systems forms novel regulatory network between carbon metabolism and nitrogen assimilation in Escherichia coli[J].Nucleic Acids Res,2007,35(5):1432-1440.
[13] De Lay N,Gottesman S.The Crp-activated small noncoding regulatory RNA CyaR(RyeE)links nutritional status to group behavior[J].J Bacteriol,2009,191(2):461-476.
[14] Park Y H,Lee B R,Seok Y J,et al.In vitro reconstitution of catabolite repression in Escherichia coli[J].J Biol Chem,2006,281(10):6448-6454.
[15] Görke B,Stülke J.Carbon catabolite repression in bacteria:many ways to make the most out of nutrients[J].Nat Rev Microbiol,2008,6(8):613-624.
[16] Deutscher J.The mechanisms of carbon catabolite repression in bacteria[J].Curr Opin Microbiol,2008,11(2):87-93.
[17] Inada T,Kimata K,Aiba H.Mechanism responsible for glucoselactose diauxie in Escherichia coli:challenge to the cAMP model[J].Genes Cells,1996,1(3):293-301.
[18] Deutscher J,Francke C,Postma P W.How phosphotransferase system-related protein phosphorylation regulatescarbohydrate metabolism in bacteria[J].Microbiol Mol Biol Rev,2006,70(4):939-1031.
[19] Postma P W,Lengeler J W,Jacobson G R.Phosphoenolpyruvate:carbohydrate phosphotransferase systems ofbacteria[J].Microbiol Mol Biol Rev,1993,57(3):543-594.
[20] Plumbridge J.Regulation of gene expression in the PTS in Escherichia coli:the role and interactions of Mlc[J].Curr Opin Microbiol,2002,5(2):187-193.
[21] Hogema B M,ArentsJ C,Bader R,et al.Inducer exclusion in Escherichia coli by non-PTS substrates:the role of the PEP to pyruvate ratio in determining the phosphorylation state of enzyme IIAGlc[J].Mol Microbiol,1998,30(3):487-498.
[22] Escalante A,Cervantes A S,Gosset G,et al.Current knowledge of the Escherichia coli phosphoenolpyruvate-carbohydrate phospho transferase system:peculiarities of regulation and impact on growth and product formation[J].Appl Microbiol Biotechnol,2012,94(6):1483-1494.
[23] Kimata K,Inada T,Tagami H,et al.A global repressor(Mlc)is involved in glucose induction of the ptsG gene encoding major glucose transporter in Escherichia coli[J].Mol Microbiol,1998,29(6):1509-1519.
[24] Plumbridge J.DNA binding sites for the Mlc and NagC proteins:regulation of nagE,encoding the N-acetylglucosamine-specific transporter in Escherichia coli[J].Nucleic Acids Res,2001,29(2):506-514.
[25] Nam T W,Cho S H,Shin D,et al.The Escherichia coli glucose transporter enzyme IICBGlcrecruits the global repressor Mlc[J].EMBO J,2001,20(3):491-498.
[26] Nam T W,Jung H I,An Y J,et al.Analyses of Mlc-IIBGlcinteraction and a plausible molecularmechanism ofMlc inactivation by membrane sequestration[J].PNAS,2008,105(10):3751-3756.
[27] DeckerK,Plumbridge J,BoosW.Negative transcriptional regulation of a positive regulator:the expression of malT,encoding the transcriptional activator of the maltose regulon of Escherichia coli,is negatively controlled by Mlc[J].Mol Microbiol,1998,27(2):381-390.
[28] Hogema B M,Arents J C,Bader R,et al.Autoregulation of lactose uptake through the LacY permease by enzyme IIAGlcof the PTS in Escherichia coliK-12[J].MolMicrobiol,1999,31(6):1825-1833.
[29] Kimata K,Takahashi H,Inada T,et al.cAMP receptor proteincAMP plays a crucial role in glucose-lactose diauxie by activating the major glucose transporter gene in Escherichia coli[J].PNAS,1997,94(24):12914-12919.
[30] Boos W,Shuman H.Maltose/maltodextrin system of Escherichia coli:transport,metabolism,and regulation[J].Microbiol Mol Biol Rev,1998,62(1):204-229.
[31] Fetsch E E,Davidson A L.Maltose transport through the inner membrane of E.coli[J].Front Biosci,2003,8:d652-d660.
[32] LandmesserH,Stein A,Blüschke B, etal.Large-scale purification,dissociation and functional reassembly of the maltose ATP-binding cassette transporter(MalFGK2)of Salmonella typhimurium[J].Biochim Biophys Acta,2002,1565(1):64-72.
[33] Hunke S,Mourez M,Jéhanno M,et al.ATP modulates subunitsubunit interactions in an ATP-binding cassette transporter(MalFGK2)determined by site-directed chemical cross-linking[J].J Biol Chem,2000,275(20):15526-15534.
[34] Mourez M,Hofnung M,Dassa E.Subunit interactions in ABC transporters:a conserved sequence in hydrophobic membrane proteins of periplasmic permeases defines an important site of interaction with the ATPase subunits[J].EMBO J,1997,16(11):3066-3077.
[35] Chen J,Sharma S,Quiocho F A,et al.Trapping the transition state of an ATP-binding cassette transporter:evidence for a concerted mechanism of maltose transport[J].PNAS,2001,98(4):1525-1530.
[36] Diederichs K,Diez J,Greller G,et al.Crystal structure of MalK,the ATPase subunit of the trehalose/maltose ABC transporter of the archaeon Thermococcus litoralis[J].EMBO J,2000,19(22):5951-5961.
[37] Joly N,Böhm A,Boos W,et al.MalK,the ATP-binding cassette component of the Escherichia coli maltodextrin transporter,inhibits the transcriptional activator MalT by antagonizing inducer binding[J].J Biol Chem,2004,279(32):33123-33130.
[38] Böhm A,Diez J,Diederichs K,et al.Structural model of MalK,the ABC subunit of the maltose transporter of Escherichia coli implications for mal gene regulation,inducer exclusion,and subunit assembly[J].J Biol Chem,2002,277(5):3708-3717.
[39] Dean D A,Reizer J,Nikaido H,et al.Regulation of the maltose transport system of Escherichia coli by the glucose-specific enzyme III of the phosphoenolpyruvate-sugar phosphotransferase system:characterization ofinducer exclusion-resistantmutants and reconstitution of inducer exclusion in proteoliposomes[J].J Biol Chem,1990,265(34):21005-21010.
[40] Chen S,Oldham M L,Davidson A L,et al.Carbon catabolite repression of the maltose transporter revealed by X-ray crystallography[J].Nature,2013,499:364-368.
[41] Hernández-Montalvo V,Valle F,Bolivar F,et al.Characterization of sugar mixtures utilization by an Escherichia coli mutant devoid of the phosphotransferase system[J].Appl Microbiol Biotechnol,2001,57(1/2):186-191.
[42] Jojima T,Omumasaba C A,Inui M,et al.Sugar transporters in efficient utilization of mixed sugar substrates:current knowledge and outlook[J].Appl Microbiol Biotechnol,2010,85(3):471-480.
[43] Holtman C K,Pawlyk A C,Meadow N D,et al.Reverse genetics of Escherichia coli glycerol kinase allosteric regulation and glucose control of glycerol utilization in vivo[J].J Bacteriol,2001,183(11):3336-3344.
[44] Lin E C C.Glycerol dissimilation and its regulation in bacteria[J].Ann Rev Microbiol,1976,30(1):535-578.
[45] Larson T J,Ye S Z,Weissenborn D L,et al.Purification and characterization of the repressor for the sn-glycerol 3-phosphate regulon of Escherichia coli K12[J].J Biol Chem,1987,262(33):15869-15874.
[46] Weissenborn D L,Wittekindt N,Larson T J.Structure and regulation of the glpFK operon encoding glycerol diffusion facilitator and glycerol kinase of Escherichia coli K-12[J].J Biol Chem,1992,267(9):6122-6131.
[47] Amster-Choder O.The bgl sensory system:a transmembrane signaling pathway controlling transcriptional antitermination[J].Curr Opin Microbiol,2005,8(2):127-134.
[48] Görke B,Rak B.Catabolite control of Escherichia coli regulatory protein BglG activity by antagonistically acting phosphorylations[J].EMBO J,1999,18(12):3370-3379.
[49] Chiang C J,Lee H M,Guo H J,et al.Systematic approach to engineer Escherichia coli pathways for co-utilization of a glucosexylose mixture[J].J Agric Food Chem,2013,61(31):7583-7590.
[50] Malherbe S, Cloete T E.Lignocellulose biodegradation:fundamentals and applications[J].Rev Environ Sci Biotechnol,2002,1(2):105-114.
[51] Keasling J D.Manufacturing molecules through metabolic engineering[J].Science,2010,330:1355-1358.
[52] Yao R,Hirose Y,Sarkar D,et al.Catabolic regulation analysis of Escherichia coli and its crp,mlc,mgsA,pgi and ptsG mutants[J].Microb Cell Fact,2011,10:67.doi:10.1186/1475-2859-10-67.
[53] Lindsay S E,Bothast R J,Ingram L O.Improved strains of recombinant Escherichia coli for ethanol production from sugar mixtures[J].Appl Microbiol Biotechnol,1995,43(1):70-75.
[54] Cordaro J C,Melton T,Stratis J P,et al.Fosfomycin resistance:selection method for internal and extended deletions of the phosphoenolpyruvate:sugar phosphotransferase genes of Salmonella typhimurium[J].J Bacteriol,1976,128(3):785-793.
[55] Nichols N N,Dien B S,Bothast R J.Use of catabolite repression mutants for fermentation of sugar mixtures to ethanol[J].Appl Microbiol Biotechnol,2001,56(1/2):120-125.
[56] Kang Z,Geng Y,Kang J,et al.Engineering Escherichia coli for an efficient aerobic fermentation platform[J].J Biotechnol,2009,144(1):58-63.
[57] Jarvis L.Lactic acid outlook up aspolylactide nears market[J].Chem Market Rep,2001,259(9):5-14.
[58] Dien B S,Nichols N N,Bothast R J.Fermentation of sugar mixturesusingEscherichia colicatabolite repression mutants engineered for production of L-lactic acid[J].J Ind Microbiol Biotechnol,2002,29(5):221-227.
[59] Eiteman M A,Lee S A,Altman R,et al.A substrate-selective cofermentation strategy with Escherichia coli produces lactate by simultaneously consuming xylose and glucose[J].Biotechnol Bioeng,2009,102(3):822-827.
[60] Li R,Chen Q,Wang P G,et al.A novel-designed Escherichia coli forthe production of various polyhydroxyalkanoates from inexpensive substrate mixture[J].Appl Microbiol Biotechnol,2007,75(5):1103-1109.
[61] Wang D,Li Q,Yang M,et al.Efficient production of succinic acid from corn stalk hydrolysates by a recombinant Escherichia coli with ptsG mutation[J].Process Biochem,2011,46(1):365-371.

