罗格列酮联合阿米洛利治疗对老年SD大鼠心脏结构及功能的影响
王晓华,胡惠民,马 强,敖强国,程庆砾*
(1解放军总医院南楼临床部肾脏病科,北京 100853;2第二军医大学长征医院肾脏病研究所,上海 200003)
老年人随着心、肾功能减退,容易出现水钠潴留,从而使体质量显著增加,心脏容量负荷加重,出现心肌肥厚、心腔增大等表现。2007年N Eng1 J Med上的一份研究报告指出,用于治疗2型糖尿病的药物罗格列酮(rosiglitazone)具有潜在的安全性问题,长期使用可大幅增加心脏病风险[1]。本研究通过使用罗格列酮长期干预SD大鼠,观察到老龄大鼠体质量显著增加,心脏存在心肌肥厚、心腔增大、淤血表现,左室后壁厚度(left ventricular posterior wall thickness,LVPWT)、室间隔厚度(interventricular septal thickness,IVST)异常,提示心脏负荷增加。而加入保钾利尿剂阿米洛利(amiloride)的联合治疗组体质量与对照组相近,且心脏毒副作用较单用罗格列酮组有明显缓解。为进一步观察罗格列酮致心脏副作用的情况,证实该联合用药对罗格列酮心脏副作用的缓解及验证该联合用药的安全性,本研究旨在通过选取无肾脏病基础动物模型探索罗格列酮联合阿米洛利治疗的安全性,指导临床治疗。
1 材料与方法
1.1 材料
雄性Sprague-Dawley(SD)大鼠购自中科院动物实验中心。SPF级动物由第二军医大学动物实验中心提供。马来酸罗格列酮、盐酸阿米洛利由常州善美药物研究开发中心有限公司馈赠,羧甲纤维素(CMC-Na)粉末购自中国医药集团上海生化试剂公司。仪器包括全自动生化分析仪(日立7080,日本),高速台式冷冻离心机(BECKMAN GS-15R),电热恒温烘箱(上海跃进医疗器械厂),病理切片机(德国Leica,RM-2135),超声显像仪(Vevo 770TM-230,复旦大学生物医学研究院提供)。
1.2 方法
1.2.1 动物实验分组 40只雄性SD大鼠随机分为对照组、罗格列酮治疗组[10mg/(kg·d)]、阿米洛利治疗组[5mg/(kg·d)]及罗格列酮联合阿米洛利治疗组[罗格列酮10mg/(kg·d),阿米洛利5mg/(kg·d)]共4组,每组10只。从第3周断乳后开始灌胃给药,给药时间6个月,治疗组药物(混悬于1% CMC-Na)灌胃,对照组给予1% CMC-Na灌胃,自由进水进食,每周测量记录体质量。
1.2.2 生理生化指标监测 每周记录体质量,每月眶后取血2ml,常温下静置30min,后以4500r/min的速度离心15min,留取血清作肝肾功、血糖、血脂、电解质等相关生化分析。代谢笼收集尿液(禁食,自由进水,收集24h尿液),记录尿量,尿液标本经过3000r/min离心10min后留取上清,作尿蛋白定量等尿生化分析。
1.2.3 心脏超声检测 于实验第6个月进行经胸高频超声心动图检查。使用Vevo770TM-230超声显像仪,经胸壁高频超声10S探头,频率11.4 MHz,图像深度2.0cm。10%水合氯醛0.33ml/100g腹腔注射麻醉大鼠,备皮。在二维超声引导下,M型超声测定胸骨旁左心长轴切面左室腱索水平左室后壁收缩期厚度(left ventricular posterior wall thickness systolic,LVPWTs)和舒张期厚度(left ventricular posterior wall thickness diastolic,LVPWTd),室间隔收缩期厚度(interventricular septal thickness systolic,IVSTs)和舒张期厚度(interventricular septal thickness diastolic,IVSTd)以及左室射血分数(left ventricular ejection fraction,LVEF)。Teichholtz公式法计算左室短轴缩短率(left ventricular fractional shortening,LVFS),每一测定值均取3个连续完整心动周期测量的平均值。
1.2.4 组织学分析 第6个月时将实验动物处死后,取心、肾、肝称重(g),计算心、肝及肾指数,脏器指数指内脏器官质量(g)与体质量(g)的比值。并取材固定作苏木精-伊红(hematoxylin-eosin,HE)染色、碘酸雪夫(periodic acid-Schiff,PAS)染色及Masson染色。方法及指标同第一部分。
1.3 统计学处理
2 结 果
2.1 体质量及血生化变化
在干预的6个月罗格列酮治疗组大鼠体质量明显增加,与对照组比较,差异有统计学意义(P<0.05)。罗格列酮联合阿米洛利治疗组与对照组比较,差异无统计学意义(P>0.05)。各治疗组与对照组SD大鼠比较,生理生化指标中血糖、血脂,血清肌酐、尿素氮水平差异均无统计学意义(P>0.05)。罗格列酮组出现明显血钠偏高,与对照组有明显差异(P<0.05),联合用药组血钠水平介于罗格列酮组与对照组之间,阿米洛利组血钠较低,各治疗组血钾、血钙差异无统计学意义(P>0.05;表1)。
2.2 心脏超声检查
与对照组相比,罗格列酮组大鼠的LVPWT,IVST均有明显增加(P<0.05)。而LVEF和LVFS并未出现明显变化(表2)。
表1 6个月各组大鼠体质量及血生化指标变化Table 1 Comparison of body mass and biochemical indices among four groups in six months(n=10,±s)
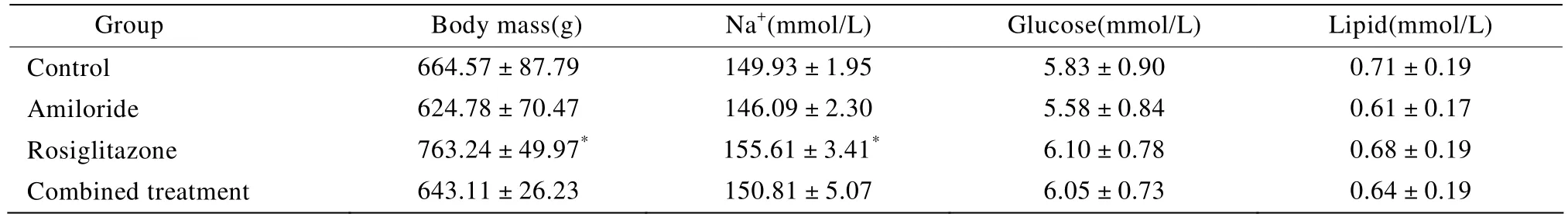
表1 6个月各组大鼠体质量及血生化指标变化Table 1 Comparison of body mass and biochemical indices among four groups in six months(n=10,±s)
Compared with control group,*P<0.05
Group Body mass(g)Na+(mmol/L)Glucose(mmol/L)Lipid(mmol/L)Control 664.57±87.79 149.93±1.95 5.83±0.90 0.71±0.19 Amiloride 624.78±70.47 146.09±2.30 5.58±0.84 0.61±0.17 Rosiglitazone 763.24±49.97* 155.61±3.41* 6.10±0.78 0.68±0.19 Combined treatment 643.11±26.23 150.81±5.07 6.05±0.73 0.64±0.19
表2 各组超声心动图检测结果Table 2 Results of ultrasound cardiogram in four groups(n=10,%,±s)
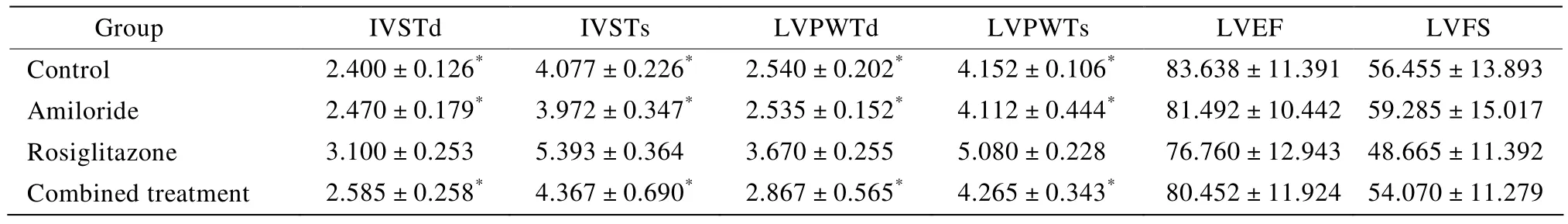
表2 各组超声心动图检测结果Table 2 Results of ultrasound cardiogram in four groups(n=10,%,±s)
IVSTd:interventricular septal thickness diastolic;IVSTs:interventricular septal thickness systolic;LVPWTd:left ventricular posterior wall diastolic;LVPWTs:left ventricular posterior wall thickness systolic;LVEF:left ventricular ejection fraction;LVFS:left ventricular fractional shortening.Compared with rosiglitazone group,*P<0.05
Group IVSTd IVSTs LVPWTd LVPWTs LVEF LVFS Control 2.400±0.126* 4.077±0.226* 2.540±0.202* 4.152±0.106* 83.638±11.391 56.455±13.893 Amiloride 2.470±0.179* 3.972±0.347* 2.535±0.152* 4.112±0.444* 81.492±10.442 59.285±15.017 Rosiglitazone 3.100±0.253 5.393±0.364 3.670±0.255 5.080±0.228 76.760±12.943 48.665±11.392 Combined treatment 2.585±0.258* 4.367±0.690* 2.867±0.565* 4.265±0.343* 80.452±11.924 54.070±11.279
2.3 组织学分析
经过6个月的药物干预,罗格列酮治疗组与对照组相比,心脏质量/体质量明显增加(P<0.05),联合治疗组心脏质量/体质量相对罗格列酮组有所下降,差异有统计学意义(P<0.05)。而肝脏质量/体质量和肾脏质量/体质量各组之间差异无统计学意义(P>0.05;表3)。
表3 各组大鼠脏器指数结果Table 3 Organ indices in four groups(n=10,±s)
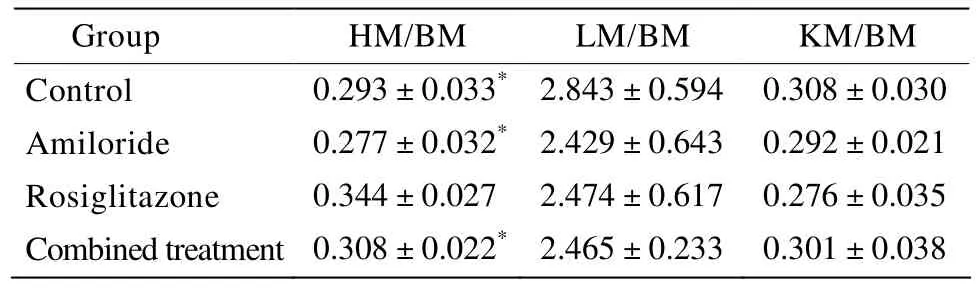
表3 各组大鼠脏器指数结果Table 3 Organ indices in four groups(n=10,±s)
HM:heart mass;BM:body mass;LM:liver mass;KM:kidney mass.Compared with rosiglitazone group,*P<0.05
Group HM/BM LM/BM KM/BM Control 0.293±0.033* 2.843±0.594 0.308±0.030 Amiloride 0.277±0.032* 2.429±0.643 0.292±0.021 Rosiglitazone 0.344±0.027 2.474±0.617 0.276±0.035 Combined treatment 0.308±0.022* 2.465±0.233 0.301±0.038
HE染色结果显示,罗格列酮组心肌组织有受损表现,心肌细胞出现水肿和空泡变性,受累较重的心肌细胞还可呈小灶状或片状坏死,部分肌原纤维溶解,心肌纤维断裂,部分增粗,心肌细胞间隙明显增宽;对照组肌纤维排列整齐,无心肌纤维的破坏,细胞质丰富均匀,可见横纹,细胞间隙正常,而联合用药组心肌纤维排列整齐,细胞间隙正常,基本逆转其病理损害(图1)。表明罗格列酮有使心肌增厚,心脏增大等作用,阿米洛利能较好抑制这一副作用。
3 讨 论
美国克利夫兰诊所的心脏科专家Nissen博士和统计学家Wolski[1]所做的一个荟萃分析中发现,罗格列酮具有潜在的安全性问题,可能大幅增加心脏病风险,导致死亡率增加。他们搜集了美国FDA官方网站和葛兰素史克公司(Glaxo-Smith Kline,GSK)的相关临床研究文献共116篇,对符合入选标准(研究时间>24周;随机的对照组未使用罗格列酮;结果包含心肌梗死和心因性死亡发生率的数据)的42项临床试验分析后显示,与对照组(12 283例)相比,罗格列酮治疗组(15 560例)患者在心肌梗死和心血管原因死亡上的优势比分别是1.43(95%CI 1.03~1.98,P=0.03)和1.64(95%CI 0.98~2.74,P=-0.06),从而得出罗格列酮会增加心肌梗死和心因性死亡风险的结论。作者同时坦言,该研究的局限在于缺乏原始资料数据而不能进行结局发生时间的分析,但患者和医师仍应考虑2型糖尿病患者使用罗格列酮所要承受的严重不良心血管事件的潜在风险。
罗格列酮作为传统的过氧化物酶体增殖物激活受体γ(peroxysome proliferator-activated receptor γ,PPARγ)激动剂,除了传统的代谢调节作用外,同时具有改善高血压血管对胰岛素的敏感性[2],还能通过抑制细胞增殖、诱导凋亡、细胞周期阻滞、诱导分化、抑制多种前炎症因子基因的表达和细胞外基质形成而发挥抗肿瘤、抗炎和抗纤维化等作用[3]。有很多研究表明,在多种恶性肿瘤组织和很多肾病模型中PPARγ都是高表达的,而使用PPARγ激动剂能够发挥有益作用。有相关研究观察到噻唑烷二酮类PPARγ激动剂罗格列酮可有效延缓常染色体显性多囊肾病动物模型雄性Han-SPRD杂合子大鼠肾功能进展速度,减小肾囊肿,但是存在体液潴留,心脏增大,心功能受限等心脏不良影响[4-6]。本研究选取无肾脏病基础但其他生物习性与Han-SPRD大鼠相似的正常SD大鼠动物模型进行同等剂量的干预治疗,观察是否仍存在心脏副作用。结果显示,罗格列酮致心脏增大、心肌肥厚、心功能下降的心脏副作用与是否具有糖尿病或肾脏病等基础疾病基本不相关,在正常的动物模型中也可导致。钠氢交换器(Na+/H+exchanger,NHE)抑制剂阿米洛利主要抑制肾脏远端小管和集合管的Na+-K+和Na+-H+交换,从而使Na+和水排出增多,不仅是临床上良好的保钾利尿剂,对心肌细胞具有显著的保护作用[7-9]。NHE抑制剂通过抑制心肌细胞内Na+浓度升高,从而防止由Na+/Ca2+交换引起的心肌细胞内Ca2+超载,在缺血和再灌注时可防止心肌细胞损伤、坏死和凋亡。目前研究表明,NHE抑制剂对心肌细胞损伤的保护作用主要表现为:(1)减少心肌梗死范围;(2)改善再灌注后的心功能;(3)减少心肌缺血和再灌注时期心律失常的发生率;(4)维持心肌细胞内外电解质的平衡;(5)减少心肌细胞凋亡;(6)保存心肌细胞能量[4]。基于阿米洛利良好的利尿消除水肿的效果及对心肌的保护作用,本研究使用阿米洛利抑制罗格列酮的副作用,观察到联合治疗组大鼠心肌肥厚情况较罗格列酮组有明显缓解,体质量及心脏指数较对照组无明显差异,血钠及尿钠水平介于对照组与罗格列酮组之间,心脏超声检查室壁增厚较罗格列酮组有明显降低,心脏活动良好。因此,我们认为,阿米洛利对应用罗格列酮的SD大鼠具有心脏保护作用,一定程度上抑制了其心脏负荷的增加。其联合罗格列酮治疗可有效缓解后者的心脏副作用,长期应用安全有效。
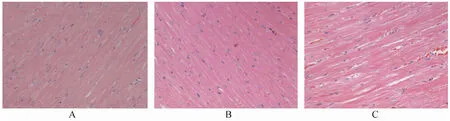
图1 给药6个月SD大鼠心肌组织病理学Figure 1 Histopathological changes of cardiac muscle of SD rats after six months(HE ×400)
【参考文献】
[1]Nissen SE,Wolski K.Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes[J].N Engl J Med,2007,356(24):2457-2471.
[2]Li R,Gao F,Huang C,et al.Rosiglitazone improves insulin sensitivity in spontaneously hypertensive-rats[J].Chin J Mult Organ Dis Elderly,2008,7(3):211-214.[李 榕,高 峰,黄 晨,等.罗格列酮改善高血压大鼠血管对胰岛素的反应性[J].中华老年多器官疾病杂志,2008,7(3):211-214.]
[3]Liu JQ,Mei CL,Xiong XS,et al.Experimental study on effects of eGFR tyrosine kinase inhibitor on PPARγ in autosomal dominant polycystic kidney disease[J].Chin J Integr Tradit West Nephrol,2011,12(1):12-15.[刘洁琼,梅长林,熊锡山,等.酪氨酸激酶抑制剂对多囊肾病PPARγ的影响研究[J].中国中西医结合肾病杂志,2011,12(1):12-15.]
[4]Xiong XS,Wang L,Ye YL,et al.Pyrimidinylarylpropionic acid derivatives:viable resources in the development of new antineoplastic agents[J].Invest New Drugs,2010,28(4):472-481.
[5]Xiong X,Zhang Y,Gao,et al.B5,a novel pyrrole-substituted indolinone,exerts potent antitumor efficacy through G2/M cell cycle arrest[J].Invest New Drugs,2010,28(1):26-34.
[6]Zhang T,Wang L,Xiong X,et al.Mycophenolate mofetilversusRapamycin in Han:SPRD rats with polycystic kidney disease[J].Biol Res,2009,42(4):437-444.
[7]Schmidt TA,Kjeldsen K.Human myocardial Na,K-ATPase- quantification,regulation and relation to Ca[J].Cardiovasc Res,1998,37(2):335-345.
[8]Inoue K,Kawahito Y,Tsubouchi Y,et al.Expression of peroxisome proliferator-activated receptor gamma in renal cell carcinoma and growth inhibition by its agonists[J].Biochem Biophys Res Commun,2001,287(3):727-732.
[9]Hu RY,Shao HT,Dong GH,et al.Protective effects of 5-N-ethyl-N-isopropyl-amiloride on ischemia-reperfused myocardium of old rats[J].J Pract Med,2007,23(1):40-43.[胡若愚,邵宏涛,董国华,等.阿米洛利同系物对老龄大鼠心肌缺血再灌注损伤的保护作用[J].实用医学杂志,2007,23(1):40-43.]

