足细胞特异性因子nephrin及肿瘤蛋白-1在肾小球硬化过程中表达变化
保 莉,田大成,郑亚莉
(宁夏人民医院肾内科,银川 750001)
在肾小球硬化(glomerulosclerosis,GS)进展的过程中,足细胞的减少是反映肾小球损伤程度的预测及观测指标。足细胞特异性分子nephrin及肿瘤蛋白-1(Wilms’ tumor-1,WT-1)的表达变化均会影响足细胞的结构和功能,导致足突融合,足细胞脱落,进而发生GS[1-4]。
为了系统地观察足细胞损伤在GS发展过程中的重要作用,本研究使用的嘌罗霉素氨基核苷(puromycin aminonucleoside,PAN)肾炎模型,通过观察其临床指标、病理形态及nephrin和WT-1的表达在GS过程中的改变,探讨足细胞损伤在GS过程中的作用。
1 材料与方法
1.1 材料
雄性SD大鼠(宁夏医科大学动物实验中心),体质量200~220g,随机分为对照组与PAN组,PAN组大鼠尾静脉注射PAN(15mg/kg,Sigma公司,美国),尿蛋白阳性即为造模成功。对照组同法注射等量生理盐水。分别于第4,8天和4,14,20周测定大鼠收缩压、血脂、血肌酐、血浆白蛋白、24h尿蛋白定量等指标,并于上述时间点处死大鼠,取其肾脏,石蜡包埋,切片。
1.2 过碘酸雪夫染色、肾小球硬化指数及肾小球面积的测定
切片行常规过碘酸雪夫(periodic acid-Schiff,PAS)染色,对每个肾小球进行半定量评分(0~4分)[5],标准如下:0分为正常;0.25分是球囊粘连;0.5分是GS面积占肾小球总面积<10%;1分表示占10%~25%;2分是占26%~50%;3分是占51%~75%;4分是占76%~100%。肾小球硬化指数(glomerulosclerosis index,GSI)是每一张切片在光学显微镜40倍下可见的所有肾小球总分的平均值。GSI=[(1×nl+2×n2+3×n3)/每张肾小球总数]×100%。依照Bertram[6]的方法,PAS染色切片在光镜下拍照,运用Image-Pro Plus 6.0图像分析软件自动测定肾小球面积(glomerular area,GA)。
1.3 nephrin和WT-1免疫组化染色及表达的测定
4µm肾组织切片脱蜡至水,柠檬酸盐抗原修复,过氧化氢室温孵育,加入兔抗鼠nephrin抗体(1∶100,Abcam公司,美国)及WT-1抗体(1∶100,Santa Cruz公司,美国)孵育(4℃冰箱过夜),PBS冲洗,山羊抗兔IgG室温孵育,PBS冲洗,按照免疫组化二步法步骤操作(北京中杉金桥生物技术有限公司)。实验中以PBS代替一抗作为阴性对照。肾小球毛细血管襻外缘观察到有棕黄色线样沉积为阳性信号,染色程度评分:0分为阴性,l分为弱阳性(低倍镜下可疑阳性,高倍镜下明确阳性),2分为中等阳性(低倍镜下明确阳性),3分为强阳性(低倍镜下强阳性);染色范围评分:0分指无阳性染区;1分为1%~25%;2分为26%~50%,3分为5l%~75%,4分为>75%。将单个肾小球染色程度及范围的评分相乘得积分值,所有肾小球积分的总和再除以肾小球数量即为nephrin的积分值。WT-1的评分:肾小球内可见深棕褐色细胞核为WT-1的阳性染色,对每个肾小球进行足细胞的计数,进行统计学分析。
1.4 统计学处理
采用统计软件SPSS13.0进行分析,先进行方差齐性检验。计量资料以±s 表示,组间比较采用配对样本t检验。GA与GSI的相关性分析采用二元变量的相关性分析,并求出相关系数r。P<0.05为差异有统计学意义。
2 结 果
2.1 PAN注射后各项临床指标的改变
PAN注射后4周前表现为肾病综合征,14和20周表现为慢性肾炎及GS的过程。病变随着时间进展,在14和20周肾小球的损害发展到广泛粘连及不同程度的GS或透明样变性,说明造模成功。
2.2 GA及GSI的关系
PAN组在4周时GA与对照组比较没有明显变化,在14周的时候,PAN组的GA明显大于对照组,在20周时PAN组的GA与正常对照组比较明显缩小(表1)。PAN组在上述时间点的GSI[(6.21%±0.45%),(25.34%±7.19%),(30.49%±4.37%)]与对照组比较明显增高(P<0.01)。将PAN组GA与GSI之间做二元变量的相关分析,20周时r=-0.82,P=0.006,呈强负相关关系(图1)。
表1 PAN组大鼠PAN注射后4,14,20周的GATable 1 The GA at 4,14 and 20 weeks after PAN injection(±s )
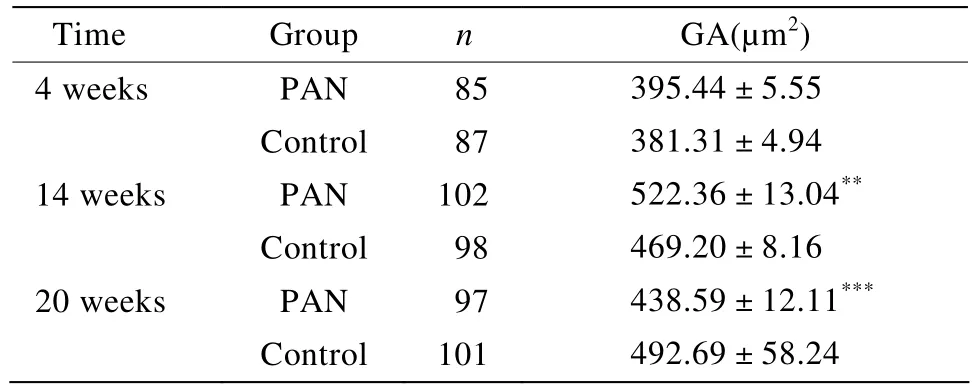
表1 PAN组大鼠PAN注射后4,14,20周的GATable 1 The GA at 4,14 and 20 weeks after PAN injection(±s )
GA:glomerular area;PAN:puromycin aminonucleoside.Compared with control group,**P<0.01,***P<0.001
Time Group n GA(µm2)4 weeks PAN 85 395.44±5.55 Control 87 381.31±4.94 14 weeks PAN 102 522.36±13.04**Control 98 469.20±8.16 20 weeks PAN 97 438.59±12.11***Control 101 492.69±58.24

图1 PAN注射后在不同时间点GA及GSI的相关趋势Figure 1 Correlation trend between GA and GSI in different time points after PAN injection
2.3 nephrin的表达
对照组肾组织中可见nephrin呈浅棕色沿肾小球毛细血管襻呈均匀、线状分布;4周时PAN组nephrin的表达较对照组有所减少,可见染色变浅,分布不均,部分线性消失。14周时,nephrin的表达进一步减少,新月体及硬化粘连的部分无表达,系膜严重增生的区域nephrin的表达稀疏杂乱。20周时,nephrin在硬化的部位无表达(表2,图2)。
表2 不同时间点nephrin的表达Table 2 Immunohistochemical semi-quantitative analysis of nephrin expression in different time points(±s )
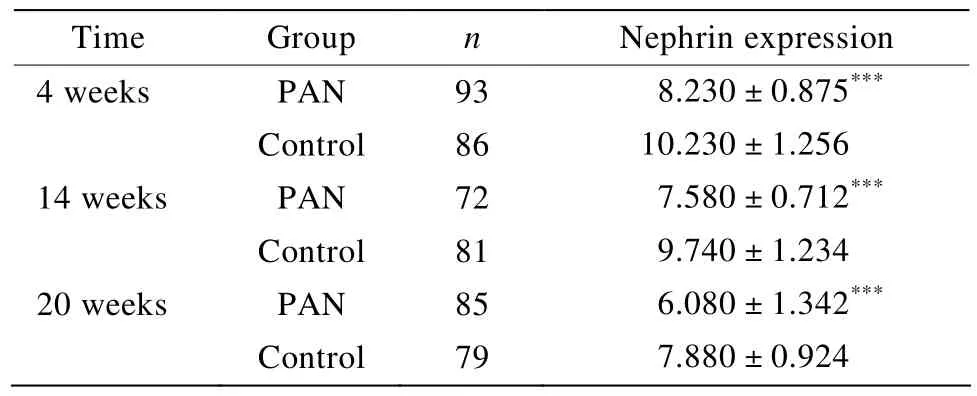
表2 不同时间点nephrin的表达Table 2 Immunohistochemical semi-quantitative analysis of nephrin expression in different time points(±s )
PAN:puromycin aminonucleoside.Compared with control group,***P<0.001
Time Group n Nephrin expression 4 weeks PAN 93 08.230±0.875***Control 86 10.230±1.256 14 weeks PAN 72 07.580±0.712***Control 81 09.740±1.234 20 weeks PAN 85 06.080±1.342***Control 79 07.880±0.924
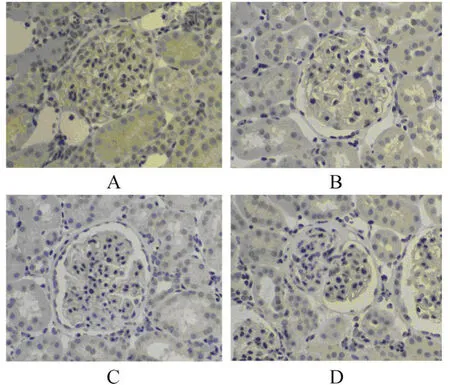
图2 nephrin在不同时间点的表达Figure 2 Expression of nephrin in different time points(ABC×100)
2.4 WT-1的表达
PAN组在4周时WT-1在足细胞核的表达呈深棕色粗大颗粒,与对照组比较差异无统计学意义;14周时表达较对照组有所减少;20周时减少更加明显,且染色较弱。足细胞数量在PAN肾病模型中随着时间的延长依次递减(表3,图3)。
表3 不同时间点WT-1的表达与对照组之间的比较Table 3 Expression of WT-1 compared with control group in different time points(±s )
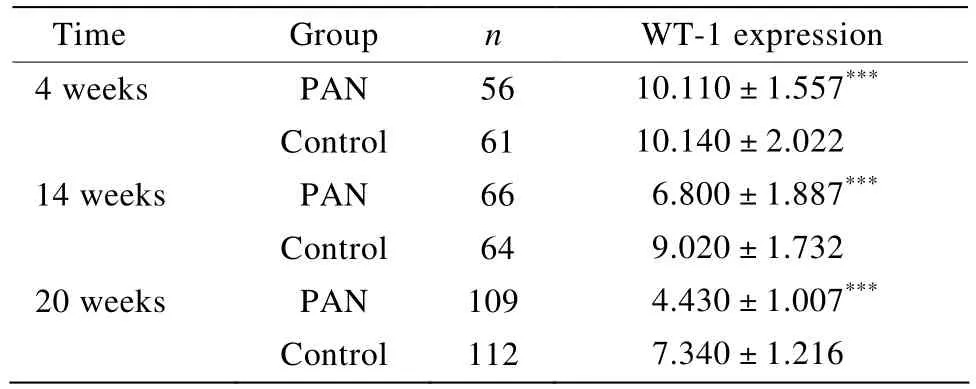
表3 不同时间点WT-1的表达与对照组之间的比较Table 3 Expression of WT-1 compared with control group in different time points(±s )
WT-1:Wilms’ tumor-1,PAN:puromycin aminonucleoside.Compared with control group,***P<0.001
Time Group n WT-1 expression 4 weeks PAN 56 10.110±1.557***Control 61 10.140±2.022 14 weeks PAN 66 6.800±1.887***Control 64 9.020±1.732 20 weeks PAN 109 4.430±1.007***Control 112 7.340±1.216
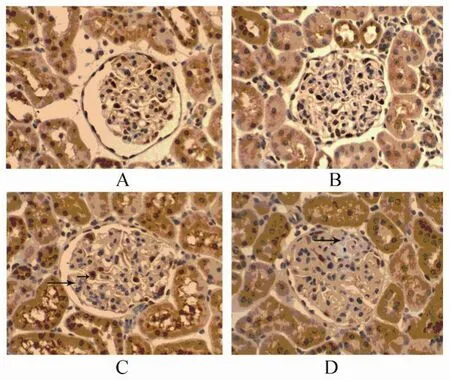
图3 WT-1在不同时间点的表达Figure 3 Expression of WT-1 in different time points(ABC×100)
3 讨 论
GS是由多种原因所致的肾小球损伤后出现的共同转归[7]。足细胞损伤在GS的过程中起着非常重要的作用。PAN肾炎模型是一个经典的足细胞损害模型[8]。我们的临床数据显示,在早期表现为肾病综合征时,GA没有明显改变,说明早期PAN诱导的主要是急性期的肾病综合征,并表示造模成功。此时出现大量蛋白尿,说明已经存在肾小球滤过屏障一过性的破坏,虽然尿蛋白定量在4周时降至正常,但nephrin的表达已经有所减少,说明存在早期的足细胞损伤。nephrin表达减少所体现的足细胞的损伤程度并没有引起足细胞从肾小球基膜上脱落,所以WT-1的表达没有明显变化,说明虽然存在足细胞的损伤,但足细胞的数量没有明显减少。近年来的一些研究也观察到了这一点,nephrin是肾小球滤过屏障选择性功能的关键,在没有出现明显肾脏组织学损害和显著蛋白尿前,nephrin的表达已经明显下降[9]。还有研究称,无论是否有足细胞的脱落,nephrin的异常都会导致蛋白尿[10]。
在14周时,PAN组24h尿蛋白再次明显增加,虽然没有第8天时严重,但此时呈慢性进行性加重的过程,而GA明显较对照组增大。此结果可能是在病程进展中,一方面由于肾小球高灌注、高滤过引起了肾脏的代偿性肥大;另一方面,GS过程中,部分肾单位破坏,功能丧失,而另一部分残存肾单位代偿性肥大(肾功能代偿期)。此时虽然GA由于代偿而相对增大,但是由于肾小球部分球囊粘连,毛细血管襻硬化,所以GSI增大,GA与GSI之间存在着一定的正相关关系,但是没有统计学差异,此时nephrin的表达较前有所减少,说明足细胞的损伤进一步加重,同时,WT-1的表达也明显减少,说明足细胞数量减少,在切片中已经观察到硬化的肾小球数目增多。大量研究表明,在GS的发展过程中,单位肾小球内足细胞数量的减少发挥着非常重要的作用。Kim等[11]发现在给大鼠单次注射PAN后,大鼠肾小球的足细胞数量明显减少,而丢失足细胞的部位会进一步发生GS。本研究也进一步证实了上述观点,如能完善电镜结果将更能在超微结构方面增加足细胞损伤的证据。
PAN模型在20周时表现为慢性肾炎综合征,在此时GA明显缩小,GS面积进一步增加,呈不同程度纤维化、透明变性,GS特征明显。并且GA与GSI之间呈负相关,即GA越小,GS的面积越大、程度越重,GSI越大。说明随着病程的进展,大面积的GS、纤维化及透明样变、使得GA缩小,肾功能进行性地发展到失代偿期,最终进入终末期肾病。而此时nephrin在硬化的肾小球几乎已经没有表达,而WT-1的表达也呈进行性下降的趋势,足细胞数量进一步减少,除了影响肾小球滤过膜结构的完整性,还使肾小球基膜大量裸露,与鲍曼囊粘连,加重GS的程度。有研究者在使用PAN模型研究足细胞的损伤中发现,PAN注射后表达在大鼠肾脏肾小球足细胞足突的NF-кB受体激活剂配体(receptor activator of nuclear factor-κB,RANK)上调,引起足细胞足突的融合,而NF-κB受体激活剂配体(receptor activator of NF-κB ligand,RANKL)显著抑制PAN诱导的足细胞损伤,表明RANKL/RANK之间的互动在PAN模型中的足细胞损伤发挥着重要的作用[12,13]。上述研究及本研究均证实了足细胞的损伤与GS之间的密切联系。关于足细胞损伤与GS的关系的发生机制尚未明确,还需要进一步的探索。
4 小 结
(1)成功建立PAN模型,模拟了肾病综合征及GS的改变过程。(2)在慢性肾炎晚期(20周)GSI和GA之间呈负相关关系,GS程度越重,GA越小。(3)nephrin及WT-1的表达在PAN模型中随着慢性肾脏病的进展逐渐减少。因此,足细胞损害及数量的减少与GS进展的过程有密切的关系。
【参考文献】
[1]Peters I,Tossidou I,Achenbach J,et al.IGF-binding protein-3 modulates TGF-beta/BMP-signaling in glomerular podocytes[J].J Am Soc Nephrol,2006,17(6):1644-1656.
[2]Loeffler I,Hopfer U,Koczan D,et al.Type Ⅷ collagen modulates TGF-β1-induced proliferation of mesangial cells[J].J Am Soc Nephrol,2011,22(4):649-663.
[3]Batlle D,Wysocki J,Soler MJ,et al.Angiotensin-converting enzyme 2:enhancing the degradation of angiotensin Ⅱ as a potential therapy for diabetic nephropathy[J].Kidney Int,2012,81(6):520-528.
[4]Brunskill EW,Potter SS.Changes in the gene expression programs of renal mesangial cells during diabetic nephropathy[J].BMC Nephrol,2012,13:70.
[5]Raij L,Azar S,Keane W.Mesangial immune injury,hypertension,and progressive glomerular damage in Dahl rats[J].Kidney Int,1984,26(2):137-143.
[6]Bertram JF.Analyzing renal glomeruli with the new stereology[J].Int Rev Cytol,1995,161:111–172.
[7]Miner JH.Organogenesis of the kidney glomerulus:focus on the glomerular basement membrane[J].Organogenesis,2011,7(2):75–82.
[8]Bae EH,Kim SW.Changes in endothelin receptor type B and neuronal nitric oxide synthase in puromycin aminonucleoside-induced nephrotic syndrome[J].Korean J Physiol Pharmacol,2010,14(4):223–228.
[9]Kalluri R.Proteinuria with and without renal glomerular podocyte effacement[J].J Am Soc Nephrol,2006,17(9):2383-2389.
[10]Matsusaka T,Sandgren E,Shintani A,et al.Podocyte injury damages other podocytes[J].J Am Soc Nephrol,2011,22(7):1275–1285.
[11]Kim YH,Goyal M,Kurnit D,et al.Podocyte depletion and glomerulosclerosis have a direct relationship in the PAN-treated rat[J].Kidney Int,2001,60(3):957-968.
[12]Greka A,Mundel P.Cell biology and pathology of podocytes[J].Annu Rev Physiol,2012,74:299–323.
[13]Liu S,Shi W,Xiao H,et al.Receptor activator of NF-kappaB and podocytes:towards a function of a novel receptor-ligand pair in the survival response of podocyte injury[J].PLoS One,2012,7(7):e41331.

