TFP5对高糖诱发的细胞周期素依赖性激酶过度激活及胰岛β细胞凋亡的影响
张 霞,付海霞,郑亚莉*
(1宁夏人民医院肾脏内科,银川 750002;2山东日照市中心医院血液净化中心,日照 276800)
2型糖尿病(type 2 diabetes mellitus,T2DM)属于老年退行性疾病,严重影响着人类的身体健康。细胞周期素依赖性激酶5(cyclin dependent kinase 5,Cdk5)作为Cdk家族成员,在病理情况下,由于p35裂解为p25,而被过度激活[1]。过度活化的Cdk5在神经系统可导致Tau蛋白过度磷酸化,引起神经细胞凋亡,参与神经退行性疾病的发生和进展[2]。近年研究发现,胰岛细胞中存在p35,高糖刺激可使p35表达增高,使Cdk5过度激活、抑制胰岛素分泌,而抑制该激酶活性可能发挥治疗T2DM作用[2]。前期的研究已经发现,由p35分解得到的短肽Cdk5抑制肽(Cdk5 inhibitory peptide,CIP)可抑制Cdk5活性,可能用于治疗神经退行性疾病[3]。有研究发现,T2DM与神经退行性疾病发病有着共同的病理生理机制[2,4]。本研究中,继续分解CIP得到24个氨基酸的短肽p5,连接TAT蛋白和FITC后合成TFP5,探究TFP5对高糖刺激下胰岛细胞中Cdk5活性、胰岛细胞存活和功能的影响,探讨其对T2DM的防治作用。
1 材料与方法
1.1 抗体和试剂
Cdk5、p35抗体购自Santa Cruz生物公司,微管蛋白(tubulin)单克隆抗体、Bax、Bcl-2抗体和Lipofectamine基因转染试剂购自Invitrogen公司,DMEM培养液购自Gibco公司,胎牛血清购自Hyclone公司,胰岛素分泌测定酶标免疫试剂盒购自Linco Research公司。小鼠胰岛β细胞(Min6细胞株),由NIH,Dr.Abner Notkins’Lab赠送。TFP5肽由21st Century Biochemicals(Marlboro,MA)合成。
1.2 细胞的培养及刺激
Min6细胞在含有4.5g/L的葡萄糖、10%的胎牛血清、100kU/L的青霉素G和100mg/L链霉素的DMEM培养液中培养。胰岛细胞铺板于6孔培养盘(100万/孔)。次日分别用不同浓度的葡萄糖(5,25mmol/L)培养刺激,并将高糖条件下培养的细胞分别转染EV、TFP5和携带p5基因的病毒(1ml/L),48h后收取细胞和上清液。裂解细胞,收取蛋白做各种蛋白表达及Cdk5酶活性测定。用ELISA试剂盒检测上清液中胰岛素的分泌量。
1.3 Cdk5激酶活性测定
用细胞裂解液收取细胞,提取蛋白,BCA法进行蛋白定量分析(Biorad protein assay)。取200µg蛋白加Cdk5多克隆抗体,在4℃中旋转孵育过夜,次日加免疫球蛋白A琼脂糖凝胶珠在4℃中旋转孵育4h,用细胞溶解液洗3次,得到Cdk5激酶,用同位素γ-32P标记测定酶的活性。
1.4 免疫印迹(Western blot)
裂解细胞提取蛋白与上样缓冲液混合后,按每道35µg上样到4%~20% SDS-PAGE凝胶,电泳分离,转膜到PVDF膜(100V,90min)。用封闭液封闭1h,加入一抗反应液(以5%脱脂奶粉封闭液稀释抗Cdk5和p35多克隆抗体,1∶200),4℃孵育过夜,TBST溶液漂洗4次,与辣根过氧化物酶标记的二抗(1∶5000)在室温下孵育1~2h,再以TBST溶液漂洗4次,ECL显色,X线底片曝光。
1.5 胰岛素分泌水平测定
将Min6细胞铺板到6孔培养盘(100万/孔),在DMEM培养基中培养,其中加10%胎牛血清,和100kU/L的青、链霉素。放在37℃,5%CO2培养箱中培养。次日加TFP5或带有p5基因的腺病毒(浓度1mg/L每孔)。48h后收取细胞和上清液,裂解液裂解细胞提取蛋白进行体外激酶活性实验测定Cdk5活性变化;用胰岛素ELISA试剂盒分别检测细胞培养上清液中胰岛素的分泌水平,用免疫酶标的方法进行测定分析。
1.6 免疫荧光染色
细胞用4%甲醛固定30min,5% BSA/PBS(含0.1% TritonX-100)封闭液封闭30min,加入用封闭液稀释的一抗,4℃孵育过夜或室温下孵育2h。加入免疫荧光标记的IgG抗体(二抗)在室温下孵育1h,然后用PBS洗涤3遍,细胞核用Hoescht33342染色。荧光图像使用Zeiss LSM-510扫描共聚焦显微镜,图像处理使用Adobe Photoshop。
1.7 统计学处理
采用SPSS13.0统计学软件进行分析。计量资料以均数±标准差表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TFP5来源及基因序列
将p35的C端24个氨基酸序列(Lys254-Ala277)短肽分解出来,命名为p5(图1A);在p5短肽-C端连接一具有11个氨基酸的TAT蛋白(一种细胞穿透肽),N端连接FITC(一种绿色荧光蛋白)合成TFP5(图1B)。
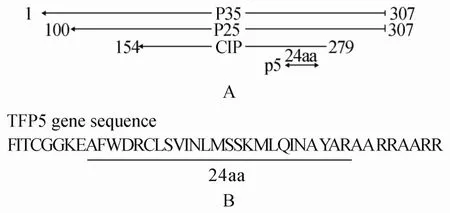
图1 TFP5结构示意图Figure 1 The schematic diagram of TPF5
2.2 TFP5可有效转导入细胞内并在Min6细胞表达
将TFP5肽导入Min6细胞(100nmol/L),以腺病毒-p5和空病毒载体为对照,以抗p35抗体为一抗,用Western印迹法检测p5蛋白表达,结果发现3组Min6细胞均有p35蛋白表达,导入TFP5和腺病毒-p5后,可检测到Min6细胞表达p5蛋白(图2A)。
免疫荧光镜下显示导入TFP5肽后Min6细胞内有绿色荧光,也证实TFP5可有效进入细胞内(图2B)。
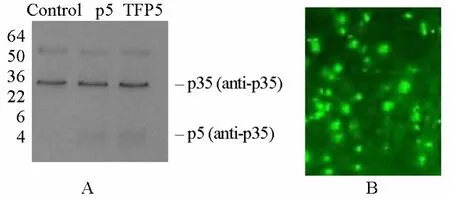
图2 TFP5转染Min6细胞后表达检测Figure 2 The expression of TFP5 in Min6 cells
2.3 TFP5抑制高糖刺激下Cdk5过度活性、恢复胰岛素分泌
实验分3组。1组:低糖组(5mmol/L);2组:高糖(25mmol/L)+空病毒载体(EV)组;3组:高糖(25mmol/L)+TFP5组。提取3组细胞中的蛋白检测Cdk5活性,组蛋白H1为底物,结果发现高糖环境下组蛋白H1磷酸化水平升高,Cdk5活性增高(图3A、3B,2组vs1组);导入TFP5后组蛋白H1磷酸化水平下降,Cdk5活性降低(图3A、3B,3组vs2组)。
收集3组细胞培养上清液,ELISA方法检测上清中胰岛素分泌水平,发现高糖环境下胰岛素分泌减少(图3C,2组vs1组),转染TFP5后,可恢复Min6细胞的胰岛素分泌(图3C,3组vs2组)。
2.4 TFP5抑制高糖刺激下Min6细胞凋亡
以TFP5或空病毒载体(EV)转染Min6细胞,24h后给予高糖或低糖刺激。试验共分4组:TFP5+低糖刺激组(5mmol/L)、TFP5+高糖刺激组(25mmol/L)、EV+低糖刺激组(5mmol/L)、EV+高糖刺激组(25mmol/L)。作用24h后收集细胞提取蛋白,采用Western印迹法分析细胞凋亡标志物Bax和Bcl-2蛋白表达水平,发现低糖刺激,TFP5不影响细胞凋亡;高糖刺激可诱导细胞凋亡,转染TFP5后细胞凋亡明显减少(图4)。
3 讨 论
T2DM的病理生理基础是胰腺β细胞损害和凋亡,发病率、病死率越来越高,严重威胁人类健康[5]。Cdk5是Cdk家族的成员,是脯氨酸限制性丝氨酸/苏氨酸蛋白激酶,普遍存在于哺乳动物的细胞内[1]。生理情况下,Cdk5与其激活亚基p35结合形成Cdk5/p35复合物而被激活,参与一系列生理过程。而在病理状态下,如氧化应激、高血糖等环境下,p35分解为p25与Cdk5结合形成Cdk5/p25复合物,使Cdk5处于过度激活状态,便某些底物过磷酸化,诱导细胞的凋亡。
在阿尔茨海默病中,Cdk5与p25结合后过磷酸化tau蛋白导致神经细胞凋亡[3]。许多研究已经发现T2DM与阿尔茨海默病在发生发展过程中有相似的病理生理机制参与[6-9]。近来有研究发现胰岛β细胞中表达Cdk5和p35,Cdk5过度激活参与了T2DM的发病,提示Cdk5激酶抑制剂可能用于治疗T2DM。
Cdk5激酶化学抑制剂大部分竞争性地结合ATP结合位点,缺乏特异性,且有严重不良反应无法应用于临床。笔者在前期研究中发现,将P35蛋白分解得到短肽CIP(含125个氨基酸残基)可特异性地抑制Cdk5激酶活性[3,10],进一步分解得到24个氨基酸残基的短肽p5仍可特异性地抑制Cdk5激酶活性,甚至作用优于CIP[3]。但在p5临床应用的研究过程中,面临的一个重要的问题是基因载体的选择。目前常用的载体有质粒载体和病毒载体,前者安全性高,但对细胞的转染率低,影响疗效,后者对细胞的转染率高,但有潜在致癌性,而且病毒蛋白易引起免疫反应,在治疗安全性上存在问题。本实验通过连接FITC和TAT,用基因重组技术合成得到含p5肽、TAT并标记了绿色荧光的TFP5短肽。TAT是一个具有细胞穿透能力的短肽,可作为一个安全而又细胞转染率高的载体。以TAT蛋白为载体,能否高效进入细胞内?本实验第二部分,观察了TFP5导入Min6的效果,发现TFP5进入细胞率高达90%(图2B)。那么,在胰岛β细胞中,TFP5是否具有抑制Cdk5活性的作用,进而能否调节胰岛素的分泌?本试验第三部分,用高糖刺激细胞诱发Min6细胞中Cdk5过度活性,并加入TFP5,观察Cdk5激酶活性变化和细胞胰岛素分泌水平。结果证实,高糖刺激可以诱发Cdk5高活性,抑制胰岛素分泌,TFP5能有效地抑制Cdk5高活性,恢复胰岛素分泌水平。以上的结果是否是通过抑制了高糖对胰岛β细胞的损伤而起作用?本试验第四部分,比较了高糖刺激下,加入TFP5后Min6细胞表达Bax/Bcl-2比例水平变化,结果发现TFP5可抑制高糖刺激下胰岛细胞的异常凋亡。

图3 TFP5对Min6细胞中Cdk5活性和胰岛素分泌的影响Figure 3 The effect of TFP5 on Cdk5 activity and insulin secretion
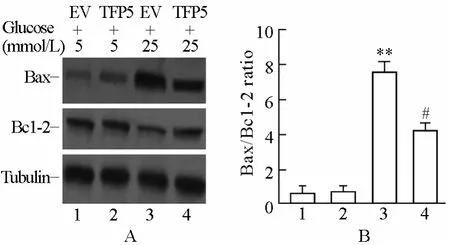
图4 TFP5对高糖刺激下Min6细胞凋亡的作用Figure 4 The effect of TFP5 on apoptosis of Min6 cells treated with high glucose
综上所述,TFP5作为Cdk5激酶过度活性的抑制短肽,不需要载体可直接进入细胞内,抑制高糖诱导的Cdk5过度活性,减轻胰岛细胞凋亡,恢复高糖环境下胰岛细胞对胰岛素的分泌,可能成为靶向Cdk5激酶治疗T2DM病的新途径。
【参考文献】
[1]Hisanaga S,Saito T.The regulation of cyclin-dependent kinase 5 activity through the metabolism of p35 or p39 Cdk5 activator[J].Neurosignals,2003,12(4-5):221-229.
[2]Zheng YL,Hu YF,Zhang A,et al.Overexpression of p35 in Min6 pancreatic beta cells induces a stressed neuron-like apoptosis[J].J Neurol Sci,2010,299(1-2):101-107.
[3]Dhavan R,Tsai LH.A decade of CDK5[J].Nat Rev Mol Cell Biol,2001,2(10):749-759.
[4]Zheng YL,Kesavapany S,Gravell M,et al.A Cdk5 inhibitory peptide reduces tau hyperphosphorylation and apoptosis in neurons[J].EMBO J,2005,24(1):209-220.
[5]Andrali SS,Sampley ML,Vanderford NL,et al.Glucose regulation of insulin gene expression in pancreatic beta-cells[J].Biochem J,2008,415(1):1-10.
[6]Wei FY,Tomizawa K.Cyclin-dependent kinase 5(Cdk5):a potential therapeutic target for the treatment of neurodegenerative diseases and diabetes mellitus[J].Mini Rev Med Chem,2007,7(10):1070-1074.
[7]Zhao WQ,Townsend M.Insulin resistance and amyloidogenesis as common molecular foundation for type 2 diabetes and Alzheimer's disease[J].Biochim Biophys Acta,2009,1792(5):482-496.
[8]Haan MN.Therapy insight:type 2 diabetes mellitus and the risk of late-onset Alzheimer's disease[J].Nat Clin Pract Neurol,2006,2(3):159-166.
[9]Li L,Holscher C.Common pathological processes in Alzheimer disease and type 2 diabetes:a review[J].Brain Res Rev,2007,56(2):384-402.
[10]Zheng YL,Li C,Hu YF,et al.Cdk5 inhibitory peptide(CIP)inhibits Cdk5/p25 activity induced by high glucose in pancreatic beta cells and recovers insulin secretion from p25 damage[J].PLoS One,2013,8(9):e63332.

