探讨血清卵泡刺激素预测非梗阻性无精子症患者精子发生的切点值
黄永汉 廖黎黎 何 磊 梁小丽 徐杰伟
中山大学附属佛山医院,佛山市第一人民医院生殖医学中心(佛山 528000)
探讨血清卵泡刺激素预测非梗阻性无精子症患者精子发生的切点值
黄永汉 廖黎黎 何 磊 梁小丽 徐杰伟
中山大学附属佛山医院,佛山市第一人民医院生殖医学中心(佛山 528000)
目的利用受试者工作特征曲线(receiver operator characteristic curve ROC曲线)探讨血清卵泡刺激素(FSH)的切点值,以预测非梗阻性无精子症患者睾丸的精子发生。方法选取104例非梗阻性无精子症患者测定其血清FSH(IU/L)值,行经皮睾丸取精子术(TESA)并根据睾丸活检报告分为有精子组(1组)和无精子组(2组)。结果FSH≤7有52例(50%),找到精子51例,其概率为98.08%(51/52);7<FSH≤14有20例(19.23%),找到精子17例,其概率为85%(17/20);14<FSH≤21有13例(12.50%),找到精子3例,其概率为23.08%(3/13);FSH>21有19例(18.27%),找到精子6例,其概率为31.58%(6/19)。利用ROC曲线优选的血清FSH切点值是13.78IU/L,该点其敏感性为85.2%,特异性为88.3%,血清FSH水平的ROC曲线下面积为0.895,表明其诊断准确性较高。结论 非梗阻性无精子症患者血清FSH水平对预测睾丸精子发生有重要意义。
ROC曲线; 卵泡刺激素; 无精子症
正常的下丘脑-垂体-睾丸轴是精子发生的先决条件,其中负反馈机制在激素控制的过程当中起着重要的作用[1,2]。由垂体前叶释放的卵泡刺激素(FSH)与黄体生成素(LH)分别作用于睾丸支持细胞(sertoli cells)与间质细胞(leydig cells),并维持正常生精。支持细胞通过释放抑制素B(Inhibin B)负反馈抑制垂体前叶释放FSH,所以当精子生成障碍时,血清抑制素B降低而FSH水平升高[3]。高水平的FSH往往预示着生精小管的生殖上皮受到损伤[4],血清FSH水平与精子发生呈负相关,因此该指标也被认为在内分泌水平用于评价不育男性的生精功能。随着无精子症患者越来越多以及辅助生殖技术的普及,我们有必要探讨血清FSH用于预测非梗阻性无精子症患者精子发生的切点值,以便提前判断患者睾丸内是否存在精子发生,从而为非梗阻性无精子症患者的进一步诊治提供重要资料。
对象与方法
一、研究对象及分组
选取2012年3月至2014年2月在本院门诊就诊的非梗阻性无精子症患者104例,年龄18~45岁,所有患者均经过连续3次精液离心沉渣镜检未发现精子,并于上午8:00~10:00行血清性激素水平检测,本院性激素水平正常参考值为:总睾酮(total testosterone,T)9.1~46.2nmol/L,卵泡刺激素(follicle-stimulating hormone,FSH)1.00~7.00IU/L,黄体生成素(luteinising hormone,LH)1.00~8.00IU/L,泌乳素(prolactin,PRL)6.20~13.00ng/mL,雌二醇(estradiol,E2)8.00~36.00ng/L。根据睾丸穿刺病理报告分为正常生精功能、生精功能低下、生精停滞、唯支持细胞综合征、未成熟型睾丸,其中正常生精功能与生精功能低下统一归入有精子组(1组)、生精停滞、唯支持细胞综合征、未成熟型睾丸统一归入无精子组(2组),其中1组77例,占74.04%,2组27例,占25.96%。
二、统计分析
统计分析软件为SPSS 13.0,数据采用均数±标准差(±s)表示,采用t检验比较各组之间的差异,采用ROC曲线分析血清FSH预测无精子症患者精子发生的切点值,根据ROC曲线下面积(Area Under the Curve AUC)判断各激素水平的预测价值,设定P<0.05为差异有统计学意义。
结 果
一、有精子组与无精子组年龄及FSH水平的比较
如表1所示,77例患者成功找到精子(1组),年龄为18~45岁(30.31±5.77);27例患者未能找到精子(2组),年龄为19~37岁(27.96±3.82),两组年龄相比无明显统计学差异。而1组的血清FSH水平(7.69±7.37)明显低于2组(22.06±9.60),有显著统计学差异。

表1 有精子组与无精子组年龄及FSH水平比较
二、不同FSH水平者找到精子的概率
本院血清FSH水平正常上限值为7.00 IU/L,统计全部病例发现:FSH≤7有52例(50%),找到精子51例,其概率为98.08%(51/52);7<FSH≤14有20例(19.23%),找到精子17例,其概率为85%(17/20);14<FSH≤21有13例(12.50%),找到精子3例,其概率为23.08%(3/13);FSH>21有19例(18.27%),找到精子6例,其概率为31.58%(6/19)。
三、用ROC曲线优选FSH的切点值
利用ROC曲线探讨血清FSH预测非梗阻性无精子症患者精子发生的切点值,设定睾丸活检报告为“金标准”并以该结果作为状态变量,以FSH水平作为检验变量,得到ROC曲线见图1。血清FSH水平切点值13.78 IU/L所对应的敏感度85.2%,特异度88.3%,两者相加可达最大值1.735,血清FSH所作ROC曲线的AUC为0.895(95%可信区间位于0.831与0.960之间),而T、LH、PRL、E2所作ROC曲线的AUC分别为0.367、0.795、0.670、0.374。
讨 论
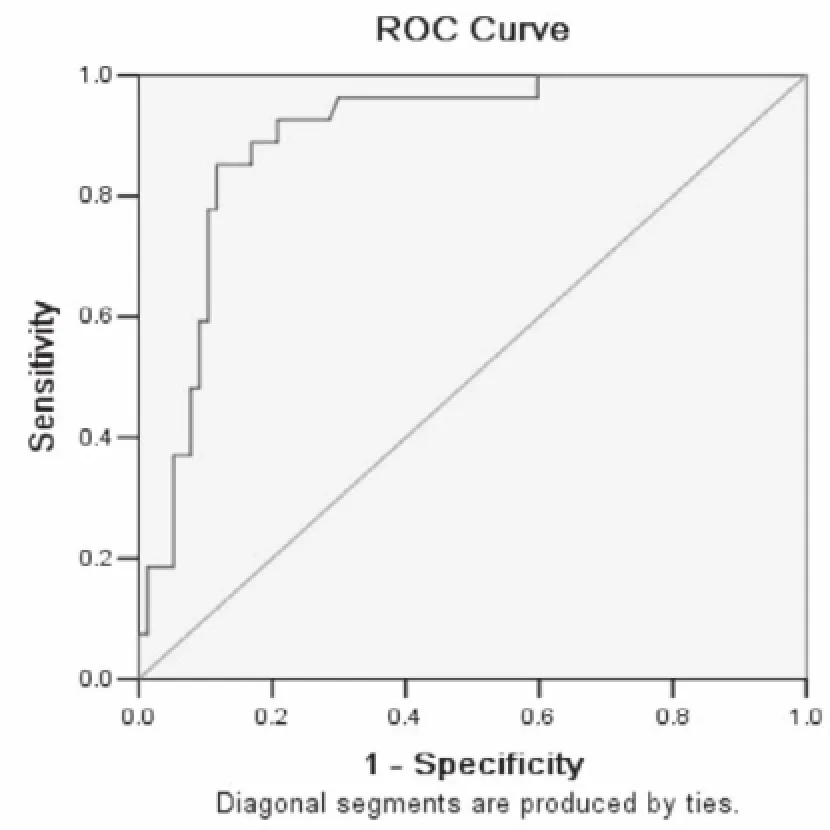
图1 血清FSH所作 ROC曲线
在非梗阻性无精子症患者当中,由于负反馈机制的存在,使得血清抑制素B浓度降低而FSH水平升高,血清FSH水平有时可升高至正常水平的2~4倍。虽然FSH在青春期可以起到启动和促进精子发生的作用,一些性腺机能减退的患者通过补充FSH仍有精子发生,但是只有在FSH与T的联合作用下,才可以使精子发生在数量和质量上都维持正常水平。当梗阻性无精子症患者无法行外科手术重建时,经皮睾丸取精子术(TESA)即为患者获得精子行ICSI的有效手段,非梗阻性无精子症患者更是如此。但由于TESA为有创性操作,在临床工作当中是否有一些无创性的检测方法能够提前预测睾丸内的精子发生,比如最常用到的血清FSH水平为多高时,穿刺取到精子的可能较大,仍值得探讨。
本研究发现有精子组与无精子组患者在年龄上无明显统计学差异,而血清FSH水平在两组之间存在明显统计学差异,证明血清FSH水平用于判断睾丸生精功能有参考价值。有学者研究了106例无精子症患者,发现当睾丸最大直径<4cm且血清FSH>10IU/L,取到精子的成功率从77%降至29%[5]。另外一项研究则发现血清FSH>60IU/L则完全可排除找到精子的可能性,而FSH≤15IU/L,找到精子的机率为100%[6]。Wang等[8]通过比较57例无精子症患者睾丸组织FSH受体的表达,发现唯支持细胞综合征组患者血清FSH水平明显高于精子成熟阻滞、生精功能低下、生精功能正常组(P<0.01),精子成熟阻滞患者的血清FSH水平明显高于生精功能低下、生精功能正常组(P<0.05),生精功能低下与生精功能正常组血清FSH水平无差别,睾丸组织中的FSH受体表达在唯支持细胞综合征患者中明显升高。
通过本研究发现FSH正常的患者共52例,51例可以找到精子,概率为98.08%,当FSH升高至正常的2倍时,20例患者当中仍有17例可以找到精子,机率为85%,即血清FSH≤14 IU/L时,共72例患者中有68例可以成功找到精子,概率为94.44%。有13例患者的血清FSH位于正常值的2倍与3倍之间,有3例可以找到精子,概率为23.08%,有19例患者的血清FSH升高至正常值的3倍或以上,找到精子有6例,其概率为31.58%,即血清FSH>14IU/L时,32例患者中有9例可以找到精子,概率为28.13%。通过分析上述数据发现随着FSH升高,找到精子的概率逐渐降低,以FSH=14IU/L作为分界,当小于该值时有94.44%的概率可以找到精子,而大于该值时仅有28.13%的概率可以找到精子。另外,我们注意到FSH位于14与21之间,找到精子的概率为23.08%,FSH>21,找到精子的概率反而能达到31.58%,究其原因,可能是一些睾丸体积明显缩小(FSH显著升高)的患者已经放弃行睾丸活检,而导致FSH>21入组例数偏少所致。
我们通过ROC曲线优选血清FSH水平的切点值发现,血清FSH水平切点值13.78 IU/L所对应的敏感度85.2%,特异度88.3%,血清FSH所作ROC曲线的AUC为0.895,而其余4种性激素所作ROC曲线下面积均小于FSH,说明FSH用于预测非梗阻性无精子症患者睾丸精子发生的准确度较高,这对于指导临床工作有重要意义,对于血清FSH水平位于该切点值以下的患者,取得精子的可能性较大,而对于FSH水平位于该切点值以上的患者,在行TESA前应当详细与患者沟通有可能无法获得精子,并取得患者充分知情同意后再行相关操作。Bar等[7]通过研究发现血清FSH升高到27 IU/L以上时,95%的患者睾丸中都不存在精子发生。Bonarriba 等[10]对74例无精子症患者进行经皮睾丸取精子术,并根据最终是否取得精子结合血清FSH水平作ROC曲线,发现切点值为12.2 IU/L。Christman等[9]对140例无精子症患者当中的78例进行睾丸活检,并根据最终结果结合所测得的精液量、精浆果糖、FSH、T、E2、PRL进行多因素分析,发现只有FSH可用于预测非梗阻性无精子症,对FSH所作ROC曲线切点值为12.3IU/L,ROC曲线的AUC为0.847。
本研究得到的结论与国内外大多数研究结论是一致的,即血清FSH水平作为预测非梗阻性无精子症患者睾丸内是否存在精子发生有指导意义,适当的切点值可帮助我们在行TESA之前初步评估患者睾丸的生精功能。但是关于切点值的具体数值存在差异,可能由于各个研究的性激素检测仪器、患者种群和TESA方式不同,但是我们的该项研究也存在一些不足,待病例数进一步增多并加入睾丸体积、抑制素B作为参数后,我们将进行更进一步的探讨。
1 Plant TM, Marshall GR. The functional significance of FSH in spermatogenesis and the control of its secretion in male primates.Endocr Rev2001; 22(6): 764-786
2 Ramaswamy S, Plant TM. Operation of the folliclestimulating hormone (FSH)-inhibin B feedback loop in the control of primate spermatogenesis.Mol Cell Endocrinol2001; 180(1-2): 93-101
3 Jensen TK, Andersson AM, Hjollund NH,et al.Inhibin B as a serum marker of spermatogenesis: correlation to differences in sperm concentration and follicle-stimulating hormone levels. A study of 349 Danish men.J Clin Endocrinol Metab1997; 82(12): 4059-4063
4 Bergmann M, Behre HM, Nieschlag E. Serum FSH and testicular morphology in male infertility.Clin Endocrinol(Oxf) 1994; 40(1): 133-136
5 Bromage SJ, Falconer DA, Lieberman BA,et al. Sperm retrieval rates in subgroups of primary azoospermic males.Eur Urol2007; 51(2): 534-539
6 Jinno M, Ozaki T, Nakamura Y,et al. Predicting sperm retrieval rates in testicular sperm extraction for azoospermia according to endocrine prof les. Reprod Med Biol 2005; 4(4): 239-245
7 Bar-On E, Weiss DB, Gottschalk-Sabag S,et al. The relationship between plasma levels of gonadotropins, androgens, and prolactin in azoospermic men with their testicular spermatogenic pattern.Fertil Steril1995; 64(5): 1043-1045
8 Wang L, Huang H, Jin F,et al. High expression of follicle stimulating hormone receptor in testicular tissue of idiopathic azoospermic patients with severe spermatogenic defects.Chin Med J (Engl)2014; 127(3): 488-493
9 Christman MS, Gudeman SR, Nork JJ,et al. Operating characteristics of follicle-stimulating hormone in azoospermic men.Fertil Steril2014; 101(5): 1261-1265
10 Bonarriba CR, Burgués JP, Vidaña V,et al.Predictive factors of successful sperm retrieval in azoospermia.Actas Urol Esp2013; 37(5): 266-272
(2014-09-01收稿)
The cut-off value of serum follicle-stimulating hormone predicts spermatogenesis of non-obstructive azoospermic patients
Huang Yonghan, Liao Lili, He Lei, Liang Xiaoli, Xu Jiewei Department of Reproductive Center, Aff liated Foshan Hospital of Sun Yat-sen University, The First People's Hospital of Foshan, Foshan, Guangdong 528000, China
ObjectiveTo explore the cut-off value of the serum follicle-stimulating hormone (FSH) by using receiver operator characteristic curve(ROC curve) for prediction of spermatogenesis in the testis of the non-obstructive azoospermic patients.MethodsLevels of serum FSH (IU/L) in 104 non-obstructive azoospermic patients were f rst measured. Based on the results of testicular sperm aspiration (TESA), the patients were divided into sperm group (No.1 group) and nonsperm group (No.2 group).ResultsIn 52 (50%) of 104 patients, level of their serum FSH was lower than 7, and 51 patients(98.08%) of them were positive in sperm retrieval; in 20/104 (19.23%) patients, level of their serum FSH ranged from 7 to 14, and 17 patients(85%) were positive in sperm retrieval; In 13/104(12.50%)patients, level of their serum FSH range from 14 to 21, and 3 patients (23.08%)were positive in sperm retrieval; In 19/104(18.27%) patients, level of their serum FSH more than 21, and 6 patients (31.58%)were positive in sperm retrieval; The cut-off value is 13.78IU/L for FSH, with sensitivity of 85.2% and specificity of 88.3%, The area under curve(AUC) was 0.895, indicating a high diagnostic accuracy. Conclution Serum FSH level of non-obstructive azoospermic patients is very important in predicting spermatogenesis in the testis.
ROC curve; follicle stimulating hormone; azoospermia
10.3969/j.issn.1008-0848.2014.10.007
R 698.2

