白细胞介素-2在人早期乳腺癌组织中的表达及预后意义
李 莹,于海明,杨俊兰,焦顺昌,司 文
1解放军总医院 肿瘤内科,北京 100853;2南开大学,天津 300071
白细胞介素-2在人早期乳腺癌组织中的表达及预后意义
李 莹1,于海明1,杨俊兰1,焦顺昌1,司 文2
1解放军总医院 肿瘤内科,北京 100853;2南开大学,天津 300071
目的探讨白细胞介素-2(interleukin-2,IL-2)在乳腺癌患者肿瘤组织中的表达与临床病理特征及预后的关系。方法回顾性收集2000年1月- 2002年12月在解放军总医院手术的130例Ⅰ~Ⅲ期乳腺癌患者的临床资料及石蜡切片,用免疫组织化学法检测IL-2蛋白的表达,分析IL-2蛋白的表达与乳腺癌临床病理特征及预后的关系。结果IL-2主要在乳腺癌间质淋巴细胞中表达。IL-2间质细胞密度与T分期呈负相关(P=0.025)。IL-2间质细胞密度高表达组的无病生存期(disease free survival,DFS)(P=0.007)、无远处转移生存期(distant disease free survival,DDFS)(P=0.010)均优于低表达组,IL-2间质细胞密度分组是总生存期(overall survival,OS)(HR=0.301,P=0.059)、DFS(HR=0.156,P=0.012)、DDFS(HR=0.171,P=0.018)的独立预后预测因素。结论IL-2在乳腺癌肿瘤组织中的表达情况具有预后预测价值。IL-2表达水平低的乳腺癌患者复发转移风险与死亡风险较高。
乳腺肿瘤;白细胞介素-2;预后
白细胞介素-2(interleukin-2,IL-2)是分子量约为15.5 kU的α-螺旋结构的细胞因子,在体内主要由活化的CD4+T细胞和CD8+T细胞分泌,前者所占比例较大[1]。它是具有免疫促进作用的Th1类细胞因子,可促进免疫细胞对肿瘤的杀伤作用。
乳腺癌是女性最常见的恶性肿瘤之一,全世界每年约有1百万例新诊断的乳腺癌患者[2]。乳腺癌的一些临床病理特征,包括肿瘤的大小、淋巴结转移情况、病理分级、病理类型、有无脉管癌栓、年龄、月经情况等,已经用于对预后的判断并指导乳腺癌的全身治疗[3]。但是临床工作中仍然需要一些新的生物靶标,更全面地对乳腺癌的复发、转移、预后进行预测,从而更有针对性地进行个体化治疗。
肿瘤的发生与进展过程受到间质细胞、内皮细胞、炎症与免疫细胞产生信号的影响并且与其微环境相互作用[4]。细胞因子是免疫应答强有力的调节器,由肿瘤细胞或者肿瘤细胞浸润淋巴细胞所引起的细胞因子异常表达一定程度上有利于肿瘤的生长,同时抑制浸润淋巴细胞的细胞毒杀伤作用。对原发肿瘤微环境中生物标记物,特别是一些细胞因子表达状态的检测结果,可以真实反映在疾病初期时肿瘤的免疫抑制能力和免疫系统抗肿瘤能力之间的对比,因此分析肿瘤免疫微环境中的细胞因子表达水平,有利于观察、理解肿瘤的生物行为,并可能作为预后指标指导肿瘤患者的诊断、治疗[5]。
IL-2在临床中已用于乳腺癌的治疗[6],但是关于IL-2在早期乳腺癌组织中的表达及其与乳腺癌预后的关系尚鲜有报道。本研究旨在探讨IL-2蛋白在乳腺癌肿瘤组织中的表达对乳腺癌预后的影响。
对象和方法
1 研究对象 收集2000年1月- 2002年12月在解放军总医院接受手术的具有完整临床资料、随访资料及病理标本的Ⅰ~Ⅲ期女性乳腺癌患者手术切除的组织样本。剔除病理证实为淋巴瘤的患者1例;剔除在本院进行手术前已在外院将原发肿瘤切除活检及术前接受化疗、放疗、免疫治疗的患者。符合上述要求患者共130例被纳入本研究。
2 信息采集及随访方法 整理患者的临床病理资料及辅助治疗资料:年龄、月经状况、手术方式、病理类型、肿瘤大小、淋巴结转移数目、临床分期、SBR分级、脉管癌栓、雌激素受体(estrogen receptor,ER)表达、孕激素受体(progesterone receptor,PR)表达、HER-2表达、Ki-67百分比、分子分型、术后辅助化疗方案及周期数、内分泌治疗用药及维持时间、放射治疗时间及部位。并记录复发转移的时间、部位以及死亡时间。计算无病生存期(disease free survival,DFS)、无远处转移生存期(distant disease free survival,DDFS)、总生存期(overall survival,OS)及生存率。DFS为手术至出现局部(患侧乳腺或皮下、胸壁转移、患侧乳腺局域淋巴结引流区淋巴结转移)和(或)远处复发转移的时间;DDFS为手术至出现远处复发转移的时间;OS为手术至任何原因导致死亡的时间。
3 免疫组化及结果判读方法 对130例病人的肿瘤组织切片进行免疫组化染色。组织切片由2位独立的病理医师(对临床和预后情况不知晓)分别进行分析,核对所得结果,获得共识。IL-2阳性细胞计数方法如下:LEICA DM2000显微镜下全片随机取30个不重复高倍视野(400×),镜下计数肿瘤间质阳性细胞数,得出平均每个高倍视野的阳性细胞数并除以高倍视野面积(0.31 mm2),得出平均每1 mm2阳性细胞数,即IL-2间质细胞密度。
4 统计学方法 使用SPSS19.0软件对数据进行统计学处理。所得实验参数为连续变量,各参数之间的相关性、实验参数与乳腺癌临床病理参数的相关性采用Spearman秩和检验。年龄、Ki-67分别按照中位数分为两组并赋值。IL-2间质细胞密度依DDFS绘制ROC曲线,在曲线下面积最大处选取截点值,按所选节点值分为低表达与高表达两组并赋值。生存分析选用Kaplan-Meier法,单因素分析显著性检验选用Log-rank检验,多因素生存分析采用COX风险比例模型。以P<0.05为差异有统计学意义。
结 果
1 随访结果 最后随访日期为2012年7月3日,中位随访时间112(7.7 ~ 138.6)个月。130例乳腺癌患者,中位年龄48(25 ~ 80)岁,肿瘤中位大小3(0.7 ~ 12.0) cm。118例患者接受了改良根治术,12例患者行保乳切除术。80例患者接受了术后辅助放疗,104例患者接受辅助化疗,术后接受辅助内分泌治疗者71例。所有患者均未接受新辅助放化疗和辅助靶向治疗。具体见表1。至随访截止时,33例出现局部复发和(或)转移,31例出现远处转移,29例死亡;无病生存率74.6%,无远处转移生存率76.2%,总生存率77.7%。
2 乳腺癌临床病理特征与DFS、DDFS、OS的关系 在单因素分析中,DFS与临床分期、年龄、SBR分级、癌栓、HER2、Ki-67、分子分型相关;DDFS与临床分期、SBR分级、癌栓、HER2、Ki-67、分子分型相关;OS与临床分期、SBR分级、癌栓、HER2、Ki-67、ER、PR、分子分型相关(表2)。而COX多因素生存分析显示,临床分期、SBR分级、HER-2均是DFS、DDFS与OS的独立预后预测因素(表3)。
3 IL-2在乳腺癌组织中的免疫组织化学染色结果IL-2主要表达在部分间质细胞的细胞质,这些IL-2阳性的间质细胞呈淋巴细胞形态(图1)。对IL-2间质细胞密度绘制ROC曲线,选取截点值为45.48。IL-2间质细胞密度以45.48为界(曲线下面积0.589,敏感度0.303,特异度0.935)分为高表达组与低表达组。
4 乳腺癌间质中IL-2的表达与临床病理特征的关系 IL-2间质细胞密度分组与T分期呈负相关(Spearman,相关系数-0.197,P=0.025),与临床分期、SBR分级、分子分型、癌栓、ER、PR、HER2、Ki-67、月经状况等的相关性均无统计学意义。见表1。
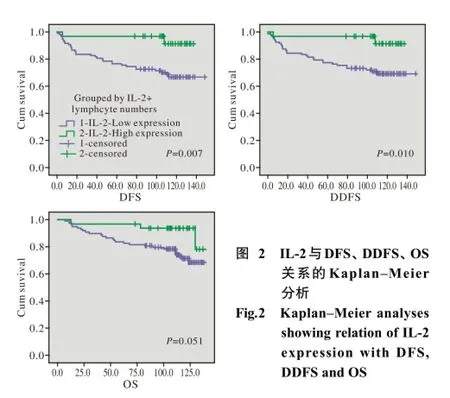
5 IL-2在乳腺癌肿瘤浸润淋巴细胞中的表达与DFS、DDFS、OS的关系 对130例患者进行单因素Kaplan-Meier分析,显示IL-2间质密度分组与预后相关:IL-2间质细胞密度低表达组与高表达组的平均DFS分别为113.09±5.54个月、131.40± 4.27个月;平均DDFS分别为114.88±5.48个月、131.4±4.27个月;平均OS分别为115.63±4.21个月、130.24±4.26个月,经Log-rank检验,IL-2间质细胞密度高表达组DFS、DDFS均优于低表达组(P=0.007、P=0.010),两组患者的OS差异无统计学意义(P=0.051)(图2)。而在加入年龄分组、临床分期、SBR分级、癌栓、ER、PR、HER2、Ki-67分组的COX多元分析中,IL-2间质细胞密度分组是DFS、DDFS、OS的独立预后预测因素,IL-2间质细胞密度高表达组复发转移风险和死亡风险均较低表达组低(表3)。
讨 论

表1 乳腺癌患者的临床病理特征及治疗情况Tab. 1 Clinicopathologic features and treatment of breast cancer patients
IL-2是Th1类细胞因子,主要由Th1淋巴细胞产生。活化的DC细胞、NK细胞和NKT细胞也可以产生IL-2,但是其生物学关联尚不清楚[7-9]。IL-2通过与细胞膜上的IL-2受体(IL-2R)结合来发挥其生物活性。IL-2R受体复合体包含的亚基不同[α链(55 kU),β链(75 kU)和γ链(64 kU)],与IL-2的亲和力也不同,包括低亲和力的IL-2Ra,中、高亲和力IL-2Raβγ。高亲和力IL-2R主要存在于活化的T、B淋巴细胞及NK细胞,NK细胞(静止状态)表达低水平的CD56抗原及IL-2Rβγ。静止状态的巨噬细胞亦表达中等亲和力IL-2R,低亲和力IL-2R仅表达在静止状态的T细胞。IL-2R有两种存在形式,一种是与细胞膜结合的IL-2R(mIL-2R),另一种是IL-2R释放到血液及其他体液中成为可溶性形式(sIL-2R)[10-11]。目前认为淋巴细胞中存多条IL-2信号转导途径,例如Jak-STAT通路、Ras-Raf-MAP途径、丝裂原活化蛋白激酶(mitogen activated protein kin-ase,MAPK)途径、磷酸酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)信号传导途径等[12]。IL-2可以产生以下作用:1)诱导活化T淋巴细胞的增殖;2)促进CTL细胞的分化、激活NK细胞、巨噬细胞等效应细胞产生杀灭肿瘤细胞作用;3)刺激T淋巴细胞产生肿瘤坏死因子(tumor neerosis factor,TNF)等免疫增强因子,间接增强B淋巴细胞、NK细胞、巨噬细胞等效应细胞产生杀灭肿瘤细胞作用[13-15]。IL-2的浓度的降低可以减弱CD4+细胞的功能。同样,IL-2的减少也会影响免疫信息向CTL细胞的传递,从而减弱CTL细胞对肿瘤细胞的杀伤能力[16]。

表2 130例患者的COX单因素生存分析Tab. 2 COX univariate analysis showing survival in 130 patients

表3 130例患者的多因素COX生存分析Tab. 3 COX multivariate analysis showing survival in 130 patients

图 1 IL-2在乳腺癌组织中的免疫组织化学染色情况Fig. 1 Immunohistochemical staining showing low (A) and high (B) IL-2 expression in breast cancer tissue
本研究在早期乳腺癌组织间质中观察到大量IL-2阳性淋巴细胞浸润。Camp等[17]对89例乳腺癌组织切片与14例良性乳腺病变组织切片的免疫组化染色分析研究显示,乳腺癌组织中肿瘤浸润淋巴细胞产生的IL-2水平超出后者。说明可能在肿瘤发生时,机体免疫水平上调以发挥抗肿瘤作用。本研究深入分析了IL-2在肿瘤细胞的表达与各临床病理特征的关系,IL-2阳性淋巴细胞的浸润强度与肿瘤T分期负相关(P=0.025),这与Elsässer-Beile等[18]对原发乳腺癌患者全血细胞培养分析,IL-2表达水平与肿瘤负荷量呈负相关的研究结果一致,也有研究发现,新辅助化疗后肿瘤负荷减少,外周血IL-2 CD25细胞百分比较前明显提高[19]。
本研究进一步的单因素与多因素生存分析认为IL-2间质细胞密度分组是DFS、DDFS、OS的独立保护性预后预测因素,IL-2间质密度较低的患者更容易出现复发转移,死亡风险也更高。既往有研究显示:IL-2在血清中的表达水平与患者乳腺癌的复发率呈负相关[20-21]。Muraro和Saglam等[22-23]的研究都发现血清IL-2表达水平在Her-2阴性的乳腺癌患者中低于正常人与Her-2阳性乳腺癌患者。所以乳腺癌间质IL-2阳性淋巴细胞的浸润水平具有预后预测价值。
1 Yomogida K, Chou Y, Pang J, et al. Streptavidin suppresses T cell activation and inhibits IL-2 production and CD25 expression[J]. Cytokine, 2012, 58(3): 431-436.
2 Chu D, Lu J. Novel therapies in breast cancer: what is new from ASCO 2008[J]. J Hematol Oncol, 2008, 1:16.
3 Watanabe MA, Oda JM, Amarante MK, et al. Regulatory T cells and breast Cancer: implications for immunopathogenesis[J]. Cancer Metastasis Rev, 2010, 29(4): 569-579.
4 Pagès F, Galon J, Dieu-Nosjean MC, et al. Immune infiltration in human tumors: a prognostic factor that should not be ignored[J]. Oncogene, 2010, 29(8):1093-1102.
5 Kim ST, Jeong H, Woo OH, et al. Tumor-infiltrating lymphocytes,tumor characteristics, and recurrence in patients with early breast Cancer[J]. Am J Clin Oncol, 2013, 36(3): 224-231.
6 Carpi A, Nicolini A, Antonelli A, et al. Cytokines in the management of high risk or advanced breast cancer: an update and expectation[J]. Curr Cancer Drug Targets, 2009, 9(8):888-903.
7 Geng X, Zhang R, Yang G, et al. Interleukin-2 and autoimmune disease occurrence and therapy[J]. Eur Rev Med Pharmacol Sci,2012, 16(11):1462-1467.
8 Attridge K, Wang CJ, Wardzinski L, et al. IL-21 inhibits T cell IL-2 production and impairs Treg homeostasis[J]. Blood, 2012, 119(20):4656-4664.
9 Yui MA, Sharp LL, Havran WL, et al. Preferential activation of an IL-2 regulatory sequence transgene in TCR gamma delta and NKT cells: subset-specific differences in IL-2 regulation[J]. J Immunol, 2004, 172(8):4691-4699.
10 Ma D, Cao W, Kapur A, et al. Differential expression of proteins in naïve and IL-2 stimulated primary human NK cells identified by global proteomic analysis[J]. J Proteomics, 2013, 91C:151-163.
11 Wong WF, Kurokawa M, Satake M, et al. Down-regulation of Runx1 expression by TCR signal involves an autoregulatory mechanism and contributes to IL-2 production[J]. J Biol Chem, 2011, 286(13):11110-11118.
12 Basquin C, Sauvonnet N. Phosphoinositide 3-kinase at the crossroad between endocytosis and signaling of cytokine receptors[J]. Commun Integr Biol, 2013, 6(4):e24243.
13 Kang TH, Mao CP, He L, et al. Tumor-targeted delivery of IL-2 by NKG2D leads to accumulation of antigen-specific CD8+ T cells in the tumor loci and enhanced anti-tumor effects[J]. PLoS One, 2012,7(4):e35141.
14 Weiss JM, Ridnour LA, Back T, et al. Macrophage-dependent nitric oxide expression regulates tumor cell detachment and metastasis after IL-2/anti-CD40 immunotherapy[J]. J Exp Med, 2010, 207(11):2455-2467.
15 Gaffen SL, Liu KD. Overview of interleukin-2 function, production and clinical applications[J]. Cytokine, 2004, 28(3): 109-123.
16 Blidaru A, Bordea CI, Viişoreanu CG, et al. Interleukin-2 alterations in the immune status of patients with mammary neoplasm[J]. Rom J Physiol, 1998, 35(1-2): 127-134.
17 Camp BJ, Dyhrman ST, Memoli VA, et al. In situ cytokine production by breast Cancer tumor-infiltrating lymphocytes[J]. Ann Surg Oncol, 1996, 3(2): 176-184.
18 Elsässer-Beile U, von Kleist S, Sauther W, et al. Impaired cytokine production in whole blood cell cultures of patients with gynaecological carcinomas in different clinical stages[J]. Br J Cancer, 1993, 68(1):32-36.
19 Murta EF, de Andrade JM, Falcão RP, et al. Lymphocyte subpopulations in patients with advanced breast Cancer submitted to neoadjuvant chemotherapy[J]. Tumori, 2000, 86(5): 403-407.
20 Arduino S, Tessarolo M, Bellino R, et al. Reduced IL-2 level concentration in patients with breast Cancer as a possible risk factor for relapse[J]. Eur J Gynaecol Oncol, 1996, 17(6): 535-537.
21 Mortarini R, Vegetti C, Molla A, et al. Impaired STAT phosphorylation in T cells from melanoma patients in response to IL-2: association with clinical stage[J]. Clin Cancer Res, 2009,15(12): 4085-4094.
22 Muraro E, Martorelli D, Turchet E, et al. A different immunologic profile characterizes patients with HER-2-overexpressing and HER-2-negative locally advanced breast cancer: implications for immunebased therapies[J]. Breast Cancer Res, 2011, 13(6):R117.
23 Saglam S, Suzme R, Gurdol F. Serum tumor necrosis factor-alpha and interleukin-2 concentrations in newly diagnosed ERBB2 (HER2/ neu) positive breast Cancer patients[J]. Int J Biol Markers, 2009,24(3): 142-146.
Expression of IL-2 in human early breast cancer tissue and its prognostic value
LI Ying1, YU Hai-ming1, YANG Jun-lan1, JIAO Shun-chang1, SI Wen21Department of Medical Oncology, Chinese PLA General Hospital, Beijing 100853, China;2Nankai University, Tianjin 300071, China Corresponding author: YANG Jun-lan. Email: yangjunlan301@sina.cn
ObjectiveTo study the relation between expression of IL-2 in breast cancer tissue and clinicopathological characteristics and prognosis of breast cancer. MethodsClinical data about 130 patients with stages Ⅰ-Ⅲ breast cancer admitted to our hospital from January 2000 to December 2002 were retrospectively analyzed and their paraffn sections were collected. Relation between expression of IL-2 detected with immunohistochemical staining and clinicopathological features and prognosis of breast cancer was analyzed. ResultsThe IL-2 was mainly expressed in mesenchymal lymphocytes of breast cancer. The IL-2 expression levels of disease-free survival (DFS) and distant disease-free survival (DDFS) were signifcantly higher in high density IL-2 mesenchymal cells than in low density IL-2 mesenchymal cells (P<0.05). The overall survival (OS, HR=0.301, P=0.059), DFS(HR=0.156, P=0.012)and DDFS(HR=0.171, P=0.018)were the independent predicting factors for high density IL-2 mesenchymal cells. ConclusionExpression of IL-2 in breast cancer tissue can predict the prognosis of breast cancer. Relapse and metastasis of breast cancer are related with the high death rate in breast cancer patients with a low IL-2 expression level.
breast neoplasms; interleukin-2; prognosis
R 737.9
A
2095-5227(2014)02-0161-05
10.3969/j.issn.2095-5227.2014.02.019
2013-10-12 11:15
http://www.cnki.net/kcms/detail/11.3275.R.20131012.1115.003.html
2013-08-12
卫生部吴阶平医学基金项目(320.6752.1230GB001)
李莹,女,在读硕士。研究方向:乳腺癌的内科治疗。Email: liyingpla@126.com;共同第一作者:于海明,女,在读博士,主治医师。研究方向:恶性肿瘤的免疫治疗。Email: xiaooyu @hotmail.com
杨俊兰,女,主任医师,教授。Email: yangjunlan301@ sina.cn

