铁代谢在术后认知功能障碍发病机制中作用的研究进展
朱 丹 综述 李文瑶,易 斌,陶国才 审校
第三军医大学附属西南医院 手术麻醉科,重庆 400038
铁代谢在术后认知功能障碍发病机制中作用的研究进展
朱 丹 综述 李文瑶,易 斌,陶国才 审校
第三军医大学附属西南医院 手术麻醉科,重庆 400038
术后认知功能障碍(postoperative congnitive dysfunction,POCD)是老年人麻醉手术的研究热点,表现为近期记忆、思维集中能力、语言理解的受损。POCD发病原因以及发病机制尚不清楚,然而炎症因子中铁调素(hepcidin)的产生及铁的代谢对术后认知功能的影响是目前研究的热点。现将其研究现状作一综述。
术后认知功能障碍、铁调素、铁蛋白
既往研究已经证实术后认知功能障碍(postoperative congnitive dysfunction,POCD)可发生于不同类型手术;患者年龄是其中最重要的危险因素[1-4],然而具体机制不明。近年的多项研究表明,铁的沉积以及铁调素的表达变化可能在老年患者POCD的发病机制中有重要的作用[5];本文就铁调素与铁在术后认知功能障碍中的研究进展综述如下。
1 POCD简介及分子机制研究近况
术后认知功能障碍是指在手术和麻醉后出现认知功能的恶化,表现为记忆、语言、视空间觉能力、计算能力、解决问题能力的下降。现已经证实术后认知功能障碍的发病率与年龄密切相关[1-2],而能诱导POCD发生的因素很多,如麻醉、手术、低氧及贫血等[1]。目前POCD的发病机制尚不清楚,现大多倾向于神经递质学说及炎症因子学说。在此背景下,通过对全麻手术后的认知功能研究进一步揭示了铁代谢的作用机制。
1.1 神经递质学说 神经递质:分为单胺类、氨基酸类、乙酰胆碱类神经递质。乙酰胆碱是参与学习和记忆的一种重要的神经递质,随着年龄的增加,乙酰胆碱酯酶与胆碱乙酰转移酶的分泌不平衡,导致了乙酰胆碱的分泌紊乱,因此,推测术后认知功能障碍和老年性生理性退变拥有一条“共同通路”[2]。
1.2 炎症因子学说 手术及麻醉相关因素都会产生炎症介质,其中以IL-1、IL-6、TNF-α对术后认知功能有强烈的影响[3]。而炎症因子又会刺激Aβ淀粉样蛋白酶的产生,进一步刺激胶质细胞的产生[4]。随着年龄的增加,脑部皮质层逐渐萎缩,保护性因素(如神经营养因子)小于损伤性因素。所以,在老龄阶段,随着大脑皮质、海马的小胶质细胞、星形胶质细胞的激活,会使更多的神经细胞元变性坏死,从而促使老年斑的形成,最终发展为阿尔茨海默病。而炎性因子以及应激介导的淀粉样蛋白酶(Aβ)的产生导致神经细胞变性坏死的机制可能是术后认知功能障碍和阿尔茨海默病的一条“共同通路”。但是胶质细胞是怎样作用于神经细胞变性坏死的机制仍然不清楚。现认为:1)Aβ具有氧化还原性,极易与神经元内Fe3+发生氧化还原作用,产生过多的氧自由基; 2)Aβ在细胞内聚集化或寡聚化,产生细胞毒性[6-10]。现推测:1)POCD是一个短而急的过程,而AD是缓慢发展的炎性过程,那么POCD是刺激了AD发生发展的一个重要因素吗? 2)Aβ与Fe3+还原为Fe2+,导致储存在胶质细胞中的Fe3+减少,氧自由基增多,神经元损伤,是否术后病人游离的Fe2+增多,Fe3+减少?这还有待进一步研究; 3)IL-6等炎症因子会引起Hepcidin增加,进一步导致膜转运蛋白(FP1)减少,最后导致铁吸收及释放减少,而贫血对Hepcidin有抑制作用,那么当炎症介质与贫血同时存在时,Hepcidin的调节是怎样的,哪种因素占主导地位?这还有待继续研究。
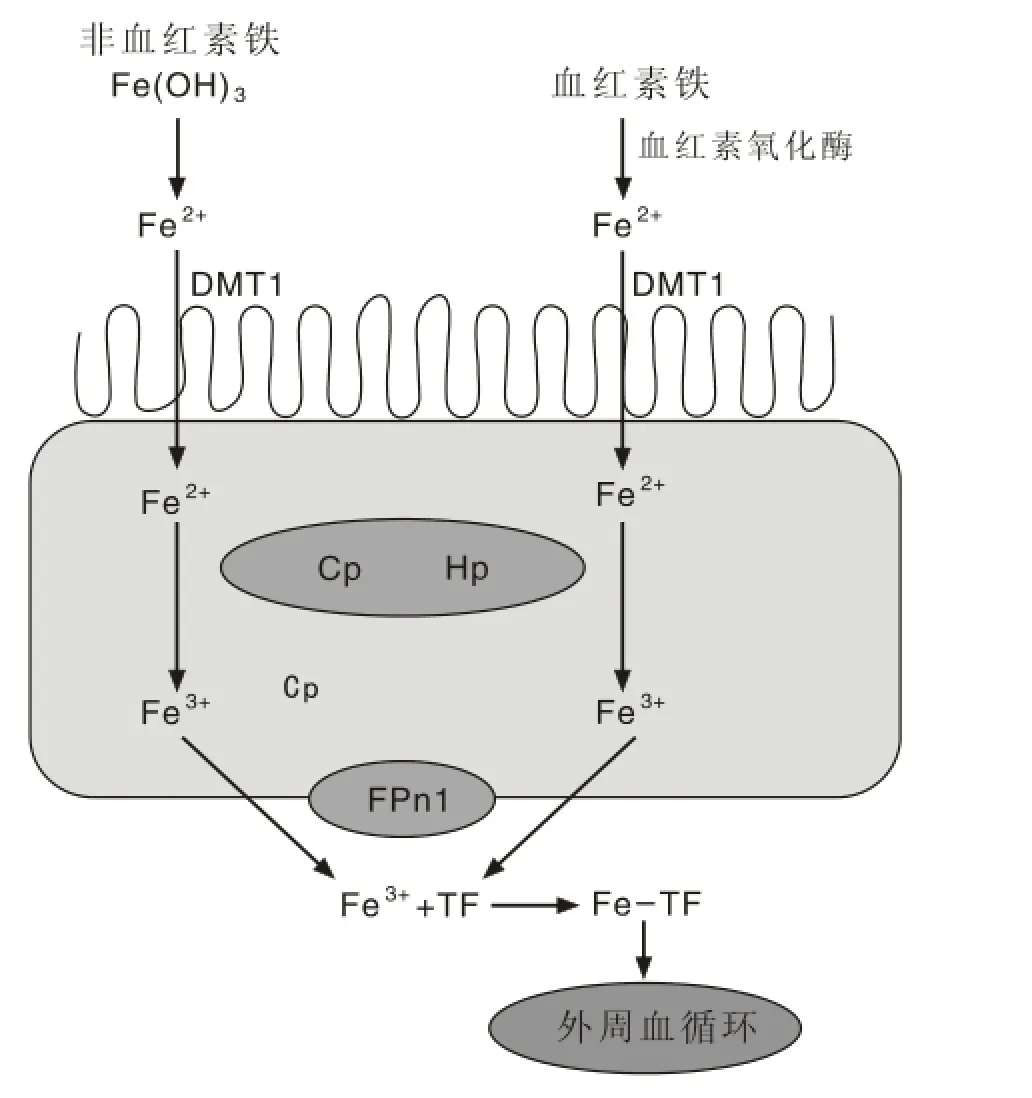
图 1 肠道铁转运机制Fig. 1 Iron transport in intestine
2 脑铁的生理代谢
在生理状态下,脑组织所需铁来源于外周血液,而血脑屏障是位于脑组织与血液间的一道天然屏障,在脑铁代谢中处于核心地位。血脑屏障由星形胶质细胞的终足(神经胶质膜)、毛细血管内皮细胞及其基膜组成。
2.1 脑内铁浓度随年龄而变化 随年龄的增加,脑铁代谢可以发生改变,脑内总铁含量可增加数倍,过多的铁以铁蛋白的形式选择性积累在胶质细胞内。而游离铁能诱发的氧化应激损伤可导致记忆和认知的损害[11-14]。Qian等[15]对大鼠的研究表明,在出生后2 d,大脑皮质、小脑、脑桥和中脑中的铁浓度最高,以后逐渐降低,到17 d时降到最低,然后再逐渐升高到成年水平(75 d)。在大脑不同区域,铁含量也不同。在皮质中,运动皮质的含铁量最高;其次是视、听和顶皮质; 而额前区和颞叶铁浓度最低。延髓中铁的含量不随年龄增长而增多,除了贫血能引起肝和脑内含铁量均下降以外,正常情况下脑铁水平与肝铁水平相关性不大。脑内铁的转换比肝慢,因此,在营养性铁缺乏时,血清铁结合能力和肝中铁贮存都大幅度降低,而脑铁水平则能维持相对平衡[15]。
2.2 铁的代谢机制(外周-脑铁循环) 铁来源于非血红素铁和血红素铁[16],非血红素铁在十二指肠细胞色素B的作用下还原成亚铁离子,再通过二价金属转运体(divalent metal transporter 1,DMT1)进入小肠上皮细胞胞质[11],亚铁离子通过铜蓝蛋白(ceruloplasmin,CP)和亚铁氧化酶(hephaestin,HP)的作用氧化成Fe3+,最后在膜铁转运蛋白(ferroportin 1,FP1)的作用下从上皮细胞基底膜侧转运出,Fe3+再与转铁蛋白(transferrin,TF)结合形成铁-转铁蛋白复合体; 血红素铁在血红素氧化酶的作用下还原为Fe2+之后直接进入内皮细胞的胞质中,而血红素铁出上皮细胞途径同非铁转运蛋白结合,形成铁-非转铁蛋白复合物,从而进入外周血循环[16],见图1。其中非转铁蛋白包括可溶性乳铁蛋白,黑色素转铁蛋白复合体。
转铁蛋白受体(transferrin receptor,TFR)存在于内皮细胞表面,外周循环铁转铁蛋白复合物与转铁蛋白受体结合,通过细胞内吞作用进入脑的毛细血管内皮细胞,铁-转铁蛋白-转铁蛋白受体形成内吞小泡,进入内皮细胞后在酸性刺激下,Fe3+被分离出来,并被氧化成为亚铁离子,再通过二价金属转运体、铜蓝蛋白、亚铁氧化酶、膜铁转运蛋白的作用下以Fe3+出内皮细胞进入脑间质中。非转铁蛋白复合物不需要与受体结合进入脑内皮细胞,进入内皮细胞的非转铁蛋白复合物在内皮细胞中以及出内皮细胞的作用机制同转铁蛋白受体复合物途径。脑内铁的分布比较广泛,神经元、小胶质细胞、少突胶质细胞和某些星形胶质细胞都含有大量的铁,而以少突胶质细胞中含铁量最多[17]。
2.3 脑中铁的转运及储存 进入脑间质的铁-转铁蛋白主要通过转铁蛋白-转铁蛋白受体途径储存在神经元和少突胶质细胞中。由于星形胶质细胞中转铁蛋白受体含量稀少,非转铁蛋白结合铁通过非转铁蛋白途径储存在星形胶质细胞中[11]。研究发现在人类大脑皮质下的区域内,尤其是在基底节灰质中发现有铁蛋白阳性的星形胶质细胞,并随着年龄增加铁蛋白(ferritin,Fn)逐渐增多[11]。正常情况下星形胶质细胞含有较少的铁蛋白,应用铁螯合剂可使这种低水平的Fn消失。然而,给予柠檬酸铁铵、血红蛋白、血色素或硫酸亚铁几小时后培养的星形胶质细胞内Fn含量就急剧升高。除了受铁含量的调节外,培养的星形胶质细胞中铁蛋白在缺氧、缺血再灌注时也表达升高[18]。此外,星形胶质细胞还可以通过受体介导的胞吞作用摄取外界的脱铁铁蛋白,继续提高其储铁能力[19-20]。星形胶质细胞内的铁蛋白升高其实是一种细胞保护性反应,使细胞免于Fenton反应介导的羟自由基引起的氧化应激损伤[7]。
2.4 脑铁的调节 脑铁浓度的调节目前主要通过转铁蛋白、铁蛋白来调节,大致可归纳如下: 1)脑铁以铁-转铁蛋白,铁-铁蛋白,铁-乳铁蛋白经脑脊液回流入外周血; 2)小胶质细胞及其他具有吞噬功能的细胞也参与了中枢铁的清除; 3)炎症因子IL-6等、Fe超载、USF2、HJV基因,将会对Hepcidin表达增加,进一步下调FPN1、DMT1、TFR1的表达,上调铁蛋白的表达,最后导致铁吸收和铁释放减少[13,21]; 4)随着年龄增加,在脑部皮质层、海马和纹状体,Hepcidin的表达上调[13],从而导致铁储存在铁蛋白中; 5)贫血对Hepcidin有抑制作用,最后导致铁的吸收和铁释放增多; 6)Hepcidin的过表达会是血铁少和炎症性贫血[22]; 7)Hepcidin与转铁蛋白结合,使其内化,从而抑制铁的吸收和铁的释放[13,22]。所以,上述任何环节出现异常情况时均会造成铁代谢的失衡。
3 铁代谢在POCD中的作用
3.1 铁缺乏和铁沉积 铁缺乏和铁过量都会导致细胞和器官功能障碍。低浓度的血浆铁将限制铁吸收和血红蛋白合成,从而导致贫血。在另一方面,血浆中含铁浓度高超过了转铁蛋白结合的能力。非转铁蛋白结合铁被肝细胞摄取和其他实质细胞摄取,迄今为止该途径还未研究清楚。在人体中,铁沉积将会导致细胞和组织的损害和活性氧的产生(依赖于铁沉积的速率和铁积累的程度)。心脏和内分泌组织损伤是铁快速和缓慢积聚在肝细胞的特点。实验室动物模型中,除了长爪沙鼠[8],出现了耐铁毒性。这些不同的分子基础的毒性仍有待研究。
3.2 手术刺激与Hepcidin 长期以来,科研人员一直推测机体内存在着调节铁稳态的类似激素样物质,具有血浆可溶性成分,并且可感知机体的铁状况,从而可在铁的吸收、利用和储存等不同铁池间进行信号传递[23-25]。Pigeon等通过对铁超负荷小鼠模型的研究,第一次阐明机体铁代谢状况与Hepcidin之间存在着密切联系。随后Nicolas等[26]也发现肝脏缺乏Hepcidin基因表达的小鼠形成了严重的组织铁超负荷。此外,Fleming和Sly[27]提出Hepcidin表达增加可出现循环铁降低,肠道铁吸收减少,网状内皮系统单核巨噬细胞内铁增加的现象,故推测Hepcidin直接抑制铁从网状内皮系统单核巨噬细胞的释放。所有这些结果均证实Hepcidin作为一种铁调激素在机体铁稳态调控方面发挥着重要作用。
在手术刺激下,大量炎症细胞因子的产生,导致Hepcidin的表达上调[28],但神经元内并没有铁蛋白的积累[29],而转铁蛋白的表达下调,现推测转铁蛋白不能运载过多的铁,多余的铁不能完全被神经元利用,所以神经元很容易受到自由铁离子的损害[30],从而影响认知功能。
3.3 手术刺激下铁蛋白的表达 铁蛋白是储存铁的场所,分为3型: H-ferritin,L-ferritin,M-ferritin,在脑组织中,M型存在于线粒体中,H型铁蛋白主要存在于神经元中,而L型铁蛋白主要存在于神经胶质细胞中,在脑铁平衡中起着不同的作用[31]。研究发现,帕金森病、阿尔茨海默病、亨廷顿病等神经退行性疾病患者脑组织Fn的表达增加[32],而不安腿综合征患者脑内Fn表达降低[33],那么术后认知功能障碍是否与铁蛋白表达增加有关?
手术中的刺激是导致机体分泌大量的细胞因子的原因之一,炎症因子进一步使Hepcidin的表达上调,从而刺激铁蛋白的表达上调和外周铁的减少,随着手术及麻醉时间的延长,炎症因子不断地刺激Hepcidin的产生,这也许是炎症性贫血的因素之一。而Hepcidin的产生会与转铁蛋白相结合,并使转铁蛋白发生内化,丧失了转铁蛋白的功能,因此转铁蛋白不能与铁相结合,既不能使铁转运出细胞外也不能使铁转入细胞内,所以导致了铁的相对增加。而铁是参加线粒体氧化还原反应的必要元素,适量的铁可以使线粒体所产生的氧自由基被破坏,从而不会导致氧化还原反应。但是过多的铁则会产生氧自由基,而H型铁蛋白在脑组织中主要存于神经元中,其主要作用是组织细胞摄取的Fe2+在铁蛋白外壳被氧化为Fe3+。所以,可以推测,如果大量的Fe2+产生,而铁蛋白来不及氧化,那么Fe2+进一步损伤神经元,导致发生术后认知功能障碍。
由于一系列手术炎症的刺激,导致了Hepcidin的表达上调,进一步抑制了巨噬细胞中铁的释放和肠道中铁的吸收,减少了外周铁的浓度,Hepcidin的调节虽然可以使外周铁减少,但同时也能使铁过度沉积在小胶质细胞中,引起小胶质细胞的过度激活,最后损伤神经元。在大脑中,由于Hepcidin的刺激,引起铁蛋白的异常表达,而多余的铁能进一步储存在小胶质细胞中。矛盾的是Hepcidin不仅能使铁蛋白的表达增加,而且也能使转铁蛋白表达减少,转铁蛋白需要与铁相结合才能到达胶质细胞中与铁蛋白储存,既然转铁蛋白的表达减少了,而铁的含量相对于转铁蛋白来说是增加的,那么铁又是靠什么物质转运到胶质细胞中与铁蛋白结合的呢?或者是铁蛋白不仅有储存的能力,还有结合的能力吗?既然铁相对增加,那么是不是由于在胶质细胞外的铁增加导致了铁参与了氧化应激的反应,最后导致了神经元损伤,患者表现为认知功能障碍。所以,为了预防术后认知功能障碍?应进一步研究: 1)人工注入铁的螯合剂以及Hepcidin是否可以阻断铁的释放; 2)IL-6等炎症因子会导致Hepcidin的增多,最后导致铁的吸收减少和释放减少; 3)Aβ会刺激星形胶质细胞和小胶质细胞的激活,究竟是激活了胶质细胞的哪条通路,是铁释放还是炎症因子引起的神经细胞变性坏死,最后导致神经细胞损伤。
4 展望
现阶段对于POCD的老年患者并没有诊断的金标准,除了神经内科与之相关的量表以外,单纯用量表测量病人以判断是否患有术后认知功能障碍,不管是对病人还是对测量医生来说主观性差异都很大,所以,现阶段还没有客观指标反映术后认知功能障碍。铁代谢对于人体来说只有输入的调节通路,没有输出的调节通路,当铁异常沉积引起一系列认知功能疾病时,我们需要从病因上来预防认知功能障碍的疾病。目前还有许多关键性问题尚未解决,如在手术创伤下,Hepcidin调节铁代谢的分子机制。因此,探索Hepcidin对铁代谢调控机制,不仅能够丰富铁代谢调节的理论知识,而且对于临床诊断和药理应用,都将为POCD的防治提供全新思路。
1 Bedford PD. Adverse cerebral effects of anaesthesia on old people[J]. Lancet, 1955, 269(6884):259-263.
2 Van Dijk D, Jansen EW, Hijman R, et al. Cognitive outcome after off-pump and on-pump coronary artery bypass graft surgery: a randomized trial[J]. JAMA, 2002, 287(11):1405-1412.
3 Monk TG, Weldon BC, Garvan CW, et al. Predictors of cognitive dysfunction after major noncardiac surgery[J]. Anesthesiology,2008, 108(1):18-30.
4 Stern Y. What is cognitive reserve? Theory and research application of the reserve concept[J]. J Int Neuropsychol Soc, 2002, 8(3):448-460.
5 Wang SM, Fu LJ, Duan XL, et al. Role of hepcidin in murine brain Iron metabolism[J]. Cell Mol Life Sci, 2010, 67(1): 123-133.
6 Gao XQ, Zhang ZY, Ma WH. Effects of electroacupuncture assistant general anesthesia on postoperative cognitive dysfunction of aged patients[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2012, 32(5):591-593.
7 Yang J, Ji M, Zhou Z, et al. Sphingosine kinase-signaling pathway:a possible therapeutic target for post-operative cognitive dysfunction[J]. Acta Anaesthesiol Scand, 2012, 56(2): 260-261.
8 Su X, Feng X, Terrando N, et al. Dysfunction of inflammationresolving pathways is associated with exaggerated postoperative cognitive decline in a rat model of the metabolic syndrome[J]. Molecular medicine (Cambridge, Mass.), 2012, 18(12): 1481-1490.
9 官杰,李浩, 刘剑刚. 炎症反应及抗炎药物与阿尔茨海默病的研究进展[J]. 中华神经医学杂志,2012,11(12):1282-1285.
10 Mandel S, Amit T, Bar-Am O, et al. Iron dysregulation in Alzheimer's disease: multimodal brain permeable Iron chelating drugs, possessing neuroprotective-neurorescue and amyloid precursor protein-processing regulatory activities as therapeutic agents[J]. Prog Neurobiol, 2007, 82(6): 348-360.
11 Connor JR, Menzies SL, St Martin SM, et al. Cellular distribution of transferrin, ferritin, and Iron in normal and aged human brains[J]. J Neurosci Res, 1990, 27(4): 595-611.
12 Dringen R, Bishop GM, Koeppe M, et al. The pivotal role of astrocytes in the metabolism of iron in the brain[J]. Neurochem Res, 2007, 32(11):1884-1890.
13 Fleming RE, Ponka P. Iron overload in human disease[J]. N Engl J Med, 2012, 366(4):348-359.
14 An LN, Yue Y, Guo WZ, et al. Surgical trauma induces Iron accumulation and oxidative stress in a rodent model of postoperative cognitive dysfunction[J]. Biol Trace Elem Res, 2013, 151(2):277-283.
15 Qian ZM, Pu Y, Wang Q, et al. Iron metabolism and CNSdiseases(chapter 17) [M]. Beijing: science press, 2000: 329-335.
16 Franchini M, Montagnana M, Lippi G. Hepcidin and iron metabolism: from laboratory to clinical implications[J]. Clin Chim Acta, 2010, 411(21-22):1565-1569.
17 杜宇,冯佑民,钱忠明.脑内的铁、转铁蛋白及转铁蛋白受体[J].生理科学进展,1999,30( 04):337-340.
18 Irace C, Scorziello A, Maffettone C, et al. Divergent modulation of Iron regulatory proteins and ferritin biosynthesis by hypoxia/ reoxygenation in neurones and glial cells[J]. J Neurochem, 2005,95(5): 1321-1331.
19 Regan RF, Kumar N, Gao F, et al. Ferritin induction protects cortical astrocytes from heme-mediated oxidative injury[J]. Neuroscience,2002, 113(4): 985-994.
20 Li Z, Chen-Roetling J, Regan RF. Increasing expression of H- or L-ferritin protects cortical astrocytes from hemin toxicity[J]. Free Radic Res, 2009, 43(6): 613-621.
21 Ganz T, Nemeth E. Hepcidin and iron homeostasis[J]. Biochim Biophys Acta, 2012, 1823(9):1434-1443.
22 Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular Iron efflux by binding to ferroportin and inducing its internalization[J]. Science, 2004, 306(5704): 2090-2093.
23 Rivera S, Nemeth E, Gabayan V, et al. Synthetic hepcidin causes rapid dose-dependent hypoferremia and is concentrated in ferroportin-containing organs[J]. Blood, 2005, 106(6):2196-2199.
24 Gao J, Chen J, De Domenico I, et al. Hepatocyte-targeted HFE and TFR2 control hepcidin expression in mice[J]. Blood, 2010, 115(16): 3374-3381.
25 Pigeon C, Ilyin G, Courselaud B, et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during Iron overload[J]. Biol Chem,2001, 276(11): 7811-7819.
26 Nicolas G, Chauvet C, Viatte L, et al. The gene encoding the Iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation[J]. J Clin Invest, 2002, 110(7): 1037-1044.
27 Fleming RE, Sly WS. Hepcidin: a putative iron-regulatory hormone relevant to hereditary hemochromatosis and the anemia of chronic disease[J]. Proc Natl Acad Sci U S A, 2001, 98(15):8160-8162.
28 Park KH, Sawada T, Kosuge T, et al. Surgical inflammation induces hepcidin production after abdominal surgery[J]. World J Surg,2012, 36(4): 800-806.
29 Youdium MBH. Brain iron: neurochemical and behavioral aspect[M] . London: Taylor and Francis, 1988: 2.
30 Gelman BB. Iron in CNS disease[J]. J Neuropathol Exp Neurol,1995, 54(4):477-486.
31 Ke Y, Ming Qian Z. Iron misregulation in the brain: a primary cause of neurodegenerative disorders[J]. Lancet Neurol, 2003, 2(4):246-253.
32 Simmons DA, Casale M, Alcon B, et al. Ferritin accumulation in dystrophic microglia is an early event in the development of Huntington’s disease[J]. Glia, 2007, 55(10): 1074-1084.
33 Haba-Rubio J, Staner L, Petiau C, et al. Restless legs syndrome and low brain Iron levels in patients with haemochromatosis[J]. J Neurol Neurosurg Psychiatry, 2005, 76(7): 1009-1010.
本刊“病例讨论”栏目征稿
本刊开辟“病例讨论”栏目,属原创性临床论文。
1.病例选择: 1)疑难病例,特别是涉及多学科、多领域的疑难病例; 2)容易误诊、漏诊且有经验教训的病例; 3)诊断明确,但病情危重、治疗棘手的病例; 4)罕见病例; 5)常见病例,但临床表现形式特殊。以上病例均须最终获得明确诊断或成功治疗,临床资料应齐全,能提供实验室、影像学和(或)病理确诊依据。
2.写作格式: 1)中英文摘要。无须按“目的”、“方法”、“结果”、“结论” 格式,简单介绍病例和诊治要点即可。2)正文含导语,设 “病例摘要” 和 “讨论” 两部分。“病例摘要”: 交代清楚患者主诉、病史(包括既往史)、实验室、影像学及病理学检查结果、临床诊断、治疗方案、治疗结果等。“讨论”: 能较好地体现正确的临床思维,对读者的临床工作有实际借鉴意义; 写清诊断和治疗思路、鉴别诊断要点、治疗上应注意的问题等,若为罕见病则介绍目前国内外的最新进展。3)列出相关的国内外主要参考文献。
Advances in iron metabolism underlying pathogenesis of postoerative cognitive dysfunction
ZHU Dan, LI Wen-yao, YI Bin, TAO Guo-cai
Department of Anesthesiology, Southwest Hospital, Third Medical University, Chongqing 400038, China Corresponding author: TAO Guo-cai. Email: 13908393339@vip.163.com
Postoperative cognitive dysfunction (POCD), a hot topic in anesthesia of elderly patients, is characterized by impairment of recent memory, thinking concentration ability and language comprehension. Although the causes and pathogenesis of POCD remain unclear, the effect of infammatory factor hepcidin and iron metabolism on it has become a hot topic. Following is a review of its current researches.
postoperative cognitive dysfunction; hepcidin; ferritin
R 348.4
A
2095-5227(2014)02-0193-04
10.3969/j.issn.2095-5227.2014.02.028
2013-11-26 09:06
http://www.cnki.net/kcms/detail/11.3275.R.20131126.0906.001.html
2013-07-30
国家自然科学基金项目(81171034)
Supported by the National Natural Science Foundation of China(81171034)作者简介:朱丹,女,医师,在读硕士。研究方向:术后认知功能障碍的发生机制及预防。Email: zd13752902138@163.com
陶国才,男,教授,主任医师,博士生导师。Email: 13 908393339@vip.163.com

