胃肠道神经内分泌瘤经内镜下治疗切缘残留的相关因素分析
温 静,卢忠生,杨 竞,刘庆森,杨云生,梁 浩
解放军总医院 消化科,北京 100853
胃肠道神经内分泌瘤经内镜下治疗切缘残留的相关因素分析
温 静,卢忠生,杨 竞,刘庆森,杨云生,梁 浩
解放军总医院 消化科,北京 100853
目的探讨胃肠道神经内分泌瘤经内镜下治疗切缘残留的相关因素。方法回顾性分析2002年2月- 2012年7月我院内镜中心118例胃肠道神经内分泌瘤内镜下治疗后切缘残留22例患者的临床资料。采用单因素分析研究各参数对切缘情况的影响,采用多因素Logistic回归分析确定切缘阳性的独立危险因素。结果切缘残留的22例,占18.6%。单因素分析提示切缘阳性组与切缘阴性组肿瘤浸润深度、术前是否明确诊断、内镜医师的工作年限差异有统计学意义。Logistic回归分析提示肿瘤浸润深度是切缘阳性的独立危险因素。结论内镜下治疗前诊断明确的由资深的专科医师操作完成且浸润深度限于黏膜下层以内的切缘阳性发生率低。
胃肠道神经内分泌瘤;内镜治疗;切缘癌残留
胃肠道神经内分泌瘤从组织学上较难判断其良恶性,主要依据肿瘤的浸润深度和有无转移。国内外学者普遍认为外科手术是直肠神经内分泌瘤治疗的最佳方法[1-3]。但同时承认内镜下局部占位病变切除也是直肠神经内分泌瘤重要的治疗方法之一[4-6]。但神经内分泌瘤呈浸润性生长,切缘阳性是内镜下切除经常遇到的问题之一,这对局部复发风险的评估及进一步治疗方案的制定都有重要意义。本文回顾性分析我院内镜下切除118例胃肠道神经内分泌瘤患者的临床及病理资料,评估内镜下治疗神经内分泌瘤切缘阳性的相关因素。
资料和方法
1 一般资料 2002年2月- 2012年7月我院内镜中心检查并内镜下治疗胃肠道神经内分泌瘤共118例,其中男性75例、女性43例,男女比例为1.7∶1。年龄16 ~ 80 (平均47.3)岁。临床症状主要为腹痛、腹泻、腹胀等。内镜下治疗后切缘残留22例,其中男性17例、女性5例,男女比例为3.4∶1,年龄17 ~ 61(平均46.5)岁。
2 内镜下治疗方法及病理检查 本组病灶直径在0.3 ~ 1.8 cm,平均0.7 cm。采用3种内镜下治疗方法切除肿瘤组织,包括圈套后电凝电切,内镜下黏膜切除术及内镜黏膜下剥离术。内镜下切除后标本留取待送病理检查,对可疑部位连续切片检查,基底部见肿瘤细胞或切缘与肿瘤细胞距离<0.2 cm确定为切缘残留。
3 统计学方法 统计学处理应用SPSS15.0统计软件,定量数据用±s表示,两组差异比较t检验,多组采用F检验,率的差异比较采用χ2检验。分析切缘阳性发生概率与各自变量间的关系采用非条件的Logistic回归模型。P<0.05为差异有统计学意义。
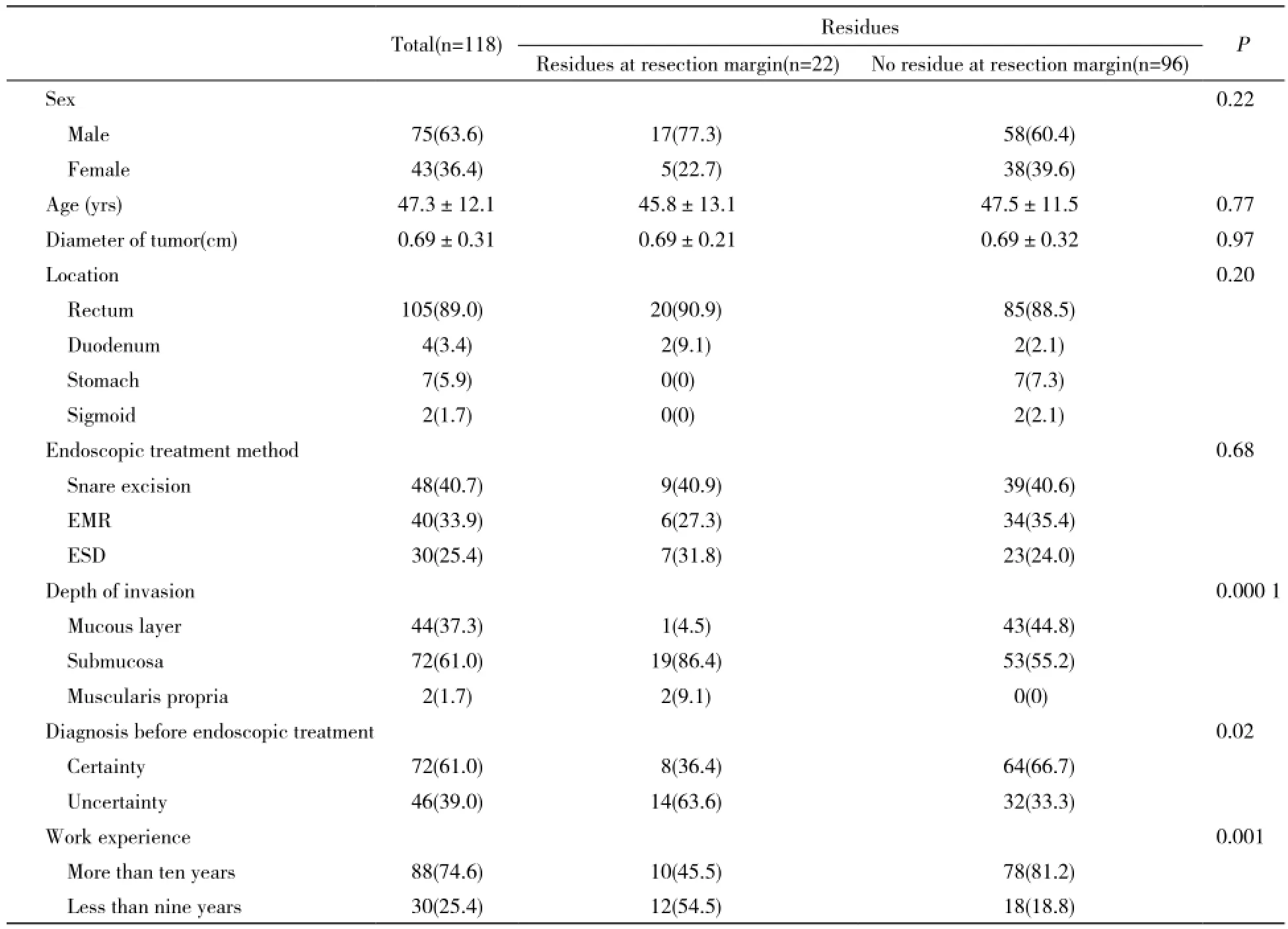
表 1 内镜下治疗切缘阴阳性的临床参数比较Tab. 1 Clinical parameters of positive and negative resection margins after endoscopic treatment(n, %)
结 果
1 残留与切缘阳性例数 内镜下治疗胃肠道神经内分泌瘤共118例,术后切缘残留22例,占18.6%(22/118)。其中一侧切缘残留3例,基底残留19例。术前采用超声内镜检查或活组织检查明确诊断为神经内分泌瘤72例,其中切缘阳性中术前明确诊断神经内分泌瘤8例。由10年以上操作经验并经专业培训的内镜医师切除神经内分泌瘤88例,其中切缘阳性10例。余为9年以下经专业培训的内镜医师完成。按病变部位:共切除直肠神经内分泌瘤105例,其中残留20例;十二指肠4例,其中残留2例;胃7例,无残留;乙状结肠2例,无残留。按操作方法:圈套电凝电切共48例,其中残留9例;内镜下黏膜切除术40例,其中残留6例;内镜黏膜下剥离术30例,其中残留7例。按病理情况:切缘残留中2例肿瘤浸润至肌层,1例限于黏膜层,其余19例均浸润至黏膜下层。
2 切缘残留阴性阳性比较 切缘阴性组与切缘阳性组年龄、肿瘤直径、生长部位、内镜下治疗方法差异均无统计学意义(P>0.05)。两组间肿瘤浸润深度(P=0.000 1)、术前是否明确诊断(P=0.02)、内镜医师的操作经验差异有统计学意义(P=0.001),见表1。Logistic回归分析显示肿瘤的浸润深度与切缘阳性独立相关。肿瘤浸润至肌层相对于局限于黏膜层切缘阳性风险增高23.3倍(OR=23.33,95%置信区间2.950 ~ 184.591,P<0.05),而术前是否明确诊断、内镜医师的操作经验并非内镜下治疗神经内分泌瘤切缘阳性的独立相关因素,见表2。
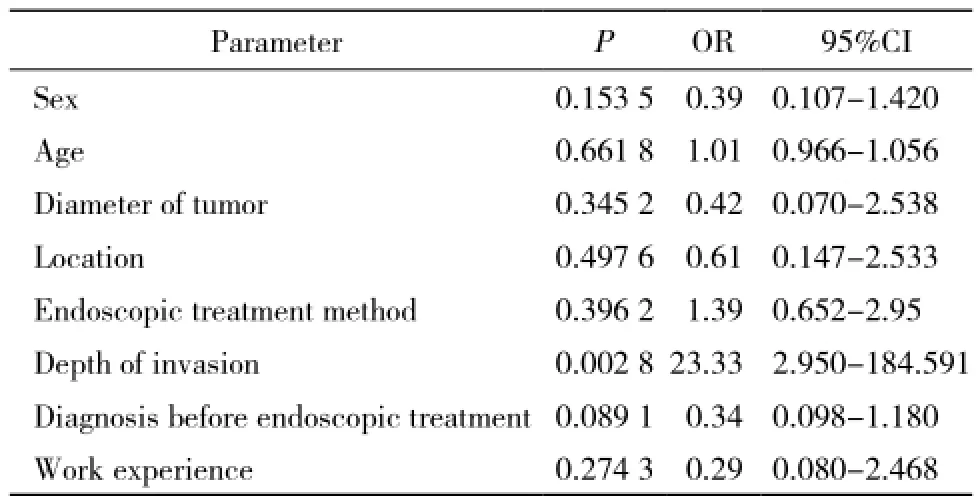
表 2 Logistic 回归分析切缘阳性危险因素Tab. 2 Logistic regression analysis showing risk factors for positive resection margin
讨 论
既往神经内分泌瘤的治疗方法一直以外科治疗为主,如肿瘤直径≥2.0 cm或已侵犯固有肌层且伴淋巴结或远处转移应选择根治性手术[7]。但是随着内镜治疗技术的不断提高,内镜下治疗神经内分泌瘤已成为不可替代的优选方法,尤其是符合内镜下切除标准的:1)肿瘤直径<1 cm;2)肿瘤未侵及肌层;3)肿瘤表面无溃疡或凹陷[8]。近年来内镜黏膜下剥离术应用于消化道黏膜下肿瘤取得了较好的效果[5,9],可以避免手术范围过大。如何降低内镜下切除神经内分泌瘤切缘阳性的发生率是每个内镜医师面临的主要问题。神经内分泌瘤内镜下完全切除标准为基底无肿瘤组织,各边缘0.2 cm以上无肿瘤组织[10]。
随着我院内镜下诊断及治疗神经内分泌瘤的准确率及成功率不断提高,以及标本取材、切片、染色流程的规范化,病理医生的诊断水平显著提高,使以往易被漏诊的切缘阳性标本得到了及时纠正。但内镜下切除神经内分泌瘤,切缘阳性的发生率依据切除方法不同发生率也有所不同[11-12],但仍较高,本组患者为18.6%。在切缘阴阳性患者的均衡性检验中患者临床特征如性别、年龄比较差异无统计学意义。在多项食管癌切缘阳性的研究中肿瘤病变的长度与切缘残留的发生率相关[13-14],但在本组资料的内镜下治疗中,并未得到相似结论。肿瘤的直径在两组中差异无统计学意义。
内镜下切除神经内分泌瘤常用的方法多种多样[15]。对于本组患者,针对患者的不同情况、内镜医师的操作技术熟练程度主要采用内镜下圈套电凝电切、内镜下黏膜切除术及内镜黏膜下剥离术。本组资料的3种治疗方法比较差异无统计学意义(P>0.05),故从本组资料可得出不同内镜下治疗方法与切缘阳性率无关。考虑本组资料为回顾性研究而非前瞻性的随机对照,对于结果的判断可能存在偏倚。但对于术前应用超声内镜评估肿瘤浸润深度至黏膜下层的,我们仍建议应用内镜黏膜下剥离术切除肿瘤组织,确保切除干净。
本组资料得出对于不同部位神经内分泌瘤内镜下治疗后切缘阳性率是不同的。内镜下共切除胃神经内分泌瘤7例,无残留,而在十二指肠中,共切除4例,2例残留。但3组比较差异无统计学意义(P>0.05),可能与例数较少有关,尚需资料的进一步收集补充。
Sauven等[16]报道,肿瘤的浸润深度与患者的生存率有直接相关性。本组资料显示肿瘤的浸润深度在切缘阴阳性中差异具有明显统计学意义,且Logistic回归分析显示浸润深度是切缘阳性独立相关危险因素。而在本组资料中术前是否明确诊断在两组的比较中差异也具有统计学意义(P<0.05),但并非是切缘阳性的独立的危险因素。神经内分泌瘤虽生长缓慢,但呈浸润性生长,恶性程度界于良性与恶性肿瘤之间[17]。神经内分泌瘤无法从内镜下直视观察其直径大小来判断其浸润深度,本组1例内镜下肿瘤直径仅为0.6 cm,但病理提示肿瘤已浸润至肌层。也有肿瘤直径为1 cm却仅局限于黏膜层。对于已浸润至固有肌层的病例,内镜下的治疗很难完整切除,故切缘残留的发生率也会相应增加。所以对于肿瘤浸润深度的判断,术前可以借助超声内镜明确肿瘤范围,进一步提高诊断的准确性及浸润深度的判断,这对于预防切缘残留具有一定帮助。本组资料结论也提示治疗前诊断明确的与诊断不清的差异存在统计学意义。本组病人在不同内镜医师的工作年限比较中差异也具有统计学意义。这就提示我们更加熟练地掌握内镜下治疗的操作方法,准确评估病情、合理掌握适应证、选择合适的治疗方法,在内镜下的神经内分泌瘤治疗中非常重要。
综上所述,术前病理活检明确病变性质,评估肿瘤的大小,超声内镜检查明确病变浸润深度,选择合适的内镜下治疗方法,合理掌握内镜下治疗适应证可以预防切缘残留。而对于术后的病理必须给予足够的重视,免疫组织化学染色的方法对于神经内分泌瘤恶性程度的分级具有重要的作用[18-19]。对于有切缘残留者需谨慎评估,必要时追加外科手术,对于防止复发、改善预后具有重要的临床意义。
1 冯福才. 大肠内镜诊治直肠类癌19例报告[J]. 中国实用内科杂志, 1997, 17(7):424.
2 Söreide JA, van Heerden JA, Thompson GB, et al. Gastrointestinal carcinoid tumors: long-term prognosis for surgically treated patients[J]. World J Surg, 2000, 24(11): 1431-1436.
3 Creutzfeldt W. Carcinoid tumors: development of our knowledge[J]. World J Surg, 1996, 20(2):126-131.
4 周平红,姚礼庆,钟芸诗,等.直肠类癌的内镜超声诊断和内镜黏膜下切除[J].中华消化内镜杂志,2006,23(3):175-178.
5 Ono A, Fujii T, Saito Y, et al. Endoscopic submucosal resection of rectal carcinoid tumors with a ligation device[J]. Gastrointest Endosc, 2003, 57(4): 583-587.
6 Berkelhammer C, Jasper I, Kirvaitis E, et al. “Band-snare”resection of small rectal carcinoid tumors[J]. Gastrointest Endosc,1999, 50(4): 582-585.
7 尚俊清,周建农,许发培,等.直肠类癌的局部切除[J].中华肿瘤防治杂志,2006,13(20):1598-1598.
8 Kobayashi K, Katsumata T, Yoshizawa S, et al. Indications of endoscopic polypectomy for rectal carcinoid tumors and clinical usefulness of endoscopic ultrasonography[J]. Dis Colon Rectum,2005, 48(2): 285-291.
9 Moon JH, Kim JH, Park CH, et al. Endoscopic submucosal resection with double ligation technique for treatment of small rectal carcinoid tumors[J]. Endoscopy, 2006, 38(5): 511-514.
10 周平红,姚礼庆,秦新裕.直肠类癌的内镜诊断和治疗[J].中国临床医学,2005,12(5):756-757.
11 Park HW, Byeon JS, Park YS, et al. Endoscopic submucosal dissection for treatment of rectal carcinoid tumors[J]. Gastrointest Endosc, 2010, 72(1): 143-149.
12 Mashimo Y, Matsuda T, Uraoka T, et al. Endoscopic submucosal resection with a ligation device is an effective and safe treatment for carcinoid tumors in the lower rectum[J]. J Gastroenterol Hepatol,2008, 23(2): 218-221.
13 赵一电,郭梅.5402例食管癌术后切缘癌分析[J].实用癌症杂志,2005,20(6):601-603.
14 周林太.食管癌切除术后切缘癌残留的相关因素与预防措施分析[J].中国医药导报,2011,8(19):150-151.
15 Boškoski I, Volkanovska A, Tringali A, et al. Endoscopic resection for gastrointestinal neuroendocrine tumors[J]. Expert Rev Gastroenterol Hepatol, 2013, 7(6): 559-569.
16 Sauven P, Ridge JA, Quan SH, et al. Anorectal carcinoid tumors. Is aggressive surgery warranted?[J] Ann Surg, 1990, 211(1):67-71.
17 Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors[J]. Cancer, 2003, 97(4): 934-959.
18 Adsay V. Ki67 labeling index in neuroendocrine tumors of the gastrointestinal and pancreatobiliary tract: to count or not to count is not the question, but rather how to count[J]. Am J Surg Pathol,2012, 36(12):1743-1746.
19 Mounajjed T, Zhang L, Wu TT. Glypican-3 expression in gastrointestinal and pancreatic epithelial neoplasms[J]. Hum Pathol, 2013, 44(4): 542-550.
Endoscopic treatment of residual gastrointestinal neuroendocrine tumors at resection margin: An analysis of its relative risk factors
WEN Jing, LU Zhong-sheng, YANG Jing, LIU Qing-sen, YANG Yun-sheng, LIANG Hao
Department of Gastroenterology, Chinese PLA General Hospital, Beijing 100853, China Corresponding author: YANG Yun-sheng. Email: synny301ddc@126.com
ObjectiveTo study the relative risk factors for residual gastrointestinal neuroendocrine tumors at resection margin after endoscopic treatment. MethodsOne hundred and eighteen patients with gastrointestinal neuroendocrine tumors who underwent endoscopic treatment in our center from February 2002 to July 2012 were included in this study. The clinical data about 22 patients with residual gastrointestinal neuroendocrine tumors at resection margin after endoscopic treatment were retrospectively analyzed. Effects of different parameters on the resection margin was analyzed by univariate analysis. Independent risk factors for the resection margin were analyzed by multivariate logistic regression analysis. ResultsThe 22 patients with residual gastrointestinal neuroendocrine tumors at the resection margin after endoscopic treatment accounted for 18.6% of the 118 patients with gastrointestinal neuroendocrine tumors. Univariate analysis showed that the tumor invasion depth, positive and negative margins, established diagnosis of tumor before endoscopic treatment and the number of years in endoscopy physicians were significantly different between patients with positive resection margin and those with negative resection margin. Multivariate logistic regression analysis showed that the tumor invasion depth was an independent factor for positive resection margin. ConclusionThe incidence of positive resection margin is low in patients with residual gastrointestinal neuroendocrine tumors at resection margin after endoscopic treatment if the diagnosis of tumor is established, the tumor invasion is limited to the submucosa, and the operation is performed by senior surgeons.
gastrointestinal neuroendocrine tumors; endoscopic therapy; residual tumor at resection margin
R 735
A
2095-5227(2014)02-0105-04
10.3969/j.issn.2095-5227.2014.02.002
2013-10-21 17:36
http://www.cnki.net/kcms/detail/11.3275.R.20131021.1736.003.html
2013-08-26
国家卫生部重大课题(201002020)
Supported by Ministry of Health of China(201002020)
温静,女,博士,主治医师。研究方向:胃肠疾病。Email: wenjingdudu@126.com
杨云生,男,博士后,主任医师。Email: synny301ddc@ 126.com;梁浩,男,主任医师。Email: lianghao301@163.com

