骨巨细胞瘤干细胞的分离鉴定
周振华,李 焱,黄 权,王旭东,徐乐勤,陈 素,肖建如
骨巨细胞瘤(giant cell tumor of bone,GCTB)是常见的原发骨肿瘤之一,好发于青壮年。尽管该肿瘤转移少见,但是其具有侵袭性和潜在恶性,局部刮除术后复发率为20%~70%,约5%的病例可发生肉瘤样恶变[1]。世界卫生组织将其定义为良恶性交界的骨肿瘤。GCTB影像学表现较为典型[2],诊断并不存在困难,但化疗对及放疗的效果并不满意,放射治疗GCTB甚至可导致发病部位继发肉瘤,因此对于GCTB的患者应慎重选择化疗与放疗,临床上多采用手术进行治疗[3]。尽管早在2个世纪前已有学者描述此瘤的一些临床特点,但是至今有关此瘤的相关基础研究相比其它肿瘤仍非常少见,对其发生机制、生物学行为进行探索具有深远的意义。
近年来肿瘤干细胞学说[4]的提出为肿瘤研究提供了新的思路。该学说认为肿瘤干细胞是存在于肿瘤组织中的一小部分具有干细胞性质的细胞群体,均具有自我更新能力和不定向分化潜能,并可导致肿瘤发生。现认为肿瘤干细胞是肿瘤形成及其不断生长的根源。目前在结肠癌[5-6]、肝癌[7-9]、乳腺癌[10-13]等实体瘤中肿瘤干细胞相继被发现分离,推动了肿瘤研究的进展。尽管越来越多的实体瘤干细胞被发现分离,但是这些实体瘤几乎都是恶性实体瘤,关于良性或良恶性交界性肿瘤干细胞分离鉴定的研究鲜见报道。GCTB属于良恶性交接性的原发骨肿瘤,其生物学特性不同于单纯的良恶性肿瘤,此外,该肿瘤组成成分复杂,其肿瘤发生的具体机制也不十分明了,这些都给GCTB的研究带来了难度。在本研究中,临床标本原代培养获取的GCTB细胞培养出了GCTB球体,并对该球体细胞进行了初步的功能学检测,发现该球体细胞群具有干细胞样特征,为将来进一步进行研究和临床应用打下了基础。
1 材料与方法
1.1 试剂
DMEM/F12培养基(Gibco公司),胎牛血清(Gibco公司),碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,Serotec公司)、表皮生长因子(epidermal growth factor,EGF,Serotec公司)、胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1,Serotec公司),RNA提取试剂Trizol(Gibco公司),反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒(TAKARA公司),PCR引物(Invitrogen公司),Transwell(BD公司)
1.2 原代培养和GCTB细胞系的建立
用于原代培养的手术标本来源于1位45岁的男性患者,该患者被诊断为C4椎体GCTB并在该院进行肿瘤切除手术。手术切除后的无菌新鲜标本一部分送往病理科进行病理学检测证实为GCTB,另一部分标本装入盛有Hank液的50 mL无菌离心管中立即送往细胞培养室进行后续的处置工作。在细胞超净工作台中将离心管中的标本倒入10 cm的无菌培养皿中,用Hank液反复冲洗,去除标本表面粘附的红细胞,用无菌组织剪将组织块反复剪切至糜状,将组织移入装有10 mL DMEM培养基的50 mL无菌离心管中,加入Ⅱ型胶原酶10 μL,同时加入青霉素(100 U/mL),链霉素(100 mg/mL),放入恒温振荡仪中在37℃的条件下以每分钟200次的速度进行振荡,2 h取出后用巴氏吸管将其吹打混匀,将组织悬液用400目(约37 μm)无菌金属筛网中过筛,收集过筛后的液体,用巴氏吸管紧贴离心管沿其壁缓慢加入到预盛5 mL Ficoll淋巴细胞分离液的15 mL无菌离心管中,放入离心机中2500 r/min水平离心30 min。离心完毕后取出,将中间的细胞层小心用吸管吸出置入另一离心管中,5 mL磷酸盐缓冲盐水(phosphate buffered saline,PBS)对其吹打、重悬,再次离心,去上清后底部即为分离所得的组织细胞。将经过上述处理获得的细胞接种于25 cm2的细胞培养瓶中,加入含有20%胎牛血清、青霉素(100 U/mL)、链霉素 (100 mg/mL)的DMEM(Dulbecco’s modified eagle medium)培养基,将细胞培养瓶放置在温度设定为37℃、CO2浓度为5%的细胞培养箱中进行培养。每天用倒置相差显微镜定期观察细胞生长情况,第3天进行半量换液1次。第5天进行全量换液1次。第7天用含有0.02%EDTA的0.25%胰酶将贴壁细胞消化后进行1∶2传代。将传代后的细胞接种于新的25 cm2的细胞培养瓶中,加入含有10%胎牛血清、青霉素(100 U/mL),链霉素(100 mg/mL)的DMEM培养基进行培养。在培养的过程中,挑选不同代数的细胞进行冻存保种,收集细胞后将细胞用冻存液(90%胎牛血清,10%二甲基亚砜)重悬,将冻存管放入液氮罐中保存。
1.3 细胞增殖检测
取对数生长期的原代细胞按3×103/孔接种于96孔培养板,每孔加200 μL含10%胎牛血清的DMEM,置5%CO2、饱和湿度37℃培养箱中培养,设3个复孔。每天加入20 μL CCK-8(Dojindo Laboratories,Kumamoto,Japan)试剂,37℃孵育2 h,使用多功能酶标仪检测450 nm波长吸收值,连续检测5 d。
1.4GCTB细胞球体诱导
将3×105个处于对数生长期的GCTB细胞培养在DMEM-F12培养基中(Gibco公司),培养基中含青霉素100 U/mL,链霉素50 μg/mL,细胞置于超低吸附培养皿中(Corning)培养,在培养基中添加EGF(20 ng/mL)bFGF(20 ng/mL),IGF(20 ng/mL),于37℃含5%CO2的细胞培养箱中培养。隔1天添加1次生长因子,待5~7 d GCTB球体细胞体积较大时吸取培养基离心,用DMEM-F12培养基吹打成单细胞悬液,按1∶3比例传代。
1.5 核心转录因子检测(RAN抽提,RT-PCR)
①总RNA抽提:用无菌PBS清洗待测球体细胞2次;吸干残液后,加1 mL Trizol裂解细胞;向细胞裂解液中加入200 μL氯仿,剧烈振荡后,室温下静置10 min;4℃,12000 r/min,离心15 min;吸出含RNA的上层水相,移至另一离心管;加入与水等体积的异丙醇,轻轻混匀,室温下静置10 min;4℃,12000 r/min,离心10 min,令RNA沉淀;弃上清液,加入焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水配制的 75% 乙醇 1mL,洗涤 RNA;4℃ ,7500 r/min,离心8 min,弃上清液;RNA沉淀在空气中干燥10 min,用40 μL DEPC水溶解;紫外分光光度仪测定浓度。②RNA逆转录合成 cDNA:将RNA稀释到100 ng/μL,逆转录反应体系为5×PrimeScript®RT Master Mix(TAKARA)2 μL,RNA 5 μL,RNase Free dH2O 3 μL。逆转录产物 1∶40 稀释后备用。③real time PCR:反应体系为:2×PreMix(TAKARA)5 μL;Primers(Pairs)1 μL;Rox 0.2 μL;cDNA 3.8 μL。扩增条件:预变性 95℃15 s;95℃ 5 s,60℃ 31 s,共40个循环。反应中使用的引物为Primer Premier 5.0软件设计(见表1)。
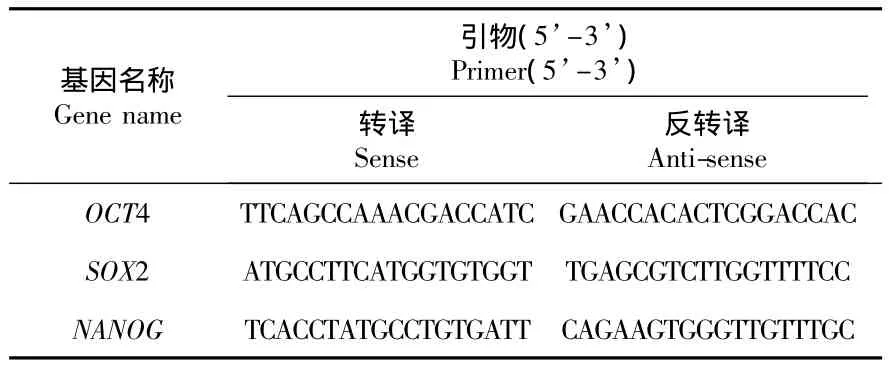
表1 引物序列Tab.1 Primer sequence
1.6 侵袭实验
Transwell、24孔培养板、Matrigel置于4℃ 冰箱过夜,将Transwell置于24孔板中,Matrigel和无血清DMEM培养基按1∶5比例混合,取60 μL加入Transwell上室,37℃温育2 h以使其凝固。将GCTB原代细胞和球体细胞用无血清DMEM培养基制备成单细胞悬液,与上室中加入200 μL细胞悬液(1×105个细胞),下室中加入800 μL含10%胎牛血清的DMEM培养基,每室设3个对照;于37℃、5%CO2的条件中培养24 h,取出上室,用结晶紫染色,用棉签擦除未能侵袭的细胞,于200倍光镜下,随机选取4个视野拍照,计数细胞进行比较。
1.7 动物实验
裸鼠用1%戊巴比妥钠(75 mg/kg)麻醉,仰卧位,胶带固定前肢及左后肢,使右后肢屈曲,胫股骨夹角成45°,然后手持1 mL TB针筒29 G针头刺入胫股骨关节间隙,从胫骨头关节窝凹点处进针,顺着胫骨骨干长轴方向缓慢钻透胫骨头松质骨部分进入骨髓腔,有明显的突破感。旋转缓慢进入扩髓,退出针头后沿原进针点用微量进样器插入骨髓腔,缓缓注入用Matrigel胶与DMEM1∶1配制的GCTB球体细胞悬液20 μL,约5×105个细胞,最后拔出针头。待裸鼠苏醒后回笼。对侧注射同体积Matrigel胶与DMEM含1×106GCTB亲代细胞作为对照。后每周定期用动物X线机(Kodak,DXS4000 Pro system)观察肿瘤生长情况。
2 结 果
2.1 原代细胞培养及生长曲线
细胞悬液接种24 h后,开始可以观察到贴壁细胞,这些细胞大小、形态不一,主要可以看到形态巨大的多核巨细胞和梭形的基质细胞,其中多核细胞细胞核排列紧密,梭形细胞大小不一,形态多样,核体积增大,核浆比例失调。经过连续3次传代以后,多核巨细胞基本在视野中消失,只能观测到梭形的基质细胞(见图1)。连续5 d检测细胞的生长情况,得到原代细胞的生长曲线(见图2)。
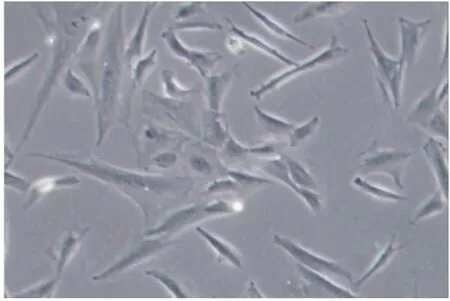
图1 原代细胞(×100)Fig.1 Primary cell(×100)

图2 生长曲线Fig.2 Growth curve
2.2 细胞球体形成
肿瘤干细胞在无血清特殊培养条件下具有形成球体的能力,因此培养球体细胞可以成为富集干细胞的手段之一。将GCTB细胞培养在含有生长因子的DMEM/F12培养基中,发现培养5 d后GCTB细胞形成了球体(见图3)。
2.3 干细胞相关核心转录因子检测
在原代GCTB细胞和培养的球体细胞中同时用real-time PCR检测了干细胞自我更新相关的基因OCT4、SOX2和NANOG的表达情况。实验结果发现,与原代细胞相比,GCTB球体细胞中OCT4、Sox2和NANOG的mRNA表达都是明显上调的(见图4),特别是OCT4,其在球体细胞中mRNA的含量是原代细胞中含量的49倍。这些结果表明培养形成的球体细胞具有一定的干细胞特性。
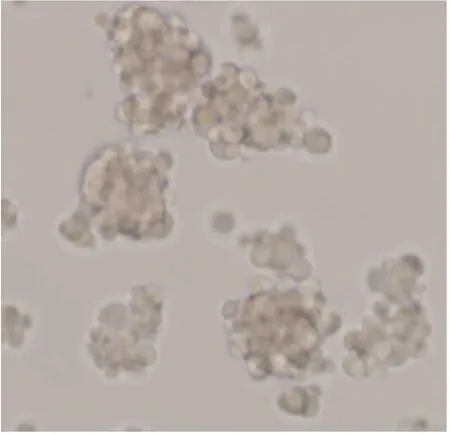
图3 球体形成(×200)Fig.3 Development of sphere(×200)
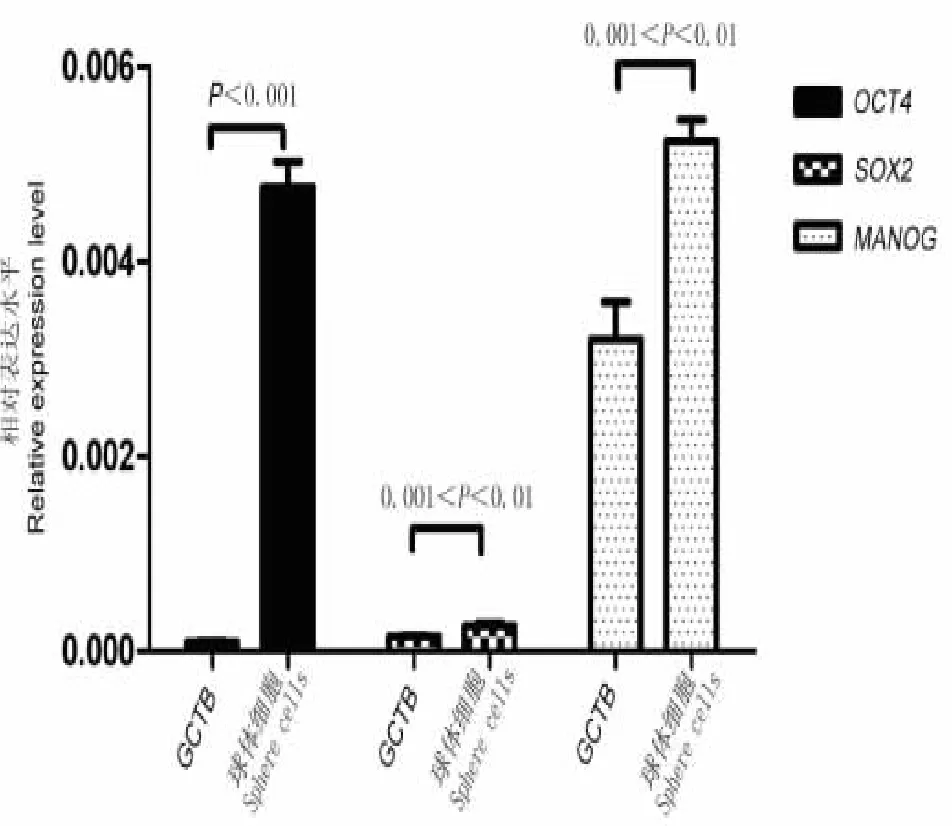
图4 干细胞相关核心转录因子real-time PCR检测Fig.4 Real-Time PCR for the detection of“stemness”-associated core transcription factors
2.4 侵袭实验
通过transwell侵袭实验检测GCTB球体细胞的侵袭性,实验结果发现GCTB球体细胞的侵袭性明显强于GCTB原代细胞(见图5),2组间差异具有统计学意义(P <0.01)。
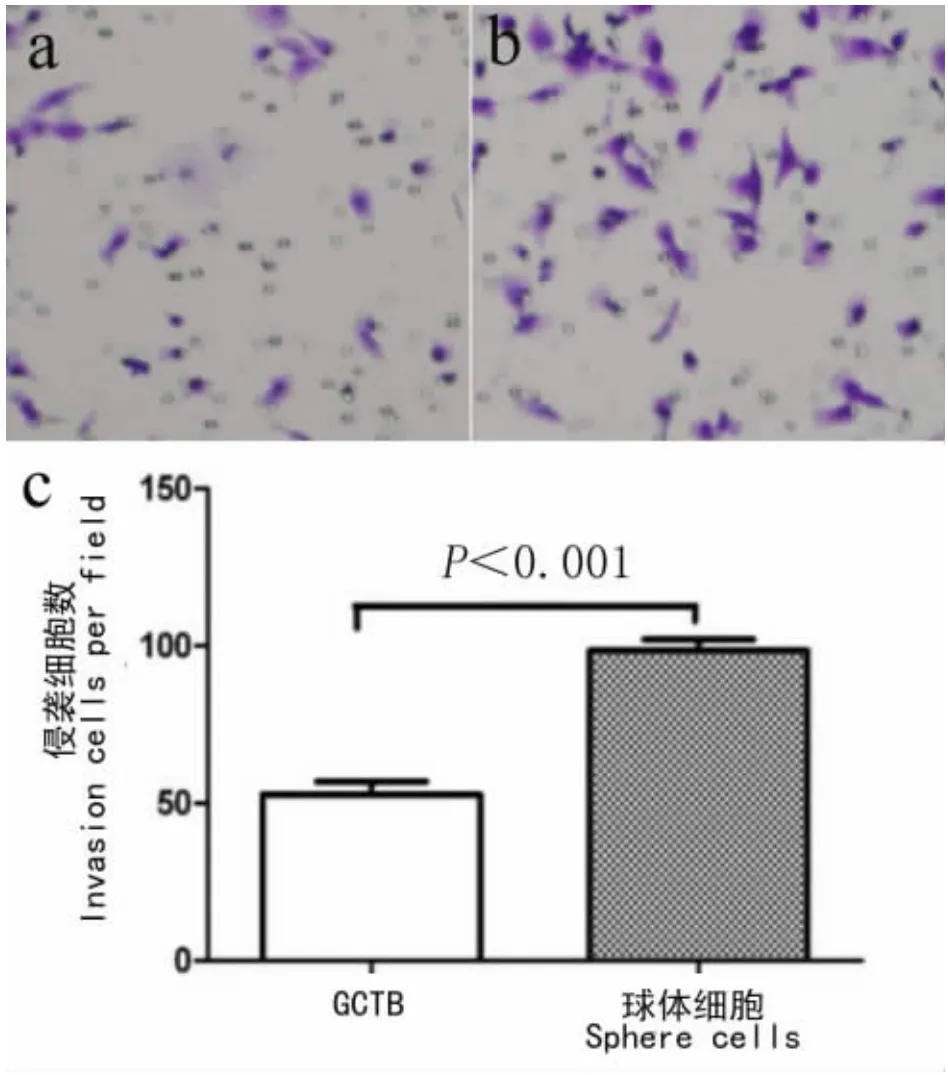
图5 侵袭实验Fig.5 Invasion sssay
2.5 动物实验
在进行GCTB细胞骨腔注射后4周后对小鼠进行了X线检测,发现实验组中骨近端出现骨质破坏(见图6箭头所指位置),而对照组骨质密度连续均一,皮质完整,提示GCTB球体细胞在骨环境中比GCTB亲代细胞具有更强的致瘤能力。
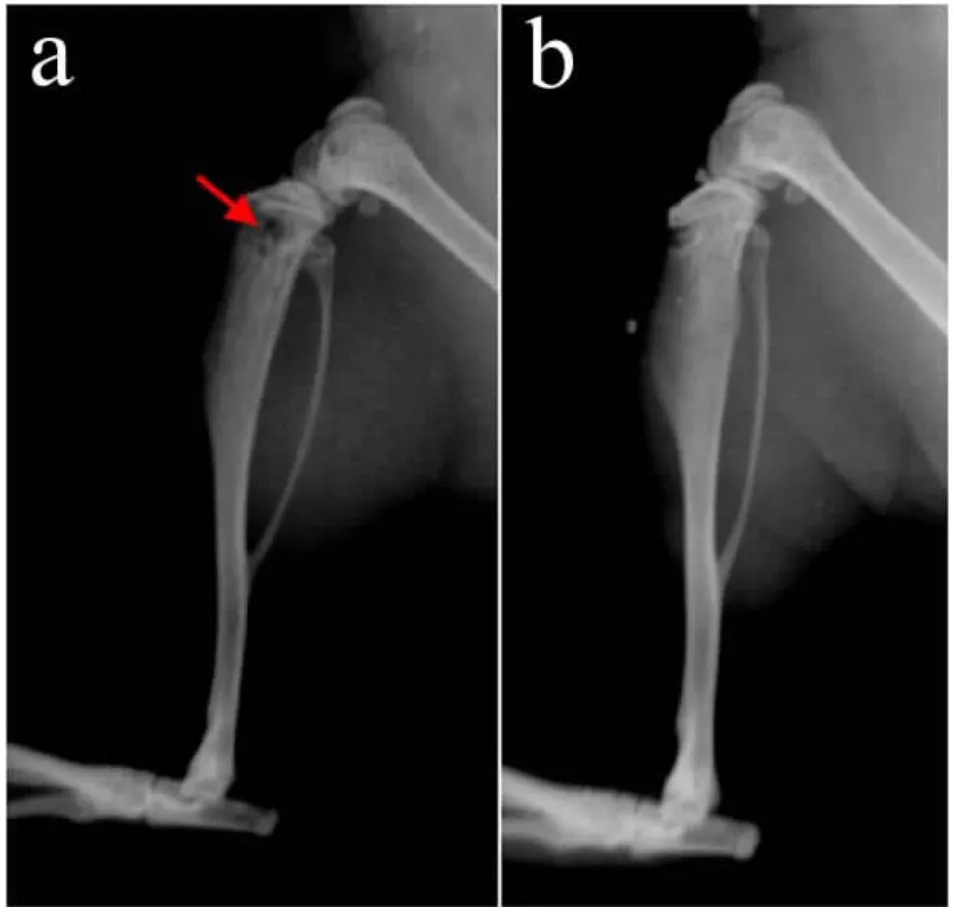
图5 GCTB细胞注射4周后小鼠胫骨X线检测结果Fig.5 X-ray films 4 weeks after GCTB cells transplant
3 讨 论
目前的肿瘤干细胞的相关研究多聚焦于恶性肿瘤,很少有良性肿瘤干细胞的研究报道。其原因在于良性肿瘤的危害性要小于恶性肿瘤,良性肿瘤或交界性肿瘤的相关研究不像恶性肿瘤研究那样深入,那么良性肿瘤中是否存在肿瘤干细胞?笔者认为如果说肿瘤起源于肿瘤干细胞的话,那么不管是良性肿瘤还是恶性肿瘤都应该存在肿瘤干细胞。另外,就肿瘤的异质性这个特点来讲,不同类型的肿瘤细胞成瘤能力也就会存在差异,那么也必然会有某一类群细胞成瘤能力最强。所以这一亚群就也可以被称为肿瘤干细胞,但是由于良性肿瘤同恶性肿瘤生物学特性方面有很大差异,比如说极少出现转移,而恶性肿瘤中目前有很多研究认为是某个亚群的肿瘤干细胞决定了是否转移,如果良性肿瘤中存在肿瘤干细胞,为何转移极为罕见?这些都是需要漫长的探索研究才能解决的问题。本研究仅是对GCTB干细胞进行了初探。
肿瘤干细胞研究的首要问题就是分离鉴定,但是由于缺乏特异的标志物,肿瘤干细胞的分离纯化一直是各国科学家亟待解决的难题之一。到目前为止已经报道了很多肿瘤干细胞表面标志物,例如CD133是一个报道很多的肿瘤干细胞表面标志物,在多种实体瘤干细胞中都有报道[14-18]。也有学者用分选侧群细胞的方法来得到肿瘤干细胞。侧群细胞最初用来从鼠骨髓中分选造血干细胞[19]。目前已经发现在成神经细胞瘤细胞系[20]、肝癌[21]和卵巢癌[22]中也发现有侧群细胞。
与上面的用标志物法来分离鉴定肿瘤干细胞的方法相比,球体培养是更简单易行的方法。研究发现,干细胞能够悬浮生长或在半固体培养基中生长,而普通细胞不附着于固体表面就不能生长。这可能是由干细胞非附着性生长的特性决定的,其确切的机制目前尚不明确。肿瘤干细胞也具有这种特性。在脑肿瘤与乳腺癌的研究中发现,脑肿瘤中的CD133+ 细胞[15]与乳腺癌中的 CD44+、CD24-细胞[11]均可在无血清培养基形成细胞球及在软琼脂中形成克隆,这是鉴定其是否具有自我更新能力的重要步骤,也是脑肿瘤及乳腺癌肿瘤干细胞的一个重要特性。本实验利用了这个特性富集干细胞,所培养的GCTB球体细胞中OCT4、SOX2和NANOG的mRNA水平与原代细胞相比都是明显上调的。OCT4、SOX2和NANOG是调控胚胎干细胞自我更新和维持其全能性的三个核心转录因子,能维持胚胎干细胞正常的未分化状态并促进其增殖,而亲代细胞株这三种蛋白表达很低[23-24]。本研究中培养的GCTB球体细胞中OCT4、SOX2和NANOG明显上调,说明球体细胞是具有一定干细胞特性的。
肿瘤干细胞的来源一直是有争议的问题,GCTB的组成成分复杂,除了多核巨细胞外,基质细胞有2种,一种为成纤维细胞样基质细胞;另一种为巨噬细胞样基质细胞。体外培养发现,巨噬细胞样基质细胞在原代培养中可占10% ~40%,经传代后逐渐减少,最后只剩下梭形排列的成纤维细胞样基质细胞。至于基质细胞的起源,有学者认为对肿瘤性质起决定作用的成纤维细胞样基质细胞来自于骨髓的原始间叶组织,而巨噬细胞样基质细胞系单核巨噬系统来源,代表机体的免疫反应。本研究中用到的都是来源于亚洲GCTB患者的GCTB细胞系,所有的手术标本在原代培养早期可以看到细胞在培养瓶中仍然保持与病理切片一致的形态,即以多核巨细胞为中心,周围围绕基质细胞,但在传代后,多核巨细胞逐渐消失,视野中只能看见梭形的基质细胞,以1×108此种基质细胞对免疫缺陷小鼠进行注射已经可以致瘤,对基质细胞进行悬浮无血清培养能够诱导成球,后来的球体细胞正是来源于此。这证明GCTB对肿瘤的致瘤能力和侵袭能力起重要作用的是基质细胞。值得注意的是以单一形态的基质细胞进行小鼠致瘤的标本,取出后进行切片可以再次看见GCTB的典型病理形态。说明多核巨细胞在体外培养时缺乏体内内环境的调控而消失或者可能是裂变成单核的基质细胞,而重新注入免疫小鼠体内后,基质细胞再次分裂或多个细胞聚合形成多核巨细胞,说明基质细胞在GCTB的发生发展中起着主导作用,其发生机制还需用示踪学的相关方法或手段进一步研究。
[1] Gitelis S,Mallin BA,Piasecki P,et al.Intralesional excision compared with en bloc resection for giant-cell tumors of bone[J].J Bone Joint Surg Am,1993,75(11):1648-1655.
[2] 蔡崇辉,陈一安,苏奇.脊柱骨巨细胞瘤的CT与MRI诊断[J].脊柱外科杂志,2005,3(6):338-340.
[3] 杜开利,黄东生,彭焰,等.脊柱原发性肿瘤的切除方式与疗效分析[J].脊柱外科杂志,2008,6(4):206-209.
[4] Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells--perspectives on current status and future directions:AACR Workshop on cancer stem cells[J].Cancer Res,2006,66(19):9339-9344.
[5] Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111-115.
[6] Dalerba P,Dylla SJ,Park IK,et al.Phenotypic characterization of human colorectal cancer stem cells[J].Proc Natl Acad Sci U S A,2007,104(24):10158-10163.
[7] Yang ZF,Ho DW,Ng MN,et al.Significance of CD90+cancer stem cells in human liver cancer[J].Cancer Cell,2008,13(2):153-166.
[8] Lee TK,Castilho A,Cheung VC,et al.CD24(+)liver tumorinitiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation[J].Cell Stem Cell,2011,9(1):50-63.
[9] Yin S,Li J,Hu C,et al.CD133 positive hepatocellular carcinoma cells possess high capacity for tumorigenicity[J].Int J Cancer,2007,120(7):1444-1450.
[10] Wright MH,Calcagno AM,Salcido CD,et al.Brca1 breast tumors contain distinct CD44+/CD24-and CD133+cells with cancer stem cell characteristics[J].Breast Cancer Res.2008;10(1):R10.
[11] Gudjonsson T,Villadsen R,Nielsen HL,et al.Isolation,immortalization,and characterization of a human breast epithelial cell line with stem cell properties[J].Genes Dev,2002,16(6):693-706.
[12] Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci U S A,2003,100(7):3983-8398.
[13] Ponti D,Costa A,Zaffaroni N,et al.Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties[J].Cancer Res,2005,65(13):5506-5511.
[14] Eramo A,Lotti F,Sette G,et al.Identification and expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ,2008,15(3):504-514.
[15] Yin AH,Miraglia S,Zanjani ED,et al.AC133,a novel marker for human hematopoietic stem and progenitor cells[J].Blood,1997,90(12):5002-5012.
[16] Bertolini G,Roz L,Perego P,et al.Highly tumorigenic lung cancer CD133+cells display stem-like features and are spared by cisplatin treatment[J].Proc Natl Acad Sci U S A,2009,106(38):16281-16286.
[17] Beier D,Hau P,Proescholdt M,et al.CD133(+)and CD133(-)glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles[J].Cancer Res,2007,67(9):4010-4015.
[18] Miki J,Furusato B,Li H,et al.Identification of putative stem cell markers,CD133 and CXCR4,in hTERT-immortalized primary nonmalignant and malignant tumor-derived human prostate epithelial cell lines and in prostate cancer specimens[J].Cancer Res,2007,67(7):3153-3161.
[19] Goodell MA,Brose K,Paradis G,et al.Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo[J].J Exp Med,1996,183(4):1797-1806.
[20] Hirschmann-Jax C,Foster AE,Wulf GG,et al.A distinct“side population”of cells with high drug efflux capacity in human tumor cells[J].Proc Natl Acad Sci U S A,2004,101(39):14228-14233.
[21] Chiba T,Kita K,Zheng YW,et al.Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties[J].Hepatology,2006,44(1):240-251.
[22] Szotek PP,Pieretti-Vanmarcke R,Masiakos PT,et al.Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness[J].Proc Natl Acad Sci U S A,2006,103(30):11154-11159.
[23] Boyer LA,Lee TI,Cole MF,et al.Core transcriptional regulatory circuitry in human embryonic stem cells[J].Cell,2005,122(6):947-956.
[24] Zhou Q,Chipperfield H,Melton DA,et al.A gene regulatory network in mouse embryonic stem cells[J].Proc Natl Acad Sci U S A,2007,104(42):16438-16443.