福建及邻近省份禽源多杀性巴氏杆菌的分离鉴定
程龙飞,许利娜,林建生,陈红梅,仇微红,施少华,叶和佳,胡秀美,梁昭平,黄 瑜
(1. 福建省农业科学院畜牧兽医研究所,福州 350013;2.广州市华南生物药品有限公司,广州 511300)
·研究论文·
福建及邻近省份禽源多杀性巴氏杆菌的分离鉴定
程龙飞1,许利娜2,林建生1,陈红梅1,仇微红2,施少华1,叶和佳2,胡秀美2,梁昭平2,黄 瑜1
(1. 福建省农业科学院畜牧兽医研究所,福州 350013;2.广州市华南生物药品有限公司,广州 511300)
本研究收集2007~2013年福建省及邻近省份的疑似禽霍乱病死亡鸡、鸭、鹅,进行细菌分离,PCR进行种和荚膜群的鉴定,琼脂扩散试验鉴定其Heddleston氏耐热菌体抗原型。结果共分离鉴定多杀性巴氏杆菌95株,其中鸭源74株,鸡源17株,鹅源4株。其荚膜群全为A型,1型耐热菌体抗原型占67.4%。与20世纪80年代以来我国已有的报道相同,禽源(不含火鸡)多杀性巴氏杆菌血清型仍然以A:1为主。
禽;多杀性巴氏杆菌;血清型
禽霍乱,又名禽出败、禽巴氏杆菌病,是由多杀性巴氏杆菌引起的一种慢性或急性接触性、败血性传染病,多发生于性成熟的禽类[1]。该病急性发作时,病程短促、死亡率高、以高热下痢和呼吸困难为特征,虽然许多抗菌药物能迅速控制本病,但停药后极易复发,造成的损失极大。慢性型则发生肉髯水肿和关节炎。早在1880年,Pasteur即分离到这种微生物并在肉汤中获得纯培养。本病是危害养禽业最为重要的细菌性传染病之一,至今仍是许多国家和地区列为重点预防的一种疾病。
多杀性巴氏杆菌的血清型由荚膜群和菌体抗原型组成,我国关于侵害家禽(结合我国的国情,这里的禽指的是鸡、鸭和鹅,不包括火鸡)的多杀性巴氏杆菌血清型的报道,在2000年以前比较多见。之后的相关报道较少。为探明近几年来流行于我国部分地区的禽源多杀性巴氏杆菌的血清型,为禽霍乱疫苗的选择提供理论依据,本研究对2007~2013年福建及邻近省份的疑似禽霍乱病死亡鸡、鸭进行细菌分离、鉴定,现报道如下。

表1 各引物的序列Table 1 Sequences of the primers in this study
1 材料和方法
1.1 病料来源2007~2013年福建、浙江、江西、安徽、广东、广西、河北等省疑似禽霍乱死亡鸡、鸭、鹅。剖检见心冠脂肪出血;肝脏肿大,表面散在大量灰白色针尖大小的坏死点;肠道增粗,肠粘膜脱落,肠道内容物呈胶冻样。
1.2 培养基的配制改良TSA,称取胰蛋白胨大豆琼脂粉(Tryptic Soy Agar,Dfico公司)4 g,加入100 mL蒸馏水中,煮沸溶解,15磅高压15 min,待其自然冷却至60℃左右时加入2 mL的新生牛血清,混匀后分装制成平板,4℃保存。
1.3 细菌的分离及初步鉴定无菌采集肝脏,接种于改良TSA,37℃培养20 h,挑取圆形突起、表面光滑湿润、露珠样的单个菌落,再次接种改良TSA进行纯化。取纯培养物进行革兰氏染色、镜检,同时做生化鉴定。生化鉴定管购自广东环凯微生物科技有限公司。
1.4 分离菌的种鉴定和荚膜群群鉴定
1.4.1 模板的制备 挑取适量纯培养物,按DNA提取试剂盒(Genomic DNA Kit,北京全式金生物技术有限公司)说明书提取基因组DNA,吸取2 μL以Thermo公司的NanoDrop超微量分光光度计测量核酸浓度,取50 ng做为模板。
1.4.2 引物 引物序列[2]见表1,由上海生工生物工程技术服务有限公司合成。
1.4.3 PCR反应 PCR反应体系为50 μL:25 μL 2×Dream TaqTMGreen PCR Master Mix、3对引物各1 μL、1 μL模板、18 μL ddH2O。反应程序为94℃预变性5 min;94℃变性30 s ,56℃退火40 s,72℃延伸60 s, 30个循环;最后72℃延伸10 min。扩增产物通过10 g/L琼脂糖凝胶电泳,应用凝胶成像系统进行观察。同时以双蒸水为空白对照,以多杀性巴氏
杆菌CVCC44801株、CVCC392株(购自中国兽医药品监察所)提取的基因组DNA分别为荚膜群A型和D型的阳性对照。
1.5 分离菌的Heddleston氏耐热菌体抗原型鉴定采用琼脂扩散法进行[3]。用含0.3%福尔马林的8.5% NaCl溶液3 mL将改良TSA上的新鲜菌落洗下,制成含菌混悬液,沸水中煮沸1 h,自然冷却后8000×g离心15 min,取上清液即为耐热菌体抗原。按1%比例将优质琼脂加到8.5% NaCl溶液中,加热熔化后取15 mL加入直径90 mm的平皿中,凝固后打成7孔梅形图案,孔径及孔距均为4 mm,中央孔加热稳定抗原标准阳性血清(购自中国兽医药品监察所),周边1和4孔分别加阴、阳性热稳定抗原,其余每孔加1株待鉴定菌制备的热稳定抗原,置37℃湿盒1~3 d,每天观察1次,见白色沉淀线者为阳性。
2 结果
2.1 细菌的分离和鉴定纯化后的细菌进行革兰氏染色,镜检呈阴性的进行生化试验,能分解葡萄糖,甲基红试验和VP试验均为阴性,产生硫化氢的菌株视为初步鉴定阳性菌株,共有95株(74株来源于鸭、17株来源于鸡、4株来源于鹅)。
2.2 细菌的种鉴定和荚膜群群鉴定95株初步鉴定阳性的菌株,提取基因组DNA,定量后取50 ng进行PCR,均能扩增出与CVCC44801株相同的两个特异性条带,其中一个约460 bp,另一个约1044 bp,说明这些细菌均为荚膜群A型的多杀性巴氏杆菌(图1)。
2.3 耐热菌体抗原型鉴定琼脂扩散试验结果见表2,1型64株,占67.4%,为最常见的血清型。1(14)型14株,占14.7%;1(4、14)型9株,占9.5%。除此外,还有1(2、14)、5、12、14型等。
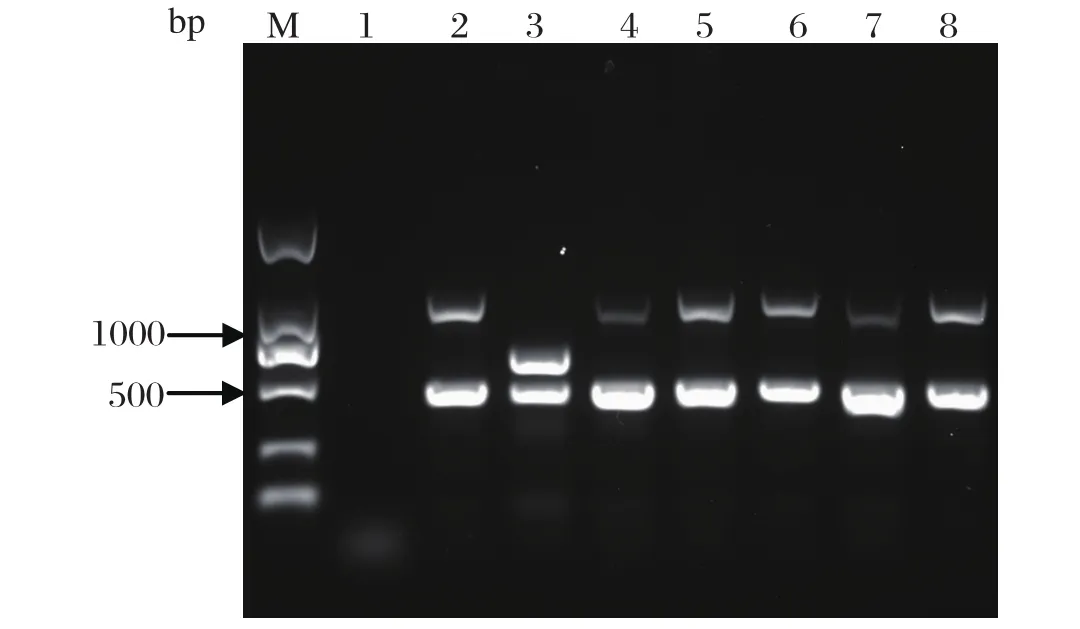
图1 多杀性巴氏杆菌分离株的多重PCR鉴定Fig.1 Multiple PCR identifi cation of P. multocida isolatesM: DNA分子量标准(DL2000); 1: 空白对照;2: CVCC44801; 3: CVCC392; 4~8: 分离菌株M: DNA Marker(DL2000); 1: Bland control; 2: CVCC44801;3: CVCC392; 4-8: P. multocida isolates
3 讨论
关于多杀性巴氏杆菌的血清学分型方法,Carter等(1955)用间接血凝试验将荚膜群抗原分为A、B、C、D四个血清型,后取消了C型,增加了E、F型[4,5]。Namioka等[6]以盐酸处理菌体制备菌体抗原,用试管凝集试验将其分为12个血清型,但由于交叉反应比较广泛,可操作性不强。Heddleston等[3]以煮沸法制备菌体耐热抗原,用琼脂扩散试验将其分为16个血清型,该方法操作简便,结果准确。Namioka分型方法中的5、8、9型相当于Heddleston分型方法中的1、3、16型。至今,将Carter荚膜群抗原分型(大写英文字母)和Heddleston耐热菌体抗原分型(阿拉伯数字,加括号表示较弱的反应)相结合的方法已被大多数人接受[7,8]。
我国1979年开始对多杀性巴氏杆菌进行血清学分型研究。何昭阳[9]鉴定了52株分离株(鸡源46株、鸭源5株、鹅源1株)的血清型,39株的荚膜群群为A型,13株未能定型;45株的菌体型为5型,7株为8型(Namioka分型方法),按现在的表述方式即A:1为主。刘国卿等[10]收集了1978年至1982年间158株禽源多杀性巴氏杆菌(鸡源153株,鸭源3株,鹅源2株),144株的荚膜群群为A型,14株未能定型。133株荚膜群A型菌中,132株的菌体型为5型(Namioka分型方法),按现在的表述方式也是A:1为主。之后,郑明(1984)[11]、胡东良(1986)[12]、林锦鸿等(1987)[13]、陈笃生等(1987)[14]、吴范庚(1987)[15]、吴彤等(1987)[16]、胡东良(1989)[17]、吴范庚(1993)[7]、刘亚刚等(1996)[18]、吴范庚(1997)[19]、程安春等(1997)[20]、王英珍等(1999)[8]、高明燕等(2011)[21]均报道了我国禽源(结合我国的国情,这里的禽指的是鸡、鸭和鹅,不包括火鸡)多杀性巴氏杆菌的血清型,均以A:1为主。其中,刘亚刚等[18]报道了1株鸭源荚膜群B型菌株,认为可能是混养在一起的猪传染给鸭的;吴范庚[19]报道了1株鸡源荚膜群D型菌株。
Townsend 等[2]根据荚膜群特异性基因hyaD-hyaC、bcbD、dcbF、ecbJ和fcbD设计引物,建立了快速鉴别多杀性巴氏杆菌荚膜群型的特异方法。间接血凝法对荚膜群进行分型时,对荚膜的量要求较高,如果细菌体外培养时丢失了较多荚膜,则无法鉴定。而针对基因的PCR方法则不存在这方面的缺点。赵耘等[22]利用该多重PCR法对42株分离自不同动物的不同荚膜群的多杀性巴氏杆菌进行鉴定,其结果与间接血凝法的结果相同,进一步证实了该方法的准确性。孙翠平等[23]、于成接等[24]均是以PCR方法鉴定出A型荚膜群的多杀性巴氏杆菌分离株。本试验综合关于禽源多杀性巴氏杆菌血清型鉴定文献报道,仅以种鉴定引物、荚膜群A、D型引物,建立三重PCR方法,进行禽源多杀性巴氏杆菌的种和荚膜群鉴定,结果证实是可行的。
检测结果表明,74株鸭源、17株鸡源和4株鹅源多杀性巴氏杆菌分离株的血清型以A:1为主,结合国内众多学者的研究结果,我们认为,20世纪80年代至今三十多年来,流行于我国的禽源(不含火鸡)多杀性巴氏杆菌的荚膜群和耐热菌体抗原型均没有发生大的变化,仍以A:1为主。
[1] Saif Y M. 禽病学[M]. 苏敬良, 高福, 索勋, 译. 北京: 中国农业出版社, 2012: 871-893.
[2] Townsend K M, Boyce J D, Chung J Y, et al. Genetic organization of Pasteurella multocida cap loci and development of a multiplex capsular PCR typing system [J]. J Clin Microbiol, 2001, 39(3): 924-929.
[3] Heddleston K L, Gallagher J E, Rebers P A. Fowl Cholera: gel diffusion precipitin test for serotyping Pasteurella multocida from avian species[J]. Avian Dis, 1972, 16(4): 925-936.
[4] Carter G R. Studies on Pasteurella multocida. I. A hemagglutination test for the identification of serological types [J]. Am J Vet Res, 1955, 16(60): 481-484.
[5] Rimler R B, Rhoades K R, Serogroup F. A new capsule serogroup of Pasteurella multocida [J]. J Clin Microbiol, 1987, 25(4): 615-618.
[6] Namioka S, Murata M. Serological studies on Pasteurella multocida. II. Characteristics of somatic (O) antigen of the organism [J]. Cornell Vet, 1961, (51): 507-521.
[7] 吴范庚. 我国多杀性巴氏杆菌血清型综述[J]. 中国兽医杂志, 1993, 19(1): 50-51.
[8] 王英珍, 黄金海, 丁伯良, 等. 天津地区禽多杀性巴氏杆菌分离株血清型鉴定[J]. 动物科学与动物医学, 1999, 16(3): 27-28.
[9] 何昭阳. 吉林省禽霍乱多杀性巴氏杆菌的血清学分型研究[J]. 吉林农业大学学报, 1982, 4(4): 60-67.
[10] 刘国卿, 袁松龄, 焦少田, 等. 河北省若干地区禽型巴氏杆菌的血清学定型[J]. 家畜传染病, 1983, 5(4): 18-20.
[11] 郑明. 我国111株由家禽分离的多杀性巴氏杆菌的血清型[J]. 畜牧兽医学报, 1984, 15(1): 51-56.
[12] 胡东良. 多杀性巴氏杆菌琼扩(AD)分型研究[J]. 吉林农业大学学报, 1986, 8(2): 63-69.
[13] 林锦鸿, 韩有库, 胡东良, 等. 我国禽多杀性巴氏杆菌血清型调查研究[J]. 中国畜禽传染病, 1987, 9(1): 1-4.
[14] 陈笃生, 陈登杰, 邓培芳, 等. 四川省畜禽多杀性巴氏杆菌菌体抗原的血清学鉴定[J]. 中国兽医科技, 1987, 17(4): 28-29.
[15] 吴范庚, 钱心元. 我国多杀性巴氏杆菌耐热抗原血清型(第一报) [J]. 中国兽医杂志, 1987, 13(12): 2-4.
[16] 吴彤, 缪玲, 刘金胜, 等. 28株禽源多杀性巴氏杆菌热浸抗原的分型研究[J]. 中国兽医科技, 1986, 16(6): 3-5.
[17] 胡东良. 我国禽源多杀性巴氏杆菌血清型研究[J]. 中国兽医杂志, 1989,15(8): 4-6.
[18] 刘亚刚, 刘内生, 岳华, 等. 安宁河流域鸭瘟、鸭霍乱综合防制研究II. 禽源多杀性巴氏杆菌血清型鉴定[J]. 中国兽医学报, 1996, 16(4): 356-358.
[19] 吴范庚. 我国多杀性巴氏杆菌血清学鉴定及交互免疫试验[J]. 中国兽医杂志, 1997, 23(8): 14-15.
[20] 程安春, 汪铭书, 陈孝跃, 等. 256株鸭源多杀性巴氏杆菌血清学鉴定及病原特性研究[J]. 中国兽医科技, 1997, 27(7): 13-15.
[21] 高明燕, 徐步, 龚建森, 等. 禽多杀性巴氏杆菌血清型与外膜蛋白型的相关性研究[J]. 黑龙江畜牧兽医, 2011, 35(8): 18-21.
[22] 赵耘, 杜昕波, 李伟杰, 等. 利用菌落多重PCR方法进行不同动物来源多杀性巴氏杆菌鉴定的研究[J]. 中国兽医杂志, 2010, 46(8): 3-6.
[23] 孙翠平, 唐娜, 谢金文, 等. 一例禽霍乱病原的分离鉴定和荚膜群分型[C]//中国畜牧兽医学会兽医公共卫生学分会第三次学术研讨会, 2012: 483-488.
[24] 于成接, 丁优玲, 华亚峰, 等. 禽霍乱巴氏杆菌的分离鉴定与致病性研究[J]. 中国兽医杂志, 2013, 49(2): 21-24.
CHARACTERIZATION OF AVIAN PASTEURELLA MULTOCIDA ISOLATES FROM FUJIAN AND ITS NEIGHBOR PROVINCES
CHENG Long-fei1, XU Li-na2, LIN Jian-sheng1, CHEN Hong-mei1, QIU Wei-hong2, SHI Shao-hua1, YE He-jia2, HU Xiu-mei2, LIANG Zhao-ping2, HUANG Yu1
(1. Institute of Animal Husbandry and Veterinary Medicine, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 2. Guangzhou South China Biological Medicine Co. Ltd., Guangzhou 511300, China)
Dead chickens, ducks and geese suspected of fowl cholera were collected in 2007~2013 from Fujian and its neighbor provinces and subject to isolation of Pasteurella multocida. A total of 95 Pasteurella multocida isolates were obtained, among which 74 isolates were isolated from ducks, 17 from chickens and 4 from geese. These bacterial strains were then determined for species and capsular types in PCR and for heat-stable somatic antigens in agar diffusion test. All isolates belonged to capsular type A and 64 isolates to heat-stable somatic antigens 1. These results have indicated that the main serotype of Pasteurella multocida isolates from avian (excluding turkey) in China has been remained A:1 since 1980’s.
Avian; Pasteurella multocida; serotype
S852.612
A
:1674-6422(2014)04-0040-05
2014-01-24
国现代农业产业技术体系建设专项资金(CARS-43);福建省农业五新工程项目(闽发改投资(2012)931号)
程龙飞,男,硕士,研究员,主要从事家禽传染病研究
黄瑜,E-mail:huangyu_815@163.com

