尼妥珠单抗联合三维适形放疗治疗局部晚期食管癌的Ⅱ期临床研究
饶创宙 张琛 杨璐 郑传城 邵守桥
尼妥珠单抗联合三维适形放疗治疗局部晚期食管癌的Ⅱ期临床研究
饶创宙 张琛 杨璐 郑传城 邵守桥
食管癌仍是目前世界上主要的恶性肿瘤之一,占全球恶性肿瘤发病率的第8位,病死率第6位[1]。对于局部晚期的食管癌,根治性手术切除的5年生存率大约为20%~25%[2-3],单纯放疗的5年生存率为8%~16%。近年来随着放疗技术的不断进步,同步放化疗作为局部晚期食管癌的标准治疗,使其5年生存率提高到20%~30%左右[4-5]。然而,同步放化疗骨髓抑制、放射性食管炎等不良反应较重,并且晚期食管癌患者因为营养状况较差,身体虚弱,无法耐受同步放化疗。近年来分子靶向治疗以其高效、低毒、高选择性的特点在多种肿瘤治疗中取得良好进展。其中针对食管癌的靶向药物就有如针对表皮生长因子受体(EGFR)的西妥昔单抗,尼妥珠单抗和帕尼单抗及小分子EGFR酪氨酸激酶抑制剂厄洛替尼、吉非替尼;针对VEGR的贝伐单抗,Bc1 2蛋白抑制剂AT-101和多靶点酪氨酸激酶抑制剂舒尼替尼,范德他尼等。尼妥珠单抗 (泰欣生)是以表皮生长因子受体(epidermal growthfactor receptor,EGFR)为靶点的国产药物,是国内第一个应用于治疗恶性肿瘤的人源化单克隆抗体。尼妥珠单抗能竞争性结合EGFR,阻断由EGFR介导的下游信号转导通路。从而抑制肿瘤细胞增殖、诱导分化、抑制肿瘤血管生成、增强放疗疗效[6-7]。本研究分析我科应用尼妥珠单抗联合放疗治疗17例局部进展期食管癌患者的近期疗效及不良反应。
1 资料和方法
1.1 一般资料 选择2012-03—2013-03我科收治的17例患者。入组标准:(1)经病理或细胞学确诊的Ⅱ~Ⅲ期或只有锁骨上淋巴结转移的Ⅳ期胸段食管癌患者;(2)有客观可测量的肿瘤病灶的初治患者;(3)年龄18~70岁;(4)ECOG≤2;(5)预计生存时间≥3个月;(6)无重要器官的严重疾病;(7)签署知情同意书。排除标准:(1)妊娠期或哺乳期妇女、处于生育期未采用有效避孕措施者;(2)精神系统疾病者;(3)有重要器官的严重疾病或严重感染者;(4)既往有恶性肿瘤治疗史;(5)入组前1个月内参加其他新药临床试验者。患者一般临床资料见表1。
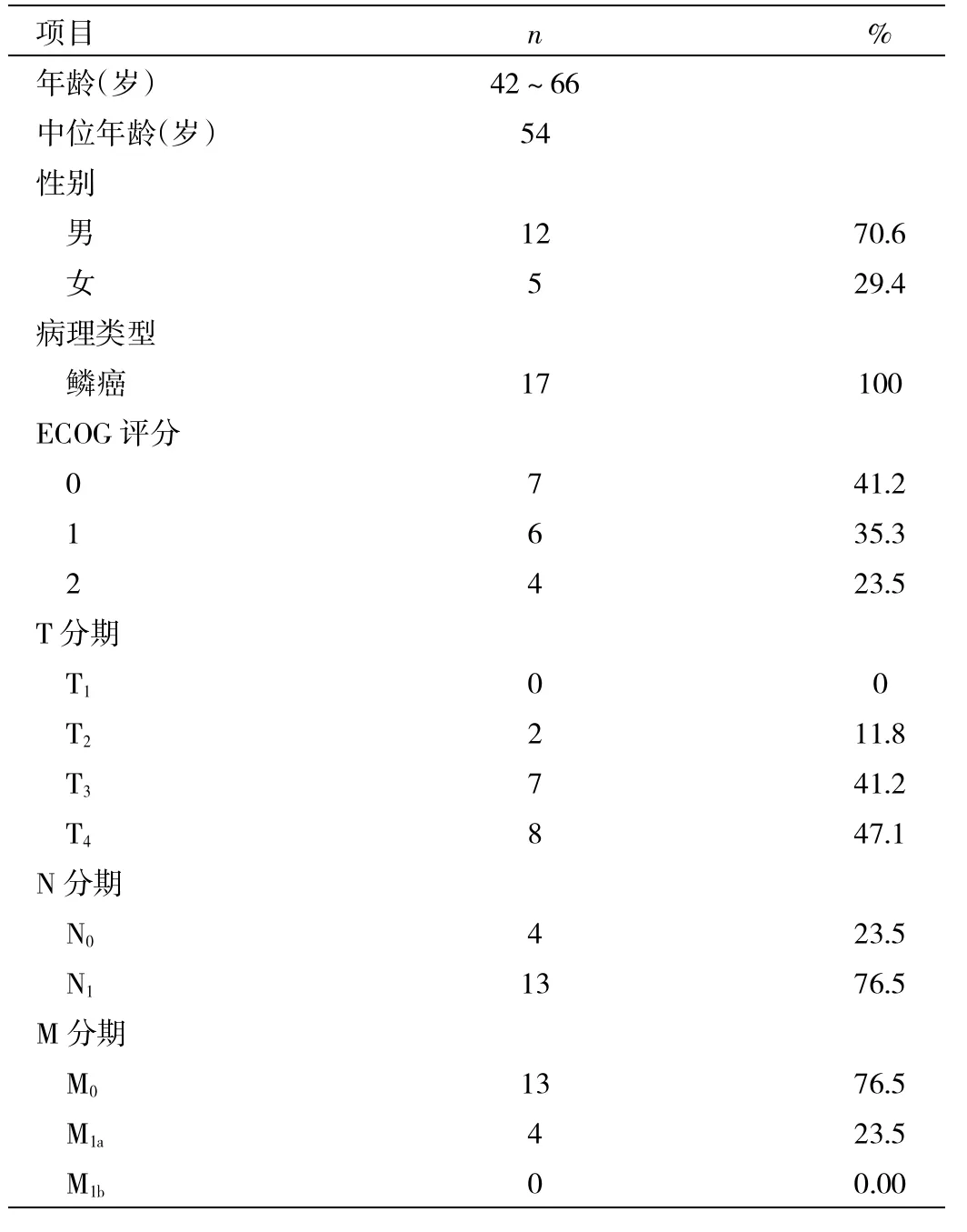
表1 17例患者的一般临床资料
1.2 放射治疗 治疗前患者取仰卧位,双手交叉抱肘置前额,真空负压成型垫固定体位,行CT模拟定位增强扫描,扫描层厚0.5cm,图像经数字化传输,三维重建进入Pinnacle三维适形计划系统,进行图像重建,由主治医师以上的医师勾画靶区。靶区的定义:结合食管钡餐造影、胃镜检查以及CT显示的病变及外侵范围为肿瘤靶区(GTV),纵隔及锁骨上肿大淋巴结定义为GTVnd,GTV前后左右方向各外放0.5~0.8cm,上下方向外放3.0~5.0cm为临床靶区(CTV),CTV再均匀外放0.5cm为计划靶区(PTV),在遇到大血管、椎体、心包、胸壁等具有屏障作用的器官时,则外扩范围予适当修改。同时勾画邻近组织和器官,如脊髓、气管、心脏及双肺。勾画完毕后输入处方剂量,通过对比观察评价剂量一体积直方图(DVH)与平面二维等剂量线图。选择最佳治疗计划,均采用6MV-X线等中心照射,Varian EX 23直线加速器实施治疗。靶区处方剂量定义:GTV、GTVnx:2.2Gy/ fx,1次/d,5次/周,总剂量DT 60~66Gy左右,中位放疗总剂量DT 61.6Gy左右。并要求PTV∶1.8~2.0Gy/fx,1次/ d,5次/周,95%PTV DT≥54Gy。危及器官剂量限定为:脊髓≤40Gy,且脊髓无超过45Gy的热点,双肺V20<30%,V30<20%,全肺平均剂量<13Gy,心脏V40<50%[8]。
1.3 尼妥珠单抗治疗 放疗第1天起即同时尼妥珠单抗(商品名:泰欣生,规格:50mg/支,百泰生物药业有限公司生产)治疗,每周首日放疗前4h给1次200mg的尼妥珠单抗溶于250m 10.9%氯化钠注射液中静脉滴注,滴注时间在1h以上,共计划6~8次。使用尼妥珠单抗当天使用地塞米松针5mg静脉推注预防过敏反应,并严密监视生命体征。
1.4 不良反应观察 根据患者治疗中,治疗后随访的症状、体征以及实验室检查、辅助检查,正常组织急性期放疗反应按美国肿瘤放射治疗协作组(RTOG)标准评价,分为0~4级[9]。尼妥珠单抗毒性按照WHO抗癌药物急性和亚急性毒性表现及分级标准[10]观察评价,分为0~Ⅳ级。
1.5 近期疗效评价及随访 所有患者在治疗结束时,以及结束后1、3、6个月左右随访时分别复查食管钡餐、胸部增强CT,并与其治疗前的食管钡餐及胸部增强CT进行对比。评价标准参考万均等[11]提出的食管癌放疗后近期疗效评价标准进行评价:完全缓解(CR):所有可见病灶均完全消失,钡剂通过顺畅,管腔无狭窄或稍显狭窄,疗效维持4周以上;部分缓解(PR):病灶最大双径乘积总和缩小50%以上,并在至少4周后复测确认,钡剂通过尚顺畅,边缘欠光滑有小的充盈缺损或小完影;稳定病情(SD):病灶最大双径乘积总和增大<25%或缩小不足25%,无新病灶出现,并在至少4周后复测确认,钡餐见病变有残留或病变无明显好转;病情进展(PD)∶病灶最大双径乘积总和增大>25%,或出现新病灶,钡餐见完影或狭窄加重。以CR+PR计算有效率(RR),以CR+PR+SD计算疾病控制率(DCR)。
2 结果
2.1 近期疗效 17例患者都按计划完成放疗及同步尼妥珠单抗靶向治疗,并且按计划完成随访。随访时间4~16个月;见表2。
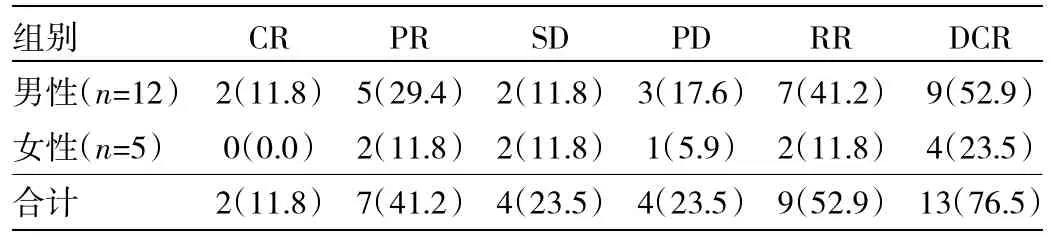
表2 17例局部晚期食管癌联合尼妥珠单抗同步放疗疗效[例(%)]
2.2 不良反应评价 常见的急性毒副反应有咳嗽、发热、吞咽疼痛、乏力、胃纳下降、腹泻等。与放疗相关的不良反应为放射性食管炎、放射性肺炎、气管炎、骨髓抑制、放疗野区皮肤反应等,与尼妥珠单抗相关的有发热、皮疹、腹泻等;见表3。

表3 17例局部晚期食管癌患者的急性毒副反应[例(%)]
3 讨论
我国是食管癌高发的国家,由于大部分患者发现时病期较晚,失去了手术机会,因此对于局部晚期,难以手术的患者,同步放化疗为NCCN指南推荐的标准治疗[12]。然而,化疗药物由于其缺乏选择性,全身毒副反应重,且大多数患者因食管癌晚期,进食少,体重下降,营养状况较差,免疫力低下,难以耐受同步放化疗的不良反应,因此亟需寻找高效、低毒的药物来配合放疗,提高疗效。
表皮生长因子(EGF)是一种促进细胞有丝分裂的细胞因子,与其受体(EGFR)结合后,可调节细胞的增殖、分化和转移等。EGFR在人类的各种恶性肿瘤中都有过表达,比如头颈部肿瘤、肺癌、食管癌、结直肠癌、前列腺癌、宫颈癌、胰腺癌等,而其过表达后导致肿瘤的发生、发展,侵袭性增加,血管生成密度增加,细胞修复增加,细胞凋亡减缓,使肿瘤对放疗的敏感性下降,对放疗产生抵抗,预后较差[13-14]。
各种研究表明,EGFR在食管癌中的表达率为40%~80%[15-16]。尼妥珠单抗是一种人源化的EGFR单克隆抗体,具有高选择性,长半衰期的特点。它能竞争性地与配体与EGFR结合,使受体失去活性,由此而阻断下游信号传导,阻止肿瘤细胞周期的进展,阻止肿瘤细胞增殖,促进肿瘤细胞凋亡。它能阻止新生血管生成,并通过细胞周期阻滞,使肿瘤细胞停滞在G1期这一对放疗较为敏感的细胞周期,有放疗增敏的作用[17]。
研究证明,尼妥珠单抗在EGFR高表达的头颈部肿瘤、肺癌、高级别的胶质瘤等肿瘤中,都显示出很强的抗肿瘤活性,与放疗、化疗结合后能提高治疗的有效率,促进肿瘤的缩小,提高局部控制率[18-20]。然而,尼妥珠单抗在局部晚期食管癌的治疗研究,在国内外均鲜有报道。
本研究采用尼妥珠单抗联合三维适形放疗治疗局部晚期食管癌,CR2例,PR7例,SD4例,缓解率RR为52.9%,疾病控制率DCR为76.5%,显示出良好的治疗反应率,近期疗效较好。在毒副反应方面,患者耐受性良好,所有患者都完成放疗,并且均接受6次以上的尼妥珠单抗治疗。无一例患者出现4级放射不良反应。放射性肺炎、放射性食管炎、放疗野区皮肤反应、腹泻均分别出现1例3级不良反应,血白细胞下降出现2例3级不良反应,经对症、支持治疗后均好转,能继续放疗,并且不能确定与尼妥珠单抗完全相关。而在治疗前担心的皮疹,仅出现2例(11.8%)1级不良反应,经外用卤米松软膏治疗后好转。而在另一个EGFR单克隆抗体西妥昔单抗(C225)的研究中,皮疹是常见的不良反应。其3到4级皮疹发生率可达30%左右[21],这可能与尼妥珠单抗为高度人源化的单克隆抗体,抗原性较小,而C225为人鼠嵌合型单克隆抗体,抗原性较强有关。在本研究中,我们采用的剂量为每周200mg的尼妥珠单抗,而在已经发表的一些基础研究中,即使每周予400mg的尼妥珠单抗,患者耐受性良好,未出现严重不良反应[22]。
鉴于以上的讨论结果,我们认为,尼妥珠单抗联合三维适形放疗治疗局部晚期食管癌,近期疗效好,不良反应轻。由于国内外相关研究少,缺乏Ⅲ期大样本的临床随机对照研究,因此我们建议,有必要组织进行多中心的随机对照研究来进一步探讨该方案的远期疗效和不良反应。
[1]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[2] Cunningham D,Allum W H,Stenning S P,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355:11-20.
[3] Sjoquist K M,Burmeister B H,Smithers B M,et al.Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma:an updated meta-analysis[J].Lancet Oncol,2011,12:681-692.
[4]Cooper J S,Guo M D,Herskovic A,et al.Chemoradiotherapy of locally advanced esophageal cancer:long-term followup of a prospective randomized trial(RTOG 85-01)Radiation Therapy Oncology Group[J].JAMA,1999,281:1623-1627.
[5] Minsky B D,Pajak T F,Ginsberg R J,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phase III trial of combinedmodality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J].J Clin Oncol,2002,20:1167-1174.
[6]黄晓东,易俊林,高黎,等.抗表皮生长因子受体单克隆抗体h-R3联合放疗治疗晚期鼻咽癌的Ⅱ期临床研究 [J].中华肿瘤杂志,2007,29 (3):197-201.
[7] 汪洋,潘力,毛颖,等.尼妥珠单抗联合放疗加同期替莫唑胺治疗高分子胶质瘤的初步研究[J].中国癌症杂志,2009,19(11):836-860.
[8]肖泽芬主编.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:546-77.
[9]殷蔚伯,余子豪,胡逸民,主编.肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2008:1350-1351.
[10]潘宏铭,耿宝琴,主编.肿瘤化疗的毒副反应和防治[M].上海:上海科学技术出版社,2001:226-227.
[11]万均,高献书,主编.食管癌单纯外照射结束时(近期疗效)的评价及标准[M].北京:原子能出版社,2000:46-49.
[12]Ajani J A,Barthel J S,Bentrem D J,et al.Esophageal and esophagogastric junction cancers[J].J Natl Compr Canc Netw,2011,9: 830-887.
[13]Modjtahedi H,Essapen S.EPidermal growth factor receptor inhibitors in cancer treatment:advances,challenges and opportunities[J].Antican cer Drugs,2009,20(10):851-855.
[14]张和平,李建成.表皮生长因子受体在食管癌放疗中的应用[J].国际肿瘤学杂志,2012,39(3):218-220.
[15]Boone J,van H R,Oferhaus G J,et a1.Targets for molecular therapyin esophageal squamous cell carcinoma:an immunohistochemical analysis[J].Dis Esophagus,2009,22(6):496-504.
[16]陈占军,吉庆春.LRIG1和EGFR在食管鳞状细胞癌中的表达与意义[J].中国实用医刊,2011,38(4):9-11.
[17]Rojo F,Gracias E,Villena N,et al.Pharmacodynamic trial of nimotuzumab in unresectable squamous cell carcinoma of the head and neck:a SENDO Foundation study[J].Clin Cancer Res, 2010,16:2474-2482.
[18] Solit D B,Rosen N.Hsp90:a novel target for cancer therapy[J].Curr Top Med Chem,2006,6:1205-1214.
[19]Akashi Y,Okamoto I,Iwasa T,et al.Enhancement of the antitumor activity of ionising radiation by nimotuzumab,a humanised monoclonal antibody to the epidermal growth factor receptor,in non-small cell lung cancer cell lines of differing epidermal growth factor receptor status[J].Br J Cancer,2008,98:749-755.
[20]Giezen T J,Mantel Teeuwisse A K,Straus S M,et al.Safetyrelated regulatory actions for biologicals approved in the United States and the European Union[J].JAMA,2008,300:1887-1896.
[21] Lorenzen S,Schuster T,Porschen R,et al.Cetuximab plus cisplatin-5-fluorouracil versus cisplatin-5-fluorouracil alone in first-line metastatic squamous cell carcinoma of the esophagus:a randomized phase II study of the Arbeitsgemeinschaft Internistische Onkologie[J].Ann Oncol,2009,20:1667-1673.
[22]Kuaile zhao,Xichun Hu,Xiang hua Wu,et al.A phase I dose escalation study of Nimotuzumab in combination with concurrent chemoradiation for patients with locally advanced squamous cell carcinomaofesophagus[J].InvestNewDrugs,2012,30:1585-1590.
2014-03-11)
(本文编辑:田云鹏)
315020 宁波市第二医院肿瘤放疗科
饶创宙,E-mail:chuangzhourao@aliyun.com

