灌注保存对猪离体供心冠脉和心肌保护效果的研究
胡志斌 严志焜 王海涛 孟群 潘晓华
灌注保存对猪离体供心冠脉和心肌保护效果的研究
胡志斌 严志焜 王海涛 孟群 潘晓华
目的 观察不同保存方法及不同灌注容量对猪离体供心冠脉血管因子表达和心肌细胞保护效果的影响。 方法 巴拿马小型香猪共36只,根据保存技术不同分为浸泡保存组和间断灌注保存组,间断灌注容量分别为50、100、150、200、250ml,每组6只。灌注液为30μmol/L二氮嗪强化Celsior液,保存温度为4℃,时间10h。保存后比较各组间冠脉血管中内皮型一氧化氮合成酶(eNOS)、内皮素-1(ET-1)、细胞黏附分子-1(ICAM-1)表达情况,以及心肌细胞凋亡情况、心肌组织ATP含量(ATPC)、心肌含水量(MWC)。 结果 间断灌注保存各组较浸泡保存组能维持较高的ATP水平,减少心肌细胞凋亡,降低MWC;而eNOSmRNA表达量高于浸泡保存组,ET-1mRNA和ICAM-1mRNA表达量却低于浸泡保存组(P<0.05)。当灌注容量为50~200ml时,随着灌注容量的增加,ATPC和eNOSmRNA表达量逐渐增高,凋亡指数、MWC、ET-1mRNA和ICAM-1mRNA表达量则逐渐降低;继续增加灌注容量至250ml时,各指标并无显著变化。 结论 在长时间心脏保存中,每隔2h灌注1次,每次灌注容量为200ml能较好保护供心;当灌注容量低于200ml时,随着灌注容量的增加供心保护效果逐渐增强,且对冠脉和心肌的保护作用具有等同性。
灌注保存 内皮细胞血管因子 心肌保护
近年来,学者们普遍认为间断灌注保存较持续灌注保存对心肌的保护作用更好[1-2]。如何使间断灌注保存对心肌保护的作用达到最佳,关键在于掌握适宜的灌注压力、流速、时间等参数。心脏移植供心的保护包含心肌细胞保护和血管细胞(内皮细胞和平滑肌细胞)保护,在心脏保存期间,应用同一种保存技术对供心心肌和血管细胞的保护作用是否等同,亦仍未明了。因此,笔者利用二氮嗪强化Celsior液,比较不同保存方法和不同灌注容量(间接反映灌注压力和流速)间断灌注进行猪离体供心心肌和血管保护效果的差异,以期提高供心保存质量,现将结果报道如下。
1 材料和方法
1.1 材料 二氮嗪强化Celsior液由本室配制,用于心脏的停搏和灌注保存,其配制成分及含量(mmol/L):二氮嗪30、Na+100、K+15、Cl-41.5、Mg2+13、Ca2+0.25、甘露醇60、乳糖酸80、组氨酸30、谷氨酸20、还原型谷胱甘肽3,pH 7.4,渗透压320mOsm/L。所需试剂均购自上海思域化工科技有限公司。二氮嗪为美国Sigma公司产品。Tunel细胞凋亡试剂盒购自上海碧云天生物技术有限公司。PCR测定试剂盒购自宝生物工程(大连)有限公司。
1.2 建立模型 巴拿马小型香猪共36只,体重30~35kg,由浙江医学科学研究院提供。实验猪麻醉前12h禁食,但不禁水。氯胺酮15mg/kg联合咪唑安定1mg/kg肌肉注射麻醉,气管插管辅助通气。3mg/kg全身肝素化后,正中开胸暴露心脏,将停搏液灌注管置于主动脉根部,阻断升主动脉,二氮嗪强化Celsior液灌注心脏,灌注流量30ml/kg,灌注时间5min,致使停搏。迅速切断各动静脉血管,摘取供心,置4℃二氮嗪强化Celsior液中保存。根据供心保存技术分为6组:(1)浸泡保存组(6只):供心取出后静置保存于4℃二氮嗪强化Celsior液中10h,随后取出制取标本;(2)灌注保存组:供心取出后保存于4℃二氮嗪强化Celsior液中10h,期间每隔2h灌注4℃二氮嗪强化Celsior液1次,30 min/次;根据间断灌注容量分为50、100、150、200和250ml灌注保存组(各组6只),随后取出制取标本。
1.3 实验检测指标及测定方法
1.3.1 冠脉血管内皮型一氧化氮合成酶(eNOS)、内皮素1(ET-1)、细胞黏附分子(ICAM-1)检测 各组留取冠脉左前降支血管2mm置冰浴匀浆器中,加入Trizol进行Total RNA提取,SY月R Green Assay体系进行cDNA反转录,以及MX3000PPCR扩增仪进行荧光定量检测eNOS、ET-1和ICAM-1指标的相对mRNA表达量。
1.3.2 心肌组织凋亡指标 各组留取一小块左心室前壁心肌为标本,采用原位末端标记法测定心肌细胞凋亡情况,并计算心肌细胞凋亡指数(apoptosis index,AI)。心肌组织ATP含量(ATPC):留取小块左心室肌组织,立即投入液氮中冻存;采用ATP检测试剂盒进行免疫荧光法测定,通过标准曲线计算出样本中ATPC。心肌含水量(myocardial water content,MWC):留取小块左心室肌组织,用滤纸拭干,称取湿重后置80℃烘箱中烘烤48h,再称取心肌干重。MWC=(湿重-干重)/湿重×100%。
1.4 统计学处理 应用SPSS 13.0统计软件,计量资料采用表示,多组间比较采用单因素方差分析,两两比较采用LSD法。
2 结果
灌注保存组eNOSmRNA表达量高于浸泡保存组,ET-1mRNA和ICAM-1mRNA表达低于浸泡保存组;当灌注容量为50~200ml时,随着灌注容量的增加,eNOSmRNA表达量逐渐增高,ET-1mRNA和ICAM-1mRNA表达量逐渐降低;继续增加灌注容量为250ml时,各指标无显著性变化。其中50ml灌注组与100ml灌注组eNOSmRNA表达量的差异无统计学意义(P>0.05);150、200与250ml灌注组ET-1mRNA和ICAM-1mRNA表达量的差异无统计学意义(P>0.05)。浸泡保存组心肌细胞凋亡最多,ATPC最少,MWC最多。200ml和250ml灌注组心肌细胞凋亡较少,ATPC较高,心肌水肿程度较轻,两组间差异无统计学意义(P>0.05),但与50、100、150ml灌注组比较差异有统计学意义(P<0.05),详见表1。
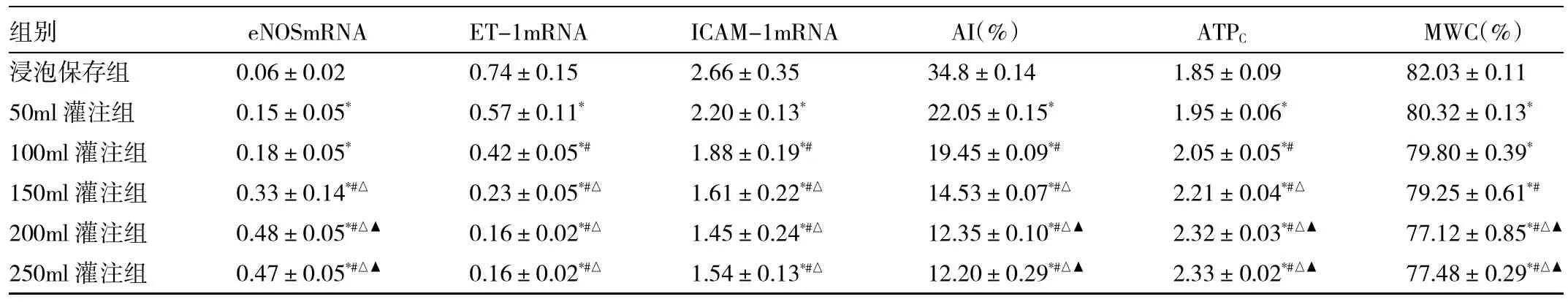
表1 各组相关检测指标的比较
3 讨论
心脏移植时,供体心脏保护的好坏直接影响心脏移植的效果。本研究保存液采用二氮嗪强化Celsior液,是一种添加ATP敏感性钾离子通道开放剂——二氮嗪(30μmol/L)的Celsior液,曾被认为具有良好的心肌保护效果[3];保存技术选择不同容量的间断灌注保存与持续浸泡保存,分析其在血管内皮和平滑肌保护作用的差异。研究结果显示,灌注保存对供心在心肌和血管细胞上的保护作用优于持续浸泡保存;在50~200ml间断灌注容量保存时,随着灌注容量的逐渐增加,心肌ATPC储备和eNOSmRNA表达量逐渐增高;心肌细胞凋亡逐渐减少,心肌水肿程度逐渐减轻,ET-1mRNA和ICAM-1mRNA表达逐渐降低;继续增加灌注容量至250ml时,心肌ATPC储备和eNOSmRNA表达并未显著增多;心肌细胞凋亡、水肿未显著减轻,ET-1mRNA和ICAM-1mRNA表达量亦未显著降低,说明灌注容量为200ml时,能较好地保护心肌细胞,以及血管舒张功能和抑制炎性介质的释放。
心脏移植过程中,供心将遭受获取期的热缺血、暂存期的冷缺血及移植后的缺血再灌注等阶段的损伤,其中供心暂存期的损伤程度受人为因素影响较明显,因此在暂存期尽量维持心脏正常营养的供给及代谢产物的排出至关重要。本研究发现,采用低温、间断灌注二氮嗪强化Celsior液的保存方法可减轻冷缺血损伤,使供心心肌细胞和血管细胞功能都得到优质的保护,其可能原因如下:首先,低温降低了心肌代谢率,减少了氧耗和能耗[4-5],同时冠状动脉内皮也能较好地耐受低温[6]。器官保存液——Celsior液是心脏专用保存液,该保存液中钾含量低,能避免冠脉血管的损伤[7-8]。二氮嗪是线粒体敏感性钾离子通道开放剂,将其加入Celsior液具有维持细胞内ATP浓度、保护线粒体的功能;减少心肌酶漏出,降低活性氧产生,以及较少发生再灌注后心律失常和心肌收缩功能异常等作用[3,9],可使冠状动脉血管平滑肌细胞膜超极化,促进心脏停搏后的血管舒张功能等[10]。再者,间断灌注保存技术提供了适宜的能量底物以及带走相应的有害代谢产物,同时减轻了持续灌注保存中心肌细胞水肿和血管内皮损伤的程度。30min内给予50~200ml的灌注容量,其流量介于Wicomb等[11]报道的0.002~0.004ml/(g·min)微流量灌注和Rosenbaum等[12]报道的0.1ml/(g·min)低流量灌注之间,心脏保存效果均良好。在200ml的灌注容量以内,随着灌注容量的增加,血管内皮感受血流剪切应力和静水压力等生物力学的变化,并没有引起过分调节内皮功能和结构,如刺激细胞因子、一氧化氮合成酶的释放,从而介导炎性介质的表达等,进而引起内皮细胞功能障碍或异常增值[13],而是随着容量的增加更好地维持了心肌细胞ATP含量,减少了心肌细胞凋亡,降低了无氧酵解代谢产物和炎性介质对血管内皮的损害。当增加灌注容量至250ml时,与200ml灌注容量心脏保护效果相当,并未见显著增强或加重损害。但继续增加灌注容量,达到或超过Peltz等[14]报道的较大流量灌注15ml/(g·min)时,心肌细胞和血管内皮细胞的保护作用是否同步增强可能值得进一步探讨。
综上所述,长时间心脏保存,间断灌注保存具有较好地供心保护作用,且每隔2h灌注1次,每次灌注容量为200ml时心肌细胞保护作用最好,血管细胞的保护作用也最佳。
[1]Rivard A L,Hellmich C,Swingen C M,et al.Intermittent antegrade cardioplegia:isolated heart preservation with the Asporto heart preservation device[J].Prog Transplant,2008,18(2):127-133.
[2] Nameki T,Takeyoshi I,Oshima K,et al.A comparative study of long-term heart preservation using 12-h continuous coronary perfusion versus 1-h coronary perfusion following 11-h simple immersion[J].J Surg Res,2006,135(1):107-112.
[3]Yan Z K,Hu Z B,Pan X H,et al.Diazoxide supplemented Celsior solution improves hypothermic heart preservation effect in rat through activation of mitochondrial ATP-sensitive potassium channel[J].Pharmaceutical Biology,2009,47(11):1060-1066.
[4] Lima M L,Fiorelli A I,Vassallo D V,et al.Deleterious effect of hypothermia in myocardial protection against cold ischemia:a comparative study in isolated rat hearts[J].Transplant Proc,2012,44 (8):2326-3232.
[5]Drescher C,Diestel A,Wollersheim S,et al.How does hypothermia protect cardiomyocytes during cardioplegic ischemia[J]?Eur J Cardiothorac Surg,2011,40(2):352-359.
[6] Iwaki H,Sakamoto A,Tanaka S.Effects of temperature and preservation time on the pharmacological response of isolated vascular endothelial and smooth muscle function[J].Nihon Ika Daigaku Zasshi,1999,66(1):15-20.
[7]Oberleithner H,Callies C,Kusche-Vihrog K,et al.Potassium softens vascular endothelium and increases nitric oxide release[J].Proc Natl Acad Sci USA,2009,106(8):2829-2834.
[8]He F J,Marciniak M,Carney C,et al.Effects of potassium chloride and potassium bicarbonate on endothelial function,cardiovascular risk factors,and bone turnover in mild hypertensives[J].Hypertension,2010,55(3):681-688.
[9]郭炜,沈岳良,陈莹莹,等.二氮嗪在长时程心脏低温保存中的作用[J].生理学报,2004,56(5):632-638.
[10] Coetzee W A.Multiplicity of effectors of the cardioprotective agent,diazoxide[J].Pharmacol Ther,2013,140(2):167-175.
[11]Wicomb W N,Collins G M.24-hour rabbit heart storage with UW solution.Effects of low-flow perfusion,colloid,and shelf storage [J].Transplantation,1989,48(1):6-9.
[12]Rosenbaum D H,Peltz M,DiMaio J M,et al.Perfusion preservation versus static preservation for cardiac transplantation:effects on myocardial function and metabolism[J].J Heart LungTransplant,2008,27(1):93-99.
[13]Desrois M,Caus T,Belles P M,et al.Limitation of myocardial and endothelial injury of the rat heart graft after preservation with Centre de Résonance Magnétique Biologique et Médicale (CRMB)solution[J].Transpl Int,2008,21(3):276-283.
[14]Peltz M,Cobert M L,Rosenbaum D H,et al.Myocardial perfusion characteristics during machine perfusion for heart transplantation[J].Surgery,2008,144(2):225-232.
Intermittent perfusion for protection of coronary endothelium and myocardium in isolated pig hearts
ObjectiveTo compare the protective effect of different preservation methods on coronary endothelium and myocardium in isolated pig hearts.Methods Thirty six hearts isolated from Bama-miniature-pigs were divided into 6 groups:one static storage group and 5 intermittent perfusion groups with 6 in each group.Isolated heart in storage group were preserved in Celsior cardioplegia solution enhanced with diazoxide (DE,30μmol/L)at 4℃for 10h;isolated hearts in perfusion groups underwent intermittent perfusion with 50,100,150,200 or 250ml solution respectively,every 2 h for 10 h.Then the samples of left ventricle and left anterior descending coronary artery were taken and apoptotic cardiomyocytes(AI),adenosine triphosphate concentrations(ATPC),myocardial water content(MWC),endothelial nitric oxide synthase(eNOS),endothilin-1(ET-1)and intercellular adhesion molecule-1(ICAM-1)were measured.Results Compared with static storage group,the ATPC,eNOSmRNA in perfusion groups were significantly higher and AI,MWC,ET-1mRNA,ICAM-1mRNA were significantly lower.ATPCand eNOSm-RNA were gradually increased and AI,MWC,ET-1mRNA,ICAM-1mRNA were gradually reduced with the perfusion solution increasing in a range of 50ml to 200ml.There were no significant differences between 200ml and 250ml intermittent perfusion group.Conclusion Intermittent perfusion of preservation solution provides better protective effect on myocardium and endothelium of coronary artery in isolated donor hearts.
Intermittent perfusion Endothelium-derived factorMyocardial protection

2013-12-30)
(本文编辑:严玮雯)
浙江省自然科学基金项目(LY12H02007)
310014 杭州,浙江省人民医院浙江省器官移植重点实验室心脏分室
胡志斌,E-mail:hulinet169@163.com

