硫酸钙晶须对磷的静态吸附
邱学剑,刘 江,杨成志,刁梦娜,秦 军,吕 晴
(1. 贵州大学 喀斯特环境与地质灾害防治教育部重点实验室,贵州 贵阳 550003;2. 贵州大学 材料与冶金学院,贵州 贵阳 550003)
磷是引起水体富营养化的主要因素,当水体含磷超过0.02 mg/L时,就会导致富营养化[1]。因此,减少废水中磷的含量可有效控制水体的污染。磷的去除方法较多,其中,吸附法利用吸附剂优越的表面性能和特殊的化学性质,对废水中的磷有较好的去除效果[2]。
硫酸钙晶须具有粒径小、比表面积大、表面自由能高等优点[3],对废水中的杂质有一定的吸附能力;另外,硫酸钙晶须在水中电离出钙离子,能与磷酸盐发生反应,生成磷酸盐沉淀,有利于无机磷酸盐的去除。目前,硫酸钙晶须主要用于提高塑料、橡胶等聚合物的性能,用于废水处理的研究鲜有报道。姚京君[4]以硫酸铵和氯化钙为原料、采用超声法合成的硫酸钙晶须,对磷的饱和吸附量仅为0.731 mg/g。而以磷石膏废渣为原料制备硫酸钙晶须,并将其用于废水除磷的研究,尚未见报道。
本工作以磷石膏废渣为原料制备硫酸钙晶须,考察了硫酸钙晶须对模拟含磷废水中磷的去除效果,分析了初始废水pH、初始磷质量浓度、硫酸钙晶须加入量对吸附的影响,研究了硫酸钙晶须对磷的吸附等温线,同时对吸附机理进行了探讨。
1 实验部分
1.1 试剂、材料和仪器
KH2PO4、酒石酸锑钾、钼酸铵、抗坏血酸、NaOH、硫酸:分析纯。
模拟含磷废水:配制磷质量浓度为1 000 mg/L的KH2PO4贮备液,使用时以去离子水稀释至所需磷质量浓度,用1 mol/L的硫酸或1 mol/L的NaOH溶液调节pH。
硫酸钙晶须:采用磷石膏废渣(由贵州瓮福集团提供)通过水热法制备[5],平均直径0.17 μm,长径比56.24,形貌规整、分散均匀。硫酸钙晶须中各元素的含量见表1,硫酸钙晶须的SEM照片见图1。
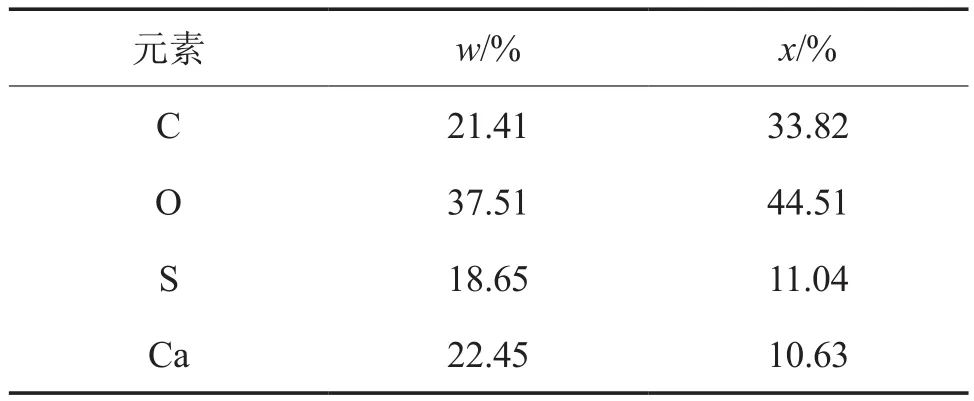
表1 硫酸钙晶须中各元素的含量

图1 硫酸钙晶须的SEM照片
752型紫外-可见分光光度计:上海菁华科技仪器有限公司;PHS-3C型pH计:上海佑科仪器仪表有限公司;JSM-7500F型场发射扫描电子显微镜:日本电子株式会社;X-Max SDD型能谱仪:牛津仪器公司;SHA-C型恒温振荡器:常州澳华仪器有限公司。
1.2 实验方法
将100 mL废水和一定量的硫酸钙晶须加入250 mL锥形瓶中,置于25 ℃恒温振荡器中进行静态吸附,调节振荡器皮带转速为100 r/min,振荡1 h(吸附等温线实验需振荡24 h),离心,取上清液进行测定。
1.3 分析方法
采用SEM技术观察硫酸钙晶须的微观形貌;采用能谱仪(活区面积50 mm2)测定硫酸钙晶须中各元素的含量。
按照GB 11893—1989《水质 总磷的测定 钼酸铵分光光度法》[6],用酒石酸锑钾、钼酸铵、抗坏血酸等试剂测定吸附上清液中的磷质量浓度,计算硫酸钙晶须对磷的吸附量及去除率。
2 结果与讨论
2.1 磷吸附效果的影响因素
2.1.1 初始废水pH
当初始磷质量浓度为20 mg/L、硫酸钙晶须加入量为1.0 g/L时,初始废水pH对磷吸附效果的影响见图2。

图2 初始废水pH对磷吸附效果的影响● 磷去除率;■ 磷吸附量
由图2可见:初始废水pH对吸附效果影响显著,随pH增大,磷的去除率和吸附量都呈上升趋势,尤其当pH从7增大到8时,磷去除率增加最快,说明碱性环境有利于磷的去除;当pH>8时,磷去除率均在94.0%以上,当pH为10和12时,去除效果最好,磷去除率均在99.9%以上,而pH<6时,磷去除率均小于50.0%。这是因为,在碱性条件下,废水中存在易与钙离子形成沉淀,且随pH增大,沉淀的溶解度减小;同时,在酸性条件下,硫酸钙晶须更稳定、活性更低。综合考虑去除效果和经济效益,选择pH=10为最佳条件。
2.1.2 初始磷质量浓度
当初始废水pH为10、硫酸钙晶须加入量为1.0 g/L时,初始磷质量浓度对磷吸附效果的影响见图3。

图3 初始磷质量浓度对磷吸附效果的影响● 磷去除率;■ 磷吸附量
由图3可见:随初始磷质量浓度的增加(5~150 mg/L),磷的去除率从接近100%降至74.74%,吸附量从5.00 mg/g增至112.11 mg/g,这表明,初始质量浓度是影响吸附效果的一个重要因素;当初始磷质量浓度为5~100 mg/L时,去除率均在93.0%以上。这可能是由于以下三个原因:1)当磷质量浓度较高时,活性位点与磷的结合达到饱和;2)磷质量浓度越高,可供硫酸钙晶须吸附的磷就越多;3)磷质量浓度越高,溶液与晶须表面液膜之间磷的浓度差就会越大,就会促使磷向硫酸钙晶须表面迁移,从而吸附的磷更多,直到平衡[7]。
2.1.3 硫酸钙晶须加入量
当初始废水pH为10、初始磷质量浓度为50 mg/L时,硫酸钙晶须加入量对磷吸附效果的影响见表2。由表2可见:硫酸钙晶须加入量越大,对磷的吸附效果越好,这是因为,增大加入量即增加了吸附的活性位点,从而导致磷去除率增大[8];当加入量为1.5 g/L时,上清液TP为0.419 mg/L,低于GB 18918—2002《城镇污水处理厂污染物排放标准》[9]中一级A标准规定的限值(0.5 mg/L);磷吸附量随硫酸钙晶须加入量的增加而逐渐减少,吸附剂的有效利用率逐渐降低。综合考虑上清液TP、经济效益和吸附量,确定最佳硫酸钙晶须加入量为1.5 g/L,即0.03 g/mg(以磷计),此时磷的去除率达到99.16%。

表2 硫酸钙晶须加入量对磷吸附效果的影响
2.2 吸附等温线
Langmuir等温吸附模型适用于包含有限相同吸附位点的单层吸附[10],其方程表达如下:

式中:qe和qsat分别为硫酸钙晶须对磷的平衡吸附量和饱和吸附量,mg/g;ρ0和ρe分别为初始和吸附平衡时的磷质量浓度,mg/L;KL为Langmuir等温吸附方程的平衡常数;RL为Langmuir分布系数。
Freundlich等温吸附模型适用于非均相体系[11],其方程表达如下:

式中:n和KF均为Freundlich常数。1/n反映出溶液初始浓度变化对材料吸附能力的影响程度,1/n越小,表明吸附能力越强;一般认为,1/n为0.1~1.0时吸附容易进行,1/n大于2.0时,吸附很难进行[12]。
当初始废水pH为10、硫酸钙晶须加入量为1.0 g/L时,将不同初始磷质量浓度废水的等温吸附数据用Langmuir和Freundlich等温吸附模型进行拟合,得到硫酸钙晶须对磷的等温吸附方程,见表3。由表3可见,两种等温吸附方程的相关系数均在0.95以上,且Langmuir等温吸附模型的拟合度比Freundlich模型高,这说明硫酸钙晶须对废水中磷的吸附更倾向于单分子层吸附(化学吸附)。由Langmuir等温吸附方程得出:硫酸钙晶须对磷的饱和吸附量为140.4 mg/g,在初始磷质量浓度为5~500 mg/L范围内,RL=0.191~0.002,在0~1之间,说明吸附作用比较容易发生[10]。由Freundlich等温吸附方程得出:1/n为0.150,表明硫酸钙晶须对磷的吸附很容易进行。

表3 硫酸钙晶须对磷的等温吸附方程
2.3 硫酸钙晶须吸附除磷机理分析
硫酸钙晶须的吸附除磷过程可看作是物理吸附和化学吸附同时并存的过程。一方面,由于硫酸钙晶须比表面积大,表面能高,在水中分散均匀,因此有较强的物理吸附能力,且硫酸钙晶须的比表面积越大则物理吸附效果越好;另一方面,可能存在配位作用,硫酸钙晶须进入水中后,表面易被羟基化,产生—OH,这些—OH有的单独存在,有的互相缔合,磷酸根可与之交换而被吸附[3]。
硫酸钙晶须对磷酸盐的吸附以化学吸附为主。不同pH下溶液中磷酸根离子的形态不同,pH<3时溶液中主要存在H3PO4,pH=5~7时主要存在pH=7~10时主要存在pH>10时开始出现pH>12时主要存在当磷酸根水解时,硫酸钙晶须表面不断电离出Ca2+,与磷酸盐形成化学沉淀,反应式如下[13]:

当pH>9.5时,生成的Ca3(PO4)2沉淀又可以进一步转变为更稳定的Ca(5OH)(PO4)3沉淀,这也解释了硫酸钙晶须在碱性条件下吸附效果好的现象,同时也证明了化学吸附的存在。具体反应式如下:

3 结论
a)硫酸钙晶须在碱性条件下对磷的去除率较酸性条件下高,且初始废水pH为10时去除效果最佳。在初始废水pH为10、硫酸钙晶须加入量为1.0 g/L、初始磷质量浓度为5~100 mg/L的条件下,反应1 h时,磷的去除率均在93.0%以上。
b)最佳硫酸钙晶须加入量为0.03 g/mg(以磷计)。在初始废水pH为10、初始磷质量浓度为50 mg/L、硫酸钙晶须加入量为1.5 g/L的条件下,反应1 h时,磷的去除率达到99.16%,上清液TP为0.419 mg/L,低于GB 18918—2002中一级A标准规定的限值(0.5 mg/L)。
c)与Freundlich模型相比,Langmuir等温吸附模型更适合描述硫酸钙晶须对磷的吸附过程。采用该模型拟合得出25 ℃下磷的饱和吸附量为140.4 mg/g。
[1] 周光红. 几种固体废弃物吸附除磷性能及其机理探讨[D]. 大连:大连理工大学环境学院,2011.
[2] 翟由涛. 吸附法除磷研究进展[J]. 安徽农业科学,2010,38(15):8154-8158.
[3] 王泽红,韩跃新,袁致涛,等. CaSO4晶须制备技术及应用研究[J]. 矿冶,2005,14(2):38-41.
[4] 姚京君. 硫酸钙处理含磷废水特性研究及机理探讨[D]. 南京:南京航空航天大学材料科学与技术学院, 2010.
[5] 刘江,杨红艳,石文建,等. 磷石膏水热法合成硫酸钙晶须[J]. 化工环保,2014,34(2):141-144.
[6] 北京市环保监测中心,上海市环境监测中心. GB 11893—1989 水质 总磷的测定 钼酸铵分光光度法[S]. 北京:中国标准出版社,1989.
[7] 刘焱,吴玲琳,王世和,等. 工业废渣基除磷材料的静态吸附研究[J]. 环境工程学报,2009,3(2):275-278.
[8] 项学敏,周光红,李厚芬,等. 含钙废弃物对废水中磷的去除性能及机理研究[C]//国际管理科学与工程技术协会. 水资源管理与工程国际学术会议论文集.郑州:国际管理科学与工程技术协会, 2011: 1-6.
[9] 北京市环境保护科学研究院,中国环境科学研究院.GB 18918—2002 城镇污水处理厂污染物排放标准[S]. 北京:中国标准出版社,2002.
[10] Azouaou N,Sadaoui Z,Djaafri A,et al. Adsorption of cadmium from aqueous solution onto untreated coffee grounds:Equilibrium,kinetics and thermodynamics[J]. J Hazard Mater,2010,184(1/2/3):126-134.
[11] Hameed B H,Ahmad A A,Aziz N. Isotherms,kinetics and thermodynamics of acid dye adsorption on activated palm ash [J]. Chem Eng J,2007, 133(1/2/3): 195-203.
[12] Namasivayam C,Jeyakumar R,Yamuna R T. Dye removal from wastewater by adsorption on‘waste’ Fe(Ⅲ)/Cr(Ⅲ) hydroxide[J]. Waste Manage,1994,14(7):643-648.
[13] 赵桂瑜. 人工湿地除磷基质筛选及其吸附机理研究[D]. 上海:同济大学环境科学与工程学院,2007.

