可注射型骺板软骨水凝胶的制作及特性研究
鲍 兴,许瑞江,黄靖香,李文超
解放军总医院,北京 100853 1小儿外科;2骨科研究所
儿童骺板损伤导致骨桥形成引起肢体短缩及内翻或外翻畸形是临床常见疾病之一。目前,通过骨桥切除、自体脂肪填塞等方法治疗儿童骺板小于35%的损伤面积获得一定疗效,但对于超过50%的大面积损伤,由于植入物仅起到填塞作用,没有生长能力,疗效欠佳。近年来,骺软骨组织工程为儿童骺板损伤的修复带来了新的希望。近年来组织工程技术的飞速发展极大地促进了骺板修复的实验研究,支架材料的选择与应用是组织工程骺板技术的关键问题。支架材料通常分为天然材料及人工合成材料,而根据空间构型及性状又可将支架材料分为可注射性材料和三维多孔隙支架材料两种。与三维多孔隙支架材料相比较,可注射性材料的优势在于材料与所修复组织之间能够很好地嵌合,保证了种子细胞及生长因子的高度均匀性,其胶体状态亦能提供近似活组织的水合微环境。由于其自身的可注射性,修复组织损伤时可在透视引导下通过微创方式进行,并在原位凝胶化,操作简单且安全、有效,避免了因有创剥离引起的软组织及血供损伤。但通常使用的凝胶类可注射性支架材料,细胞外软骨基质成分有限,不能充分满足骺板软骨特有的生理要求,而且与固态支架相比,缺乏良好的细胞贴附条件[1]。本实验选取藻酸钙(ALG)和骺板软骨细胞外基质(CACECM)以及葡萄糖酸钙复合物作为可注射型水凝胶,将CACECM三维支架的充分贴附性以及藻酸钙凝胶的良好可塑性两大优势相结合,然后与骺板软骨细胞混合后行体外培养,为可注射性组织工程化骺板软骨材料的构建提供一条新的思路。
材料和方法
1 材料 胎牛骺软骨(北京元亨金马生物技术开发有限公司)、4周龄新西兰白兔(解放军总医院骨科研究所提供);培养基DMEM(美国Sigma公司),标准胎牛血清(美国Hyclone公司),Ⅱ型胶原酶(美国Sigma公司),胰蛋白酶(美国Sigma公司),Hochest33258液(美国Sigma公司),磷酸缓冲盐溶液(PBS),三羟基甲基氨基甲烷(Tris北京科昊达生物公司),苯甲基磺酞氟(PMSF美国Sigma公司),DNase(美国Sigma公司),RNase(美国Sigma公司),TritonX-100(德国J.T.BAKER化学试剂公司),藻酸钙(美国Sigma公司,10%葡萄糖酸钙(医用标准),番红O染色试剂(Sigm a公司),AB染色剂(Sigma公司),甲苯胺蓝染色剂(北京索莱宝科技有限公司),HE染色剂(Sigma公司),Ⅱ型胶原鼠抗猪单克隆抗体(美国Neomarkersabcam公司);CO2恒温培养箱(德国Hereus公司),倒置显微镜(日本Olympus公司),超净工作台(北京半导体元件一厂),Zeiss不锈钢滤器(上海医疗器械厂),磁力搅拌器(江苏常州国华仪器公司),Nikon光学显微镜及照相装置(日本Nikon公司),96孔培养板(平底型),紫外分光光度计(Beckman公司),扫描电子显微镜(日本日立公司S4800型),恒低温切片机(德国Reichert-Jang 2800E型),BLX-E254紫外交联仪(VILBFRL000URMAT公司),多功能显微镜(日本Olympus Bx51TR型DP70CCD采集系统),BioTek微量孔板分光光度计(美国伯腾仪器有限公司EPOCH型)。
2 CACECM的制备 用生理盐水将胎牛骺板软骨反复冲洗以除去杂质,在无菌台中将其剪碎成1 mm× 1 mm×1 mm大小,加入含蛋白酶抑制剂苯甲基磺酞氟的Tris-HCL(Ph7.4)缓冲液,在4℃下进行超湿法粉碎。充分稀释后进行差速离心,收集上清,加入1%TritonX-100持续振荡24 h后去除残余细胞成份,用脱氧核糖核酸酶5×104U/L及核糖核酸酶1×103U/L混合液在37℃条件下进行消化以去除核酸。制成2%CACECM,进行电镜观察,组织学检查,DNA定量分析。
3 骺软骨细胞的获取和体外扩增 2周龄实验用新西兰白兔,全麻状态下无菌手术取胫骨近端骺板软骨块,去除周围骨质,置于事先准备好的无菌软骨液中。6 h内采用解放军总医院骨科研究所纱巾组织块培养法进行细胞分离培养[2]。分别取细胞悬液计算细胞产量和细胞成活率后置于75 cm2培养瓶中,37℃、5%CO2培养箱中培养,3 ~ 4 d换液1次,约10 d后第1次传代,比例1∶3,传代后生长迅速,约3 ~ 4 d后第2次传代,比例同样1∶3,再次3 ~ 4 d后细胞长满瓶底,收集后细胞总数达1.0×108个,用于复合凝胶材料。
4 CACECM+ALG复合水凝胶的制备 将制备的2% CACECM与6% ALG及10%葡萄糖酸钙按3∶6∶1比例混匀制备成溶液A;取单独2% CACECM制成溶液B;取单独6% ALG制成溶液C。分别行糖胺聚糖(GAG)含量测定。
5 水凝胶材料与骺板细胞的复合 CACECM、骺软骨细胞、藻酸钙和葡萄糖酸钙复合后置于温箱培养1周,行电镜扫描观察、AB染色、甲苯胺蓝染色、番红O染色、Hochest33258荧光染色及Ⅱ型胶原免疫免疫组化染色。
6 组织相容性及组织学检测 制备出C+CACECM+ ALG复合物的悬液l ml,用1个1 ml注射器配以粗针头抽取悬液,在悬液凝固前注射入实验兔背部真皮下以检测组织相容性,分2点注射,每点0.5 ml。8周后取材,行大体观察、HE染色、甲苯胺蓝染色、番红O染色。
结 果
1 所制备CACECM的大体及组织学观察 差速离心后的骺软骨细胞外基质微丝呈乳白色、粘稠状。电镜下可见大量Ⅱ型胶原微丝(图1),组织学观察番红O、甲苯胺蓝、AB染色均呈强阳性说明基质浆料中含有大量的糖胺聚糖成份,且微丝呈网状分布,形态较规则,未见细胞碎片残留。Ⅱ型胶原免疫组织化学染色阳性说明获得的浆料中含有Ⅱ型胶原成份。
2 骺软骨细胞体外扩增 第二代骺软骨细胞数量级l.0×108个,光镜下观察细胞铺满培养瓶底,此时细胞相互间紧密贴附,单个细胞呈狭长梭形,大多数细胞沿着胞体的长轴呈有序排列,集落中心的细胞密集呈漩涡状排列(图2)。
3 组织工程化骺板软骨组织学检测 CACECM、骺软骨细胞、藻酸钙和葡萄糖酸钙复合物呈乳白色粘稠胶状,易凝固。温箱培养1周后:番红O染色C+CACECM+ALG复合物显示结构层次清楚,基质深层染色最红,呈强阳性(图3);甲苯胺蓝染色C+CACECM+ALG复合物均匀染成蓝色,其中CACECM成分呈现深紫色块状和条索状,提示其中的糖胺聚糖成分;AB染色可见细胞周围的呈深蓝色的酸性黏多糖,基质层淡蓝色;Hochest33258荧光染色可见细胞核圆形或者椭圆,呈均一的蓝染,未见明显固缩、碎裂的强蓝色细胞核,椭圆形的细胞围绕在大量的网状、相对连续的蓝色条状物(CACECM+ALG复合凝胶)周围,结合紧密,复合物活性好,细胞和支架相容性好,细胞可以在水凝胶材料上继续保持较好的活性;Ⅱ型胶原免疫组化染色显示C+CACECM+ALG复合物Ⅱ型胶原免疫荧光表达强阳性,证实组织中软骨细胞具有分泌Ⅱ型胶原的功能(图4)。电镜下观察水凝胶上可见大量骺板细胞生长(图5)。
4 植入皮下8周后组织学检测 HE染色显示骺板细胞呈簇状分布在支架空隙内,支架降解明显,内部残留部分柱状结构,伴有明显纤维组织包裹,无明显炎症细胞浸润(图6)。
5 CACECM+ALG复合凝胶DNA及GAG含量测定DNA浓度为62.38 ng/μl,GAG浓度5.26 μg/ml (复合前CACECM所测GAG浓度为2.39 μg/ml)。
讨 论
目前应用较为广泛的可注射性材料主要有藻酸盐、胶原、Pluronic、纤维蛋白凝胶等,这些材料各自有其优越点和局限性。藻酸盐是从马尾藻等生物体内分离提取的一种天然多聚糖,来源较为丰富,价格低廉,其在支架构建方式上也较简单。藻酸钙水凝胶能很好地维持形状且无毒性,利于种子细胞的黏附[3]。常温状态下,不需添加任何有毒试剂藻酸钙便能形成三维立体多孔结构,其自身的力学及生物学性能也可随着物理及化学因素的变化而改变,这些特点使其能与高分子聚合物、生长因子等其他材料一起构建出新型的复合材料[4]。Masuda等[5]利用藻酸钙凝胶作载体培养软骨细胞,然后收集细胞及细胞外基质,重新培养成不含藻酸钙凝胶的软骨组织,该软骨组织在组织学结构上与正常的软骨组织十分相似。利用藻酸钙凝胶作为载体,应用于骺板软骨的损伤修复亦会受到极大鼓舞。
相关研究认为ECM是个“蛋白信使”丰富的环境,具有良好的生物相容性,并且ECM能通过与软骨细胞的相互作用来调节许多细胞相关的生物学过程,包括细胞的黏附、生长、分化及生存[6-8]。ECM是天然的细胞外基质成份,能够提供骺板软骨生长增殖所需的最原始的微环境。Nehrer等[9]使用多孔胶原—GAG复合物比较了I型胶原和Ⅱ型胶原复合物对狗关节软骨细胞的影响,分别从细胞维持形状、DNA和GAG合成几个方面比较,认为Ⅱ型胶原更适合用作软骨支架。Veilleux[10]等发现种植于Ⅱ型胶原—GAG基质上的软骨细胞,其合成速率较I型胶原高。Ⅱ型胶原是ECM的主要成份,所以以此制备的水凝胶材料具有良好的生物相容性和生物活性,更有利于骺板软骨细胞粘附、生长及增殖。
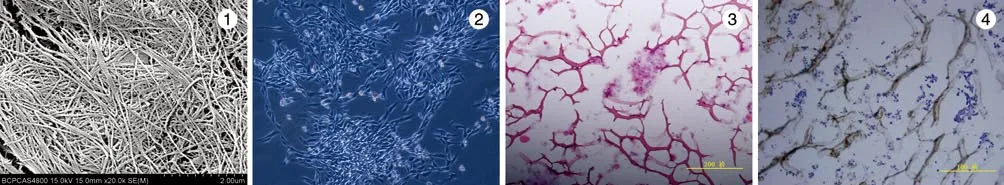
图1 扫描电镜下CACECM+ALG复合支架可见Ⅱ型胶原微丝图 2 原代幼兔骺细胞呈集落性生长图 3 番红O染色显示支架上骺细胞按照柱状结构分布在支架上图 4 Ⅱ型胶原免疫组化染色显示骺细胞和周围支架材料呈强阳性Fig. 1 SEM showing typeⅡcollagen in stents made of CACECM+ALGFig. 2 Primary rabbit plate chondrocytes showing colony growthFig. 3 Safranin O staining showing distribution of plate chondrocytes in stentsFig. 4 Immunohistochemistry staining of typeⅡcollagen showing positive plate chondrocytes and materials around stents

图5 电镜扫描下可见大量骺板细胞生长 A: 低倍电镜扫描下凝胶上可见大量骺板细胞生长; B: 高倍镜下可见细胞生长良好图 6 HE染色显示骺板细胞呈簇状分布在支架上,凝胶内部降解明显Fig. 5 SEM showing growth of plate chondrocytes in hydrogel A:×200; B: ×1500Fig. 6 HE staining showing cluster distribution of plate chondrocytes and obvious degradation of hydrogel
本实验将CACECM与藻酸钙混合制成可注射型水凝胶材料,因为CACECM微粒直径较小及其凝胶状态,复合材料可以顺利通过注射器具,同时辅以10%葡萄糖酸钙,为细胞与CACECM贴附提供环境支持,将CACECM三维支架的充分贴附性、“蛋白信使”丰富的微环境以及藻酸钙的良好可塑性这几大优势相结合,既弥补了藻酸钙作为单一细胞外基质的不足,也避免了骺软骨细胞外基质不能黏合成块及塑形的缺点,极大地提高了组织工程化骺软骨的生物学性能。从本实验中所培养的组织工程化骺软骨组织的定性及定量检测结果上看,实验制备的CACECM中DNA含量较低,说明其抗原性较低,生物相容性良好,电镜下可见复合凝胶上骺板软骨细胞生长情况良好,细胞较均匀地分布于凝胶上,未见明显“空巢”现象。基质中GAG(糖胺聚糖等)和Ⅱ型胶原成分亦较充足,保证了足够的力学强度及充分的细胞外基质环境。这些检测结果表明新生类骺软骨组织已具备一定的成熟度。下一步拟将CACECM、ALG及骺板软骨细胞的复合物回植于受损的动物关节骺软骨受力面,使之置于天然的骺板微环境中。通过关节的压缩与牵拉作用以及关节液的刺激,对组织产生充分的直接和间接作用力,使组织工程化骺板软骨更好地发挥纵向生长能力的作用,从而进一步观察此可注射性复合水凝胶对骨骺损伤的修复效果。
1 Kang EY, Moon HJ, Joo MK, et al. Thermogelling chitosan-g-(PAF-PEG) aqueous solution as an injectable scaffold[J]. Biomacromolecules, 2012, 13(6): 1750-1757.
2 黄靖香,张文涛,周勇刚,等.种子细胞库的建立及应用[J].骨与关节损伤杂志,2003,18(4):217-220.
3 Salgado CL, Sanchez EM, Zavaglia CA, et al. Injectable biodegradable polycaprolactone-sebacic acid gels for bone tissue engineering[J]. Tissue Eng Part A, 2012, 18(1-2): 137-146.
4 位晓娟, 奚廷斐, 顾其胜, 等. 医用海藻酸基生物材料的研究进展[J]. 中国修复重建外科杂志, 2013, 27(8): 1015-1020.
5 Masuda K, Miyazaki T, Pfistcr B. Human tissue engineered cartilage by the alginate-recovered-chondrocyte method after an expansion in monolayer[J]. Trans Orthop Res Sec,2002,27:467.
6 Wei B, Jin C, Xu Y, et al. Effect of bone marrow mesenchymal stem cells-derived extracellular matrix scaffold on chondrogenic differentiation of marrow clot after microfracture of bone marrow stimulation in vitro[J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2013, 27(4): 464-474.
7 Han L, Grodzinsky AJ, Ortiz C. Nanomechanics of the Cartilage Extracellular Matrix[J]. Annu Rev Mater Res, 2011, 41:133-168.
8 Thibault RA, Mikos AG, Kasper FK. Scaffold/Extracellular matrix hybrid constructs for bone-tissue engineering[J]. Adv Healthc Mater, 2013, 2(1):13-24.
9 Nehrer S, Breinan HA, Ramappa A, et al. Canine chondrocytes seeded in type I and type II collagen implants investigated in vitro[J] . J Biomed Mater Res, 1997, 38(2):95-104.
10 Veilleux NH, Yannas IV, Spector M. Effect of passage number and collagen type on the proliferative, biosynthetic, and contractile activity of adult canine articular chondrocytes in type I and II collagen-glycosaminoglycan matrices in vitro[J]. Tissue Eng,2004, 10(1-2):119-127.

