三七主要病原菌对皂苷的敏感性分析
杨 敏, 梅馨月, 郑建芬, 尹兆波, 赵 芝, 张潇丹, 何霞红, 朱书生
(云南农业大学农业生物多样性与病虫害控制教育部重点实验室,昆明 650201)
三七主要病原菌对皂苷的敏感性分析
杨 敏, 梅馨月, 郑建芬, 尹兆波, 赵 芝, 张潇丹, 何霞红, 朱书生*
(云南农业大学农业生物多样性与病虫害控制教育部重点实验室,昆明 650201)
摘要采用菌丝生长速率法测定了三七4种病原菌对三七皂苷粗提物及其含有的4种主要皂苷的敏感性。结果表明,三七皂苷粗提物对病原菌的抑制活性较低,在浓度1 000μg/m L条件下对4种供试病原菌的抑制率均低于20%。在低浓度下对锈腐病菌和恶疫霉菌甚至表现出明显的促生作用。利用HPLC分析表明,三七皂苷粗提物中含有R1、Rb1、Rg1和Rd4种主要皂苷。在浓度为1 000μg/m L条件下,R1、Rb1和Rg1对锈腐病菌均表现明显的促进生长作用;Rg1对恶疫霉D-1菌株表现出微弱的抑制作用,而R1、Rb1、Rd对恶疫霉菌均具有较低的促生长活性;R1和Rb1对腐皮镰刀菌PN-21具有较弱的促生长作用,而Rg1和Rd具有较弱的抑制作用;4种皂苷对侵染三七茎部的人参链格孢菌均具有抑菌活性,抑菌能力Rd>Rb1>R1>Rg1,Rd的抑制率可达23.43%。本试验结果表明,三七一些皂苷可以促进根腐病菌的生长,对根腐病的发生具有促进作用。
关键词三七; 根腐病菌; 人参皂苷; 敏感性
三七[Panax notoginseng(Burk.)F.H.Chen]为五加科人参属多年生草本植物。三七性喜温暖阴湿,其独特的生态环境导致根腐病发生严重。三七根腐病可由多种病原菌侵染所致,其病原菌主要包括柱孢属真菌(Cylindrocarpon destructans、C. didynum)、茄腐镰刀菌(Fusarium solani)及其根生专化型(Fusarium solani f.sp.radicicola)、恶疫霉(Phytophthora cactorum)、茎点霉(Phoma herbarum)、立枯丝核菌(Rhizoctonia solani)、槭刺孢[Mycocentrospora acerina(Hartig)Deighton]、假单胞菌(Pseudomonas spp.)和根结线虫(Meloidogyne spp.)等[1-5]。根腐病的发生已经严重制约了三七的生产。
皂苷是三七主要的次生代谢产物。迄今已从三七的不同部位分离得到三十多种单体皂苷成分。这些单体皂苷大多数为达玛烷型的20(S)-原人参二醇型和20(S)-原人参三醇型[6]。皂苷是植物固有的一类天然抗菌化合物,在植物抵御病原菌的侵染中具有重要作用[7],而且一些皂苷能以根系分泌物的形式释放到根际土壤中[8]。根系分泌物是植物根系产生并向根际分泌的化合物,包括糖、蛋白质、氨基酸及其他次生代谢产物等[9],在植物根与病原菌间的互作中扮演着非常重要的角色[10]。一方面,土壤中病原物通过感应根系分泌的化学信号完成对寄主的识别和定殖[11];另一方面,植物根系分泌出的次生代谢物质可以抵御病原物的侵染,例如,常见作物番茄、豌豆、麦类、玉米和辣椒等根系分泌物中就含有具抑菌活性的酚类、黄酮类及其他化合物[12-13]。皂苷在三七抵御病原菌特别是根腐病菌侵染或在病原菌识别寄主过程中的作用均还未知。本试验以3种三七根腐病菌及黑斑病菌为研究对象,测定这些病原菌对三七皂苷粗提物及主要皂苷的敏感性,为深入研究三七与根腐病菌之间的化感互作提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试植物材料
健康的三年生三七块根,于2012年10月采自云南省文山市砚山县苗乡三七有限公司盘龙镇种植基地。
1.1.2 供试菌株
供试茄腐镰刀菌、恶疫霉菌、锈腐病菌、人参链格孢菌均由云南农业大学农业生物多样性与病害控制实验室分离自三七病样,且经过鉴定的致病菌(表1)。

表1 供试病原菌Table 1 The isolates tested
1.1.3 供试培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖18 g,琼脂16 g,去离子水定容至1 L,用于腐皮镰孢菌、锈腐病菌和人参链格孢菌的培养;胡萝卜培养基(CA):胡萝卜200 g,组织捣碎机捣碎后4层纱布过滤;琼脂粉16 g,去离子水定容至1 L,用于恶疫霉菌的培养。
1.2 试验方法
1.2.1 菌株的培养
将上述供试菌株在培养基上活化3~4次后,取生长较旺盛的菌株备用。
1.2.2 供试病原菌对三七皂苷粗提物的敏感性测定
1.2.2.1 三七粗皂苷的提取
方法参照Nicol等[8]的方法进行并稍作调整。取三年生三七根2 g,40℃烘干48 h后研磨成粉,将三七粉均分成5份,分别置于50 m L离心管中,用10 m L 80%甲醇超声提取40 min(30℃)后离心(12 000 r/min,4℃,5 min),收集上清液,下层粉末再重复提取2次,离心后合并3次上清液,将所有上清液用旋转蒸发仪蒸发至干(40℃),称重,再用一定量甲醇溶解,使三七粗皂苷的浓度为500 mg/m L,0.45μm滤膜过滤除菌,将滤液置于-20℃冰箱中保存备用。
1.2.2.2 三七粗皂苷对病原菌的抑制作用测定
分别将三七粗皂苷用甲醇稀释至105、104、103、102μg/m L的溶液。取母液及上述4个浓度的三七粗皂苷提取液0.8 m L置于无菌三角瓶中,再加入冷却至40℃的灭菌培养基定容至80 m L,充分混匀后配制成5个不同浓度的培养基平板。每一浓度设置4次重复。将供试病原菌在培养基上培养5 d后,用直径为0.5 cm的打孔器沿菌落边缘打取菌饼。将供试菌饼接种于培养基平板中央,以培养基中混入1%甲醇的平板为对照,置于25℃恒温培养箱中培养。
1.2.3 三七粗皂苷中主要皂苷成分HPLC检测
称取三七皂苷R1、人参皂苷Rg1、Rb1、Rd标准品(购于上海同田生物技术有限公司)各0.01 g,加入一定量甲醇溶解配制成每1 m L分别含0.2 mg的标准品溶液,所得标准品溶液用0.45μm滤膜过滤。三七块根提取液按照1.2.2.1的方法提取,提取液过滤后检测。检测条件如下:色谱柱(Kinetex 2.6μm C18 100A 50 mmⅹ4.6 mm美国Phenomennex);流动相由乙腈(A)和0.05%H3PO4水(B)组成,0~21 min用22%A和78%B洗脱,21~31 min用33%A和67%B洗脱,22~42 min用22%A和78%B洗脱;流速:1.0 m L/min;波长:203 nm;柱温:室温;进样体积:10μL[14]。
1.2.4 三七中主要皂苷的抑菌活性测定
称取人参皂苷Rg1、Rb1、Rd和三七皂苷R1各0.1 g,加入1.0 mL甲醇配制成100 mg/m L的母液;其次,用移液枪移取上述皂苷单体各0.8 mL置于无菌三角瓶中,再加入冷却至40℃的灭菌培养基定容至80 mL充分混匀后配制成浓度为1 000μg/mL的培养基平板。将恶疫霉菌D-1、茄腐镰刀菌PN-21、锈腐病菌CD-MS-7和人参链格孢菌A1在培养基上培养5 d后,用直径为0.5 cm的打孔器沿菌落边缘打取菌饼。将供试菌饼接种于培养基平板中央,以培养基中混入1%甲醇的平板为对照,置于25℃恒温培养箱中培养,每一处理设置4次重复。
1.2.5 数据统计
培养5 d后,待空白对照菌落长到培养皿的2/3左右,用“十字交叉法”测量出每一处理下的菌落生长直径,求出各平均值带入公式计算。

2 结果与分析
2.1 供试病原菌对三七粗皂苷提取液的敏感性
2.1.1 茄腐镰刀菌对三七粗皂苷的敏感性
供试的8株茄腐镰刀菌菌株对三七粗皂苷的敏感性存在差异(图1)。但在浓度1、10和100μg/m L条件下,提取液对多数菌株的抑制率均低于10%,随提取液浓度升高,抑制作用增强。当浓度为5 000μg/m L时,抑制效果多在20%~30%之间,个别菌株也仅能达到35%左右。
2.1.2 锈腐病菌对三七粗皂苷的敏感性
粗皂苷提取液在浓度1和10μg/mL时对供试的3株锈腐病菌均表现出促进生长作用,浓度100μg/ mL时对CD-MS-8和CD-MS-9菌株也表现促生长作用,而对CD-MS-7表现出微弱的抑制作用;只有当供试浓度达到1 000μg/m L或以上时,对3株供试菌株仅表现较弱的抑制作用,即使在供浓度5 000μg/m L时,抑制率也仅在25%左右(图2)。
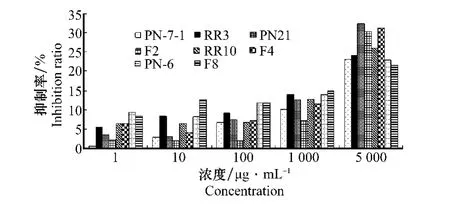
图1 茄腐镰刀菌对三七粗皂苷的敏感性Fig.1 The sensitivity of Fusarium solani isolates to the crude saponin extracts of P.notoginseng
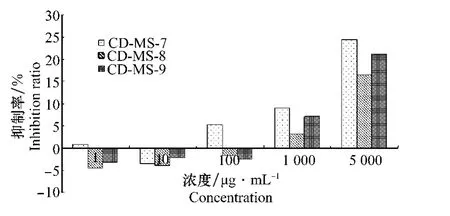
图2 锈腐病菌对三七粗皂苷的敏感性Fig.2 The sensitivity of Cylindrocarpon destructans isolates to the crude saponin extracts of P.notoginseng
2.1.3 恶疫霉菌对三七粗皂苷的敏感性
由图3可以看出,三七粗皂苷提取液在浓度1μg/m L和10μg/m L条件下抑制率较低,甚至促进部分菌株的生长。当供试浓度达到100μg/m L时,对除菌株D-12之外的所有菌株均表现出微弱的抑制作用;当浓度升高到1 000μg/m L时,抑制作用增强到20%~30%,在供试最高浓度5000μg/m L时,敏感菌株的最高抑制率达50%~60%。
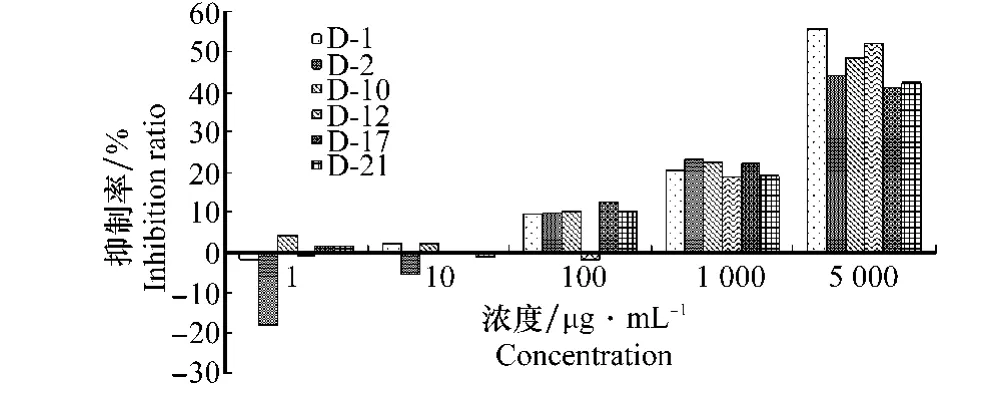
图3 恶疫霉菌对三七粗皂苷的敏感性Fig.3 The sensitivity of Phytophthora cactorum isolates to the crude saponin extracts of P.notoginseng
2.1.4 人参链格孢菌对三七粗皂苷的敏感性
由图4可以看出,三七粗皂苷提取液在低浓度下(1、10μg/m L)抑制率较低,甚至促进某些菌株的生长,当供试浓度达到100μg/m L时,对除菌株A5之外的所有菌株均表现出抑制作用;当浓度升高到1 000μg/m L时,抑制作用增强到10%~30%,在供试最高浓度5 000μg/m L时,敏感菌株的最高抑制率可达30%~40%。
2.2 三七病原菌对三七中主要皂苷的敏感性
2.2.1 三七块根提取液中皂苷成分检测结果
利用HPLC结合标准品的方法分析了三七块根提取液中含有的主要皂苷成分(图5),结果表明,从三七块根提取液中可检测出4种主要的皂苷成分,即R1、Rg1、Rb1和Rd。
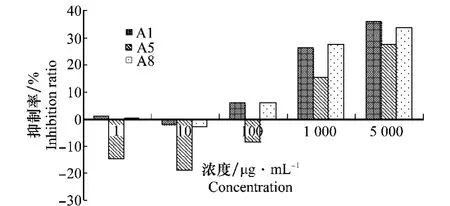
图4 人参链格孢菌对三七粗皂苷提取液的敏感性Fig.4 The sensitivity of Alternaria panax isolates to the crude saponin extracts of P.notoginseng
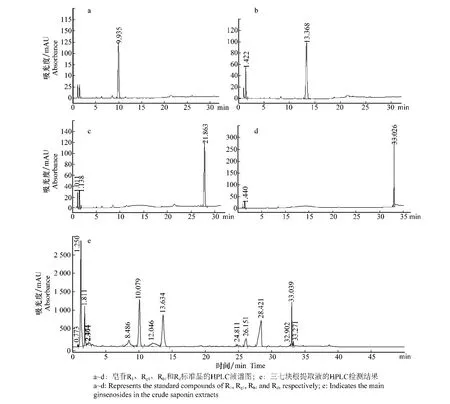
图5 三七块根提取液中主要皂苷的HPLC检测Fig.5 The main ginsenosides in the crude saponin extracts of P.notoginseng detected by the method of HPLC
2.2.2 供试病原菌对三七主要皂苷的敏感性
试验结果表明(表2),R1、Rb1和Rg1在供试浓度1 000μg/m L条件下,均可明显促进锈腐病菌CDMS-7菌株菌丝生长,Rd对CD-MS-7无显著影响。Rg1对恶疫霉D-1菌株表现出微弱的抑制作用,而R1、Rb1、Rd对恶疫霉菌均具有较低的促生长活性。R1和Rb1对腐皮镰刀菌PN-21具有较弱的促生长作用,而Rg1和Rd具有较弱的抑制作用。供试4种皂苷对人参链格孢菌均具有抑菌活性,抑菌能力Rd>Rb1>R1>Rg1。

表2 4种皂苷单体在浓度1 000μg/m L条件下对三七主要病原菌的抑菌活性1)Table 2 Antifungal activity of four ginsenosides to the pathogens of P.notogensing at the concentration of 1 000μg/mL
3 结论与讨论
本试验的结果表明,不同病原菌对三七粗皂苷的敏感性具有差异。皂苷粗提液在低浓度下对供试的4种病原菌均具有较明显的促生作用,只有当浓度上升到1 000μg/m L或以上时,才对供试病原菌表现一定的抑菌活性,但抑菌活性菌株之间存在差异,其原因可能与不同菌株之间对三七的致病性差异有关。孙玉琴等的研究也表明三七水培液、三七鲜根水提液、三七总皂苷对毁坏柱孢菌和腐皮镰刀菌的生长均有促进作用[15]。Nicol等对与三七同科的西洋参研究也显示,西洋参皂苷粗提物对非病原菌木霉菌(Trichoderma spp.)和叶部病原菌人参链格孢菌(A.panax)具有明显的抑菌活性,而对根部病原菌C.destructans、P.cactorum和Py.irregulare具有促进生长的作用[16]。供试病原菌对三七粗皂苷提取液中的几种主要皂苷成分的敏感性也有差异。在1 000μg/m L条件下,R1、Rb1、Rg1和Rd对锈腐病菌均表现明显的促进生长作用;Rg1和Rd对镰刀菌和恶疫霉菌具有较弱的抑制作用。但4种皂苷对三七茎部病原菌人参链格孢菌具有一定的抑制作用,Rd还表现出较强的抑菌活性。比较三七粗皂苷和4个皂苷单体对三七病原菌的抑菌活性差异结果表明,在浓度1 000μg/m L条件下,三七粗皂苷对供试病原菌的抑制效果明显强于4个皂苷单体。这可能与不同皂苷之间存在协同增效作用或者在所提取的三七粗皂苷中还含有其他具有抑菌活性的次生代谢产物,如槲皮素等黄酮类物质[6]有关,但还有待试验进一步证实。
皂苷是五加科植物主要的次生代谢产物。有研究表明,人参皂苷可能还是西洋参受到病原真菌侵染后产生的一类重要防御物质。西洋参植株体内的人参皂苷Rb1含量在接种茄腐镰刀菌和尖孢镰刀菌后迅速上升,且Rb1在40mg/mL浓度条件下对茄腐镰刀菌和尖孢镰刀菌的孢子萌发抑制率分别为25%和42%[17]。但本研究中供试皂苷Rb1在浓度1 000μg/m L对茄腐镰刀菌不但没有抑菌活性,反而能促进病原菌的生长,这可能与试验所使用的浓度有关,也可能与不同菌株之间的致病性差异有关。供试的4种皂苷中除了Rg1对恶疫霉及Rg1和Rd对茄腐镰刀菌菌株表现出微弱的抑制作用外,其他皂苷对3种根部病原菌均表现出促进生长作用。这种促生作用可能与病原菌对这些物质的解毒代谢有关。皂苷酶是病原菌产生的能水解植物皂苷的葡萄糖苷酶,通常能解毒或降解皂苷。很多病原菌产生皂苷酶,其中一些酶具有寄主特异性。例如,麦类全蚀病菌(G.graminis var.avenae)能产生一种胞外燕麦皂苷酶,这种酶能将燕麦产生的植保素avenacin A-1降解[17-19]。将产生这种酶的基因突变后菌株就不能侵染含有皂苷的寄主[7]。从西洋参病株上分离的畸雌腐霉菌也能产生皂苷酶降解20(S)-原人参二醇型皂苷,而从豆科植物上分离的畸雌腐霉菌降解能力却很弱[20]。供试部分皂苷对三七根部病原菌不但无抑制活性,反而能促进其生长。这表明三七根腐病菌在与三七长期协同进化过程中不仅形成了对皂苷的解毒机制,而且还可能形成了利用皂苷的特殊机制。
综上所述,土壤是一个复杂的集合体,根腐病的发生可能源于不同因素如自毒物质、微生物等的相互作用,最终导致植物生长受阻。三七分泌到根际的一些皂苷对根腐病菌的生长具有促进作用,这会导致三七植株选择性地吸引根腐病菌在根际定殖和扩繁,这可能是导致三七根腐病发生严重的重要原因。另外,三七连作障碍的形成也可能是由于土壤中存在的皂苷类物质能提供根腐病菌生存的营养,导致根腐病菌在土壤中长期存活。但这些推测均需进一步试验验证。
参考文献
[1] 骆平西,许毅涛.三七根腐病病原鉴定及药剂防治研究[J].西南农业学报,1991,4(2):77-80.
[2] 陈昱君,王勇,伍忠翠.种苗质量与三七根腐病关系[J].中药材,2002,25(5):307-308.
[3] 罗文富,喻盛甫,黄琼,等.三七根腐病复合侵染中病原细菌的研究[J].云南农业大学学报,1998(1):124-126.
[4] 李忠义,喻盛甫.三七根腐病防治研究[J].中药材,1998,21(4):163-166.
[5] 缪作清,李世东,刘杏忠,等.三七根腐病病原研究[J].中国农业科学,2006,39(7):1371-1378.
[6] 崔秀明,陈中坚.三七药材的道地性研究[M].昆明:云南科技出版社,2007:5-7.
[7] Bowyer P,Clarke B R,Lunness P,et al.Host range of a plant pathogenic fungus determined by a saponin detoxifying enzyme[J].Science,1995,267:371-374.
[8] Nicol R W,Traquair J A,Bernards M A.Ginsenosides as host resistance factors in American ginseng(Panax quinquefolius)[J].Canadian Journal of Botany,2002,80:557-562.
[9] Bais H P,Loyola-Vargas V M,Flores H E,et al.Root-specific metabolism:the biology and biochemistry of underground organs[J].In Vitro Cellular&Developmental Biology-Plant,2001,37:730-741.
[10]Walker T S,Bais H P,Grotewold E,et al.Root exudation and rhizosphere biology[J].Plant Physiology,2003,132(1):44-51.
[11]Bais H P,Park S W,Weir T L,et al.How plants communicate using the underground information superhighway[J].Trends in Plant Science,2004,9:26-32.
[12]Bais H P,Weir T L,Perry L G,et al.The role of root exudates in rhizosphere interactions with plants and other organisms[J].Annual Review of Plant Biology,2006,57:233-266.
[13]Bednarek P,Osbourn A.Plant-microbe interactions:Chemical diversity in plant defense[J].Science,2009,324:746-748.
[14]Court W A,Hendel J G,Elmi J.Reversed-phase high-performance liquid chromatographic determination of ginsenosides of Panax quinquefolium[J].Journal of Chromatography,1996,755:11-17.
[15]孙玉琴,陈中坚,李国才,等.化感物对三七病原菌生长影响的初步研究[J].现代中药研究与实践,2008,22(6):19-21.
[16]Nicol R W,Yousef L,Traquair J A,et al.Ginsenosides stimulate the growth of soilborne pathogens of American ginseng[J].Phytochemistry,2003,64(1):257-264.
[17]Jiao X L,Bi W,Li M,et al.Dynamic response of ginsenosides in American ginseng to root fungal pathogens[J].Plant Soil,2011,339:317-327.
[18]Crombie W M L,Crombie L,Green J B,et al.Pathogenicity of the take-all fungus to oats:its relationship to the concentration and detoxification of the four avenacins[J].Phytochemistry,1986,25:2075-2083.
[19]Osbourn A E,Clarke B R,Dow J M,et al.Partial characterization of avenacinase from Gaeumannomyces graminis var.avenae[J].Physiological and Molecular Plant Pathology,1991,38:301-312.
[20]Yousef L F,Bernards M A.In vitro metabolism of ginsenosides by the ginseng root pathogen Pythium irregulare[J].Phytochemistry,2006,67(16):1740-1749.
中图分类号:S 435.672
文献标识码:A
DOI:10.3969/j.issn.0529-1542.2014.03.014
收稿日期:2013-08-07
修订日期:2013-11-19
基金项目:云南省发展与改革委员会专项(高技20112513);国家自然科学基金(31260447)
*通信作者E-mail:shushengzhu79@126.com
Sensitivity of the pathogens of Panax notoginseng to ginsenosides
Yang Min, Mei Xinyue, Zheng Jianfen, Yin Zhaobo, Zhao Zhi, Zhang Xiaodan, He Xiahong, Zhu Shusheng
(Key Laboratory of Agricultural Biodiversity for Plant Disease Management,Ministry of Education,Yunnan Agricultural University,Kunming 650201,China)
AbstractThe sensitivity of the main pathogens of Panax notoginseng to the crude saponin extract from cultivated P.notoginseng and four ginsenosides was evaluated using the mycelial growth method.The results indicated that the pathogen exhibited a low sensitivity to crude saponin extract.The inhibition ratios of mycelial growth by all pathogens tested were all lower than 20%at the concentration of 1 000μg/m L.The mycelial growth of Phytophthora cactorum and Cylindrocarpon destructans was stimulated when the concentration of crude saponin extract was lower than 100μg/m L.The ginsenosides,including R1,Rb1,Rg1and Rd,were identified via HPLC in the crude saponin extract.The mycelial growth of C.destructans was strongly stimulated by these four ginsenosides at the concentration of 1 000μg/m L.The mycelial growth of P.cactorum was slightly inhibited by Rg1,but slightly promoted by R1,Rb1and Rd.The mycelial growth of Fusarium solani was slightly inhibited by Rg1and Rd,but slightly promoted by R1and Rb1.In contrast,growth of the leaf pathogen Alternaria panax was inhibited by these four ginsenosides(Rd>Rb1>R1>Rg1).The inhibition ratio of Rdeven reached to 23.43%.These results imply that ginsenosides can act as allelopathic stimulators for the growth of soilborne pathogens in the rhizosphere,and this may contribute to the occurrence of root rot of P.notoginseng.
Key wordsPanax notoginseng; root rot; ginsenosides; sensitivity

