甘蔗和玉米不同生育时期叶片挥发物组成及其对亚洲玉米螟的电生理活性
蒋兴川, 谢兴伟, 董文霞, 肖 春,陈 斌, 严乃胜, 李 祥, 李正跃
(云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201)
研究报告
Research Reports
甘蔗和玉米不同生育时期叶片挥发物组成及其对亚洲玉米螟的电生理活性
蒋兴川#, 谢兴伟#, 董文霞, 肖 春,陈 斌, 严乃胜, 李 祥, 李正跃*
(云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201)
为了研究甘蔗和玉米不同生育时期叶片挥发物成分的差异及挥发物对亚洲玉米螟的电生理活性,采用溶剂漂洗法和气相色谱—质谱联用仪(GC-MS)提取、分析了甘蔗(Saccharum of ficinarum)苗期、甘蔗茎伸长期、玉米(Zea mays)苗期、吐丝期叶片挥发物,并通过触角电位技术测定了亚洲玉米螟对其中24种挥发物的电生理反应。结果表明:甘蔗苗期、玉米苗期分别分离出45种、38种化合物,而甘蔗茎伸长期和玉米吐丝期分别鉴定出44种、42种化合物。甘蔗和玉米不同生育时期挥发物成分存在差异,其中在甘蔗和玉米不同生育时期叶片中均存在的化合物有25种,玉米特有化合物有4种,甘蔗特有化合物有12种。甘蔗和玉米不同生育时期挥发物种类主要包括萜类、绿叶气味、醛类、酮类、酸类、醇类、酯类、酰胺类和烃类,且这些化合物的含量在甘蔗和玉米不同生育时期之间存在着差异,但均以烃类化合物的含量最高。亚洲玉米螟交配雌蛾对检测的24种挥发物均可产生EAG反应,表现出绿叶气味>萜类和醛类化合物>酸类和烃类化合物的总体反应趋势,其中以顺-3-己烯基乙酸酯的反应相对值最大(145.91±5.43);交配雌蛾的反应相对值在同一类化合物(绿叶气味除外)间差异不显著,说明亚洲玉米螟对同一类化合物的嗅觉辨识能力较差。本研究结果为进一步探明植物挥发物对亚洲玉米螟的行为影响奠定了基础。
甘蔗; 玉米; 生育时期; 植物挥发物; 亚洲玉米螟; 触角电位反应
亚洲玉米螟(Ostrinia furnacalis Guenée),属鳞翅目螟蛾科,是我国玉米螟的优势种[1]。其大发生年可使玉米减产30%以上,造成巨大损失[1];同时其食性杂,寄主范围广,还可为害棉花、甘蔗、水稻、小麦等69种作物[2]。常规的化学防治方法不仅增加投入,而且污染环境,因此,寻找可持续防治的新途径至关重要[3]。
农作物合理间套作不但可以提高作物产量,而且可以有效控制害虫种群,从而减轻作物的受害程度[4-5]。近年来,广西、云南、海南等省逐渐开展甘蔗(Saccharum of ficinarum Linn.)、玉米(Zea mays Linn.)间作套种示范试验,并已获得成功[6],显著提高了经济效益[7]。已有研究表明:间套作植物释放的挥发物通过干扰害虫的定向、交配、产卵等行为,影响昆虫在作物上定居和繁殖,进而影响其对作物的为害程度[8]。有关玉米挥发物组分的研究国内外学者已有报道[9-10];而对该间作套种模式下甘蔗不同生育时期叶片挥发物组成及其与玉米挥发物的差异未见报道,同时有关亚洲玉米螟对植物挥发物的触角电位反应的报道也较少。
本研究拟通过溶剂漂洗法分离甘蔗和玉米叶片挥发物,再利用气相色谱—质谱联用(GC-MS)技术进行鉴定分析,并通过触角电位(electroantennogram,EAG)技术测定成虫对挥发物成分的触角电位反应,明确对成虫起重要电生理作用的挥发物,以期为进一步研究这些物质对亚洲玉米螟行为的影响奠定基础,为利用化学生态防治亚洲玉米螟提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试植物
甘蔗(‘新台糖22号’)和玉米(‘会单4号’)均为云南常用的种植品种,采用包家爱等[11]的种植方法,并稍作改进:甘蔗在光照培养箱中催芽10 d后,选取长势一致的甘蔗芽隔行种植于温室内,行距1 m,株距25 cm,种植后覆盖地膜;30 d后在光照培养箱中催芽玉米,并于5 d后选取长势一致的玉米芽隔行与甘蔗间作,行距1 m,株距25 cm,种植后覆盖地膜。试验期间不喷洒任何农药,植物长势良好。
1.1.2 供试虫源
亚洲玉米螟采自云南农业大学后山农场玉米试验田,室内采用宋彦英等[12]的半人工饲料在温度(26±1)℃、相对湿度(70±10)%、光周期L∥D=14 h∥10 h的人工气候箱内连续饲养多代,成虫饲以10%蜂蜜水。触角电位试验选取羽化正常、健康、能正常飞行的已交配2~3日龄雌蛾。
1.2 方法
1.2.1 甘蔗、玉米不同生育时期叶片挥发物的收集
大量研究表明单种时甘蔗苗期、茎伸长期和玉米苗期、吐丝期的虫害发生较严重[13-16],故选择甘蔗、玉米上述生育期叶片进行试验。试验过程中,甘蔗和玉米苗期的叶片在同一天进行漂洗,甘蔗茎伸长期和玉米吐丝期的叶片漂洗也在同一天完成。溶剂漂洗法参照Udayagiri和Mason的方法[17],并稍作改进:试验时剪取、称量100 g健康叶片带回实验室,在3个存有50 mL二氯甲烷(色谱纯,99.99%)的烧杯中依次漂洗叶片5~10 s,然后将漂洗液用滤纸过滤2遍,再加入辛烷和壬酸乙酯各300 ng作为内标,用氮吹法浓缩至100μL后,在气相色谱-质谱联用仪中进行分析检测。试验过程中取等量的二氯甲烷放在烧杯中作对照,等待测叶片漂洗结束后,将对照二氯甲烷采用相同方法过滤、浓缩、检测。上述所有试验操作均在存有冰块的冰盒中进行,处理和对照各设4次重复。
1.2.2 甘蔗、玉米不同生育时期叶片挥发物的分离和鉴定
采用气相色谱-质谱联用仪对漂洗液进行分析。气相色谱-质谱联用仪条件:色谱柱为HP-5毛细管柱(30 m×0.25 mm×0.25μm),起始温度40℃,3℃/min升温至80℃,再以5℃/min升温至260℃,保持10 min;柱前压100 kPa,载气为高纯氮气,流速1 m L/min,分流进样,分流比是10∶1,进样量2μL;EI离子源,电子能量70eV,质子扫描范围35~500 amu,四级杆温度150℃,离子源温度230℃,接口温度250℃,柱压100 kPa。通过核对标准谱库(Wiley7n.l)与标准化合物的质谱图,根据标准化合物的保留时间对挥发物组分进行定性,通过内标法对各组分进行定量。
1.2.3 亚洲玉米螟成虫对植物挥发物的触角电位反应
选取甘蔗、玉米大多数生育期均存在的挥发物的标准化合物(见表2),配成5×10-3g/mL的石蜡油溶液。触角电位反应参照张颖等的方法[3],并稍作改进:将亚洲玉米螟雌成虫的触角由基部剪下,去除端部2个鞭节后与触角电位仪连接;取20μL待测样品溶液,均匀涂在滤纸条(6.0 cm×0.5 cm)上,立即将滤纸条放入巴斯德管内,然后将巴斯德管连接在刺激气流上。测量时,刺激气流的流量为1 150 mL/min,连续气流的流量为850 m L/min;待基线稳定后给予刺激,用脚踏板人为控制刺激,保持每次刺激时间为0.2 s,连续2次刺激的时间间隔为30 s以上。同一根触角中待测样品的顺序为石蜡(1次)、反-2-己烯-1-醛(3次)、待测化合物(3次)、石蜡(1次),其中石蜡为对照,反-2-己烯-1-醛为参照化合物,反-2-己烯-1-醛和待测化合物的浓度相同且每测1根触角后互换检测顺序。每头成虫取用1根触角,每个样品重复15根触角。得到的EAG信号经放大器(Syntech CS-55)放大,展示于示波器上,并通过Syntech公司提供的软件对各样品的EAG反应值进行标准化校正,EAG反应相对值=(样品的反应值-对照的反应值)/(参照物的反应值-对照的反应值)×100%[18]。
1.3 数据处理
试验数据采用Excel和SPSS 17.0软件进行分析,利用Duncan氏新复极差法进行显著性检验。
2 结果与分析
2.1 甘蔗、玉米在不同生育时期叶片挥发物组成
甘蔗和玉米叶片共分离出62种化合物,其中甘蔗苗期、玉米苗期分别分离出45种、38种化合物;而甘蔗茎伸长期、玉米吐丝期分别鉴定出44种、42种化合物(图1,表1)。在甘蔗和玉米不同生育时期叶片中均存在的化合物有25种,而甘蔗特有化合物包括十二醛、十四烷酸异丙酯、1-十八碳烯、1-十九碳烯、十八烷酸甲酯、十八碳二烯酸乙酯、十八酰胺和2-二十五烷酮等12种物质,玉米特有化合物为异长叶烯、9-十八碳烯酸、对甲氧基桂酸-2-乙基己酯及4,8,12,16-四甲基十七烷基-4-内酯(图1,表1)。
2.2 甘蔗、玉米不同生育时期叶片的各类挥发物总量
甘蔗、玉米不同生育时期叶片释放的挥发物种类和各组分含量存在差异(表1)。甘蔗和玉米不同生育时期挥发物种类主要包括绿叶气味、萜类和脂肪族化合物;其中脂肪族化合物含量丰富,又包括醛类、酮类、酸类、醇类、酯类、酰胺类和烃类,且以烃类化合物的含量最高,所占比例均大于50%,显著高于其他种类化合物。其中苗期玉米叶片中烷烃类化合物含量最高,达(13 141.69±549.62)ng(表1)。
随着甘蔗的生长,萜类、脂肪族化合物酮类、酸类的含量逐渐增加,绿叶气味、脂肪族化合物醛类、醇类、酯类的含量逐渐降低,且这些物质在甘蔗苗期和茎伸长期间差异显著(P<0.05);而脂肪族化合物酰胺类、烃类含量在甘蔗不同生育期间差异不显著(表1)。而随着玉米的生长,萜类、脂肪族化合物酮类、酸类、酯类、酰胺类的含量逐渐增加,绿叶气味、脂肪族化合物醛类、烃类的含量逐渐降低,且这些物质的含量在玉米苗期和吐丝期间存在显著差异(P<0.05);脂肪族化合物中的醇类化合物含量在玉米不同生育期间差异不显著。除部分采样时间的绿叶气味、萜类、脂肪族化合物醛类、酰胺类、烃类外,相同采样时间下甘蔗、玉米叶片中同一类化合物的总量间均存在显著差异(P<0.05)。
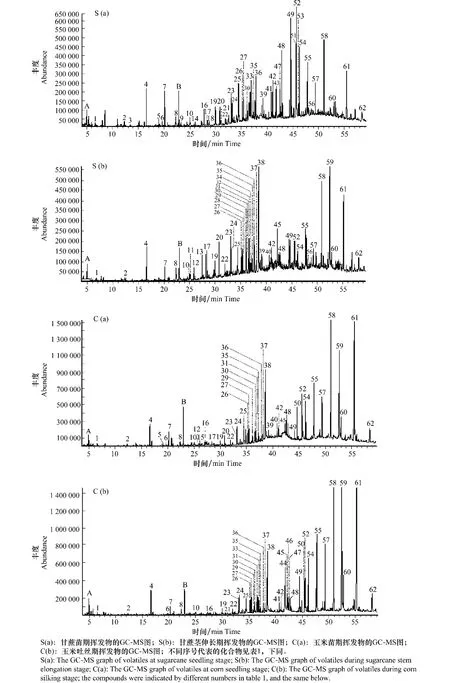
图1 甘蔗、玉米不同生育时期叶片挥发物的GC-MS图Fig.1 The GC-MSgraphs of volatiles emitted from leaves of sugarcane and corn during different growth stages
2.3 甘蔗、玉米不同生育时期叶片中挥发物各组分含量
2.3.1 甘蔗、玉米不同生育时期叶片中绿叶气味、萜类化合物各组分含量
绿叶气味包括顺-3-己烯-1-醇、顺-3-己烯基乙酸酯,其中顺-3-己烯-1-醇的含量均低于10.00 ng,且其含量在甘蔗、玉米不同生育期叶片间差异不显著;随着植物的生长,甘蔗、玉米中顺-3-己烯基乙酸酯的含量均下降,且其含量在同一种植物不同生育期间差异显著(P<0.05),而在同一采样时间下两种植物间差异不显著(表1)。
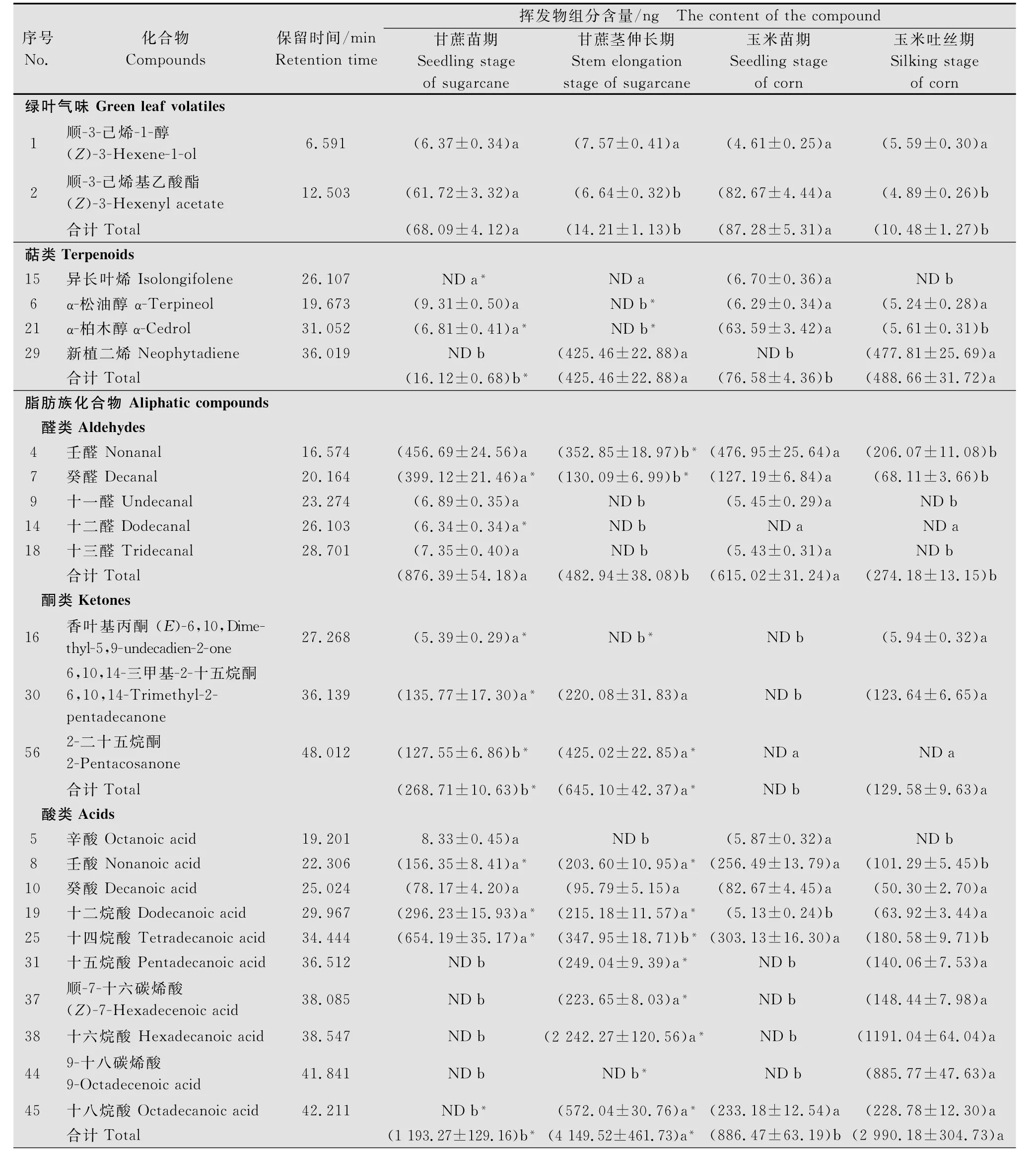
表1 甘蔗、玉米不同生育时期叶片释放的挥发物各组分含量1)Table 1 Component quantities of different compounds from leaves of sugarcane and corn in different growth stages

续表1 Table 1(Continued)
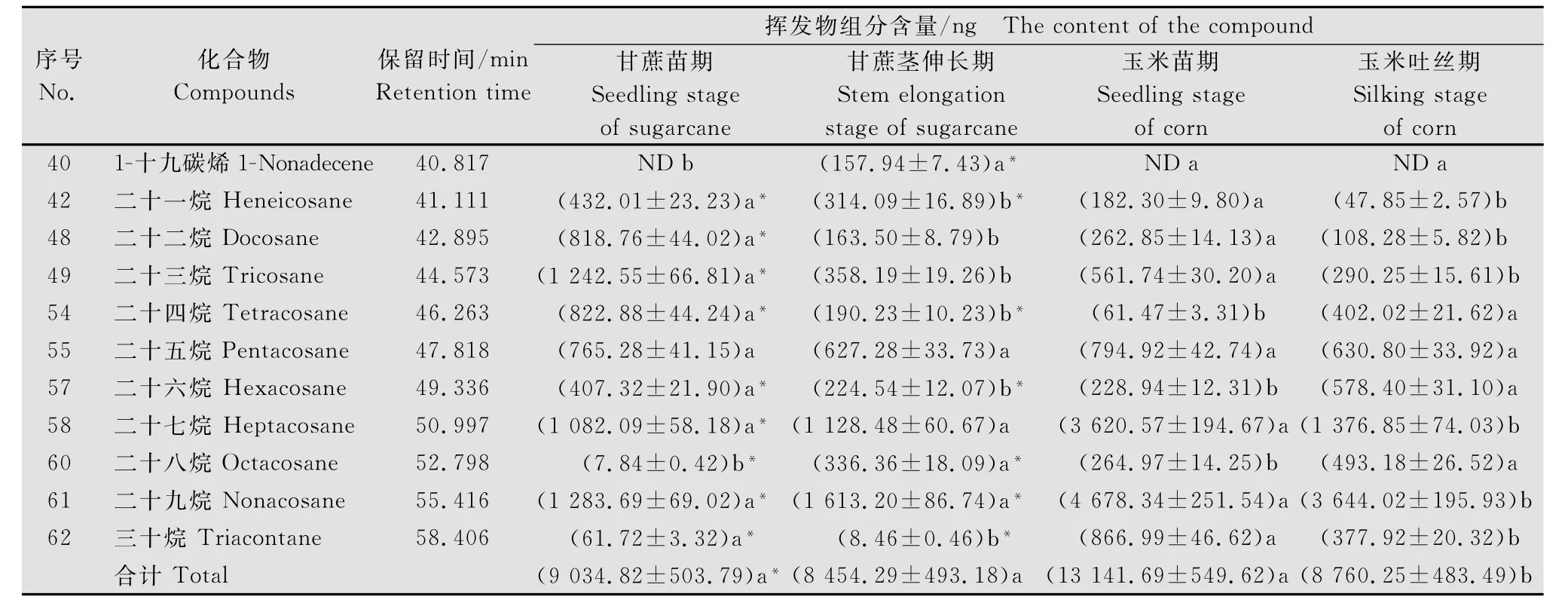
续表1 Table 1(Continued)
萜类化合物含有异长叶烯、α-松油醇、α-柏木醇和新植二烯这4种物质,其中异长叶烯仅在玉米苗期叶片中存在,其含量为(6.70±0.36)ng;新植二烯在甘蔗茎伸长期和玉米吐丝期中均存在,但两者差异不显著(表1)。
2.3.2 甘蔗、玉米不同生育时期叶片中醛类、酮类化合物各组分含量
醛类化合物包括壬醛、癸醛、十一醛、十二醛、十三醛这5种化合物,其中十一醛、十二醛、十三醛的含量均低于10.00 ng,且仅在苗期叶片中出现;在同一种植物中壬醛、癸醛的含量均随着植物的生长而减少,如甘蔗茎伸长期叶片中癸醛的含量为(130.09 ±6.99)ng,是苗期的32.60%(表1)。在同一采样时间下,甘蔗叶片中癸醛的含量均高于其在玉米叶片中的含量,且癸醛的含量在两种植物间存在显著差异(P<0.05)。
酮类化合物含有香叶基丙酮、6,10,14-三甲基-2-十五烷酮、2-二十五烷酮,其中2-二十五烷酮仅在甘蔗中出现,且其在甘蔗茎伸长期的含量显著高于在苗期的含量(P<0.05)。除6,10,14-三甲基-2-十五烷酮的含量在甘蔗茎伸长期和玉米吐丝期间差异不显著外,同一采样时间下其余物质的含量在两种植物间差异显著(P<0.05,表1)。
2.3.3 甘蔗、玉米不同生育时期叶片中酸类、醇类化合物各组分含量
酸类化合物包括10种物质,且各物质含量在甘蔗、玉米不同生育期存在着差异(表1)。壬酸、癸酸、十二烷酸、十四烷酸这4种物质在甘蔗和玉米不同生育期中均存在;其中,除癸酸外,同一采样时间下其余物质的含量在两种植物间差异显著(P<0.05,表1)。辛酸仅在甘蔗、玉米苗期出现,且含量较低;而9-十八碳烯酸仅在玉米吐丝期出现(表1)。十五烷酸、顺-7-十六碳烯酸、十六烷酸仅在甘蔗茎伸长期和玉米吐丝期出现,且在甘蔗茎伸长期的含量均显著高于其在玉米吐丝期的含量(P<0.05);其中十六烷酸在两种植物中的含量均显著高于酸类的其他物质,如其在甘蔗叶片中含量达(2 242.27± 120.56)ng(表1)。
醇类化合物包括2-乙基己醇、1-十六烷醇和十八烷醇,但这3种物质在甘蔗茎伸长期均未被检测出;且同一采样时间下1-十六烷醇、十八烷醇的含量在两种植物间差异显著(P<0.05,表1);其中1-十六烷醇的含量均较高,其占醇类物质的比例均高于50.00%。
2.3.4 甘蔗、玉米不同生育时期叶片中酯类、酰胺类化合物各组分含量
在6种酯类物质中,十六烷酸甲酯在甘蔗、玉米不同生育期均存在,且含量均高于100.00 ng;4,8,12,16-四甲基十七烷基-4-内酯仅在玉米苗期和吐丝期存在,且其含量在玉米两个生育期间存在显著差异(P<0.05,表1)。另外4种物质仅在一种植物的特定生育期出现。
酰胺类化合物含有十六酰胺、顺-9-十八碳烯酰胺、十八酰胺、顺-13-二十二碳烯酰胺这4种物质;其中顺-9-十八碳烯酰胺在甘蔗、玉米不同生育期均存在,其在甘蔗苗期的含量显著高于其在玉米苗期的含量(P<0.05)。顺-13-二十二碳烯酰胺仅存在于甘蔗茎伸长期和玉米吐丝期,且其含量依次为(2 283.25±122.76)ng、(2 480.92±133.39)ng。
2.3.5 甘蔗、玉米不同生育时期叶片中烃类化合物各组分含量
在甘蔗、玉米不同生育期叶片中,烃类化合物的种类最多,达25种;其中十四烷、环十四烷、1-十八碳烯等6种物质仅在甘蔗茎伸长期出现,而十五烷、十六烷、二十烷这3种物质存在于除玉米吐丝期外的其他3个生育期(表1)。在甘蔗、玉米不同生育期均存在的15种化合物中,二十七烷和二十九烷相对较高,其含量均高于1 000.00 ng(表1);其中二十九烷在烃类物质中的含量最高,且在同一采样时间下,其在玉米叶片中的含量显著高于在甘蔗叶片中的含量(P<0.05);如二十九烷在玉米苗期叶片中的含量为(4 678.34±251.54)ng,是其在甘蔗苗期的3.64倍。
2.4 亚洲玉米螟交配雌蛾对不同化合物的EAG反应
亚洲玉米螟交配雌蛾对包括参照物反-2-己烯-1-醛在内的25种化合物均能产生EAG反应,其反应值为0.1~0.7 m V,且均显著高于对照液体石蜡的反应值(P<0.05);其中对参照物反-2-己烯-1-醛的EAG反应值为(0.574±0.086)m V。而在这些化合物中,α-柏木醇、癸醛、壬酸、十四烷酸、十六烷酸、十六烷、十七烷、二十一烷、二十二烷、二十四烷、二十六烷、二十八烷、二十九烷、三十烷等物质的含量在同一采样时间下的两种植物间均差异显著(P<0.05,表1)。
亚洲玉米螟交配雌蛾对绿叶气味的EAG反应值较大,对萜类和醛类化合物的反应居中,对酸类和烃类化合物的反应值较小;其中,交配雌蛾对顺-3-己烯基乙酸酯的反应相对值最大(145.91%± 5.43%),而对二十四烷的反应相对值最小(45.07% ±2.13%)(表2)。方差分析结果显示,交配雌蛾对同一类化合物(绿叶气味除外)的反应相对值的差异均未达到显著水平(P>0.05),说明亚洲玉米螟对同一类化合物的辨识能力较差。
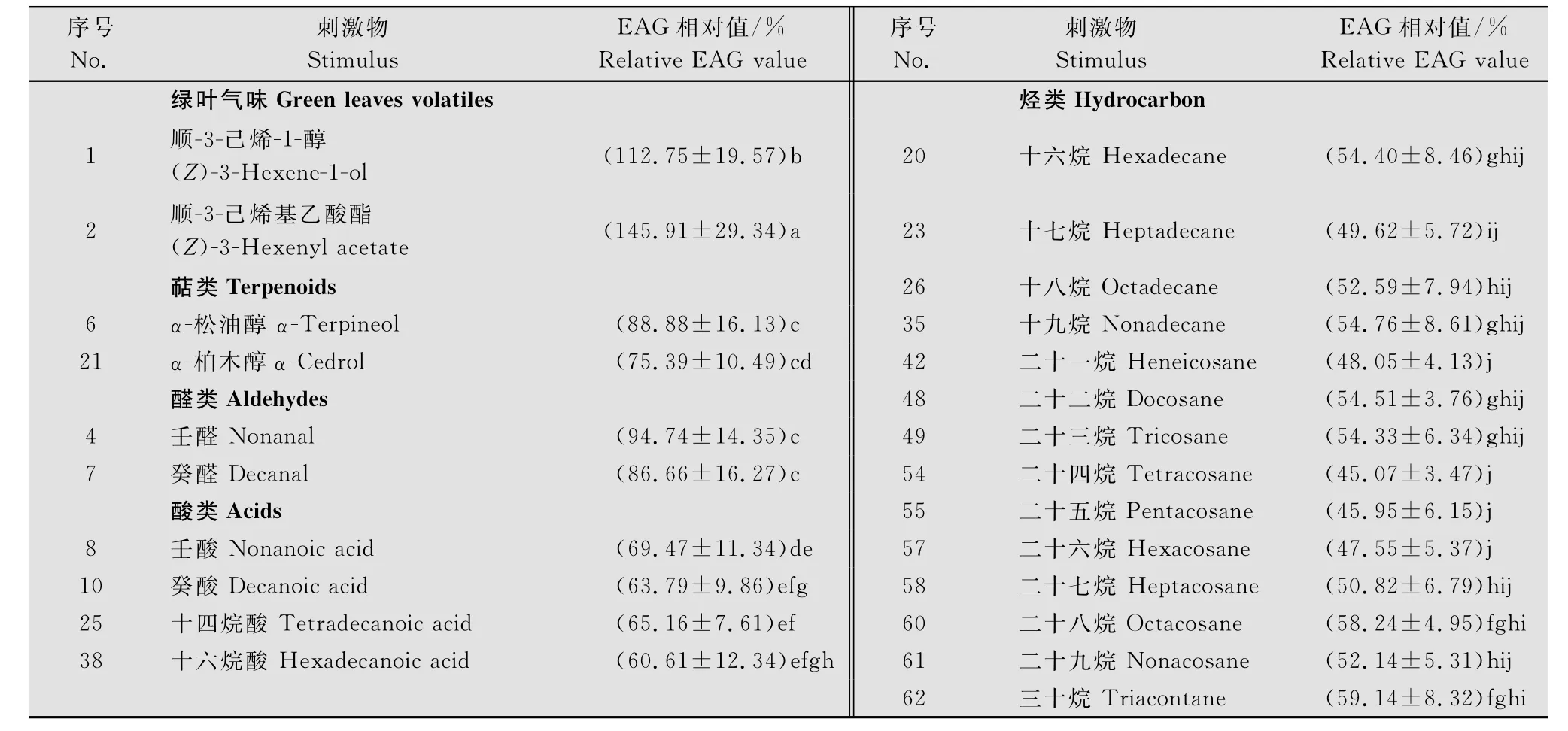
表2 亚洲玉米螟交配雌蛾对不同化合物的EAG反应相对值1)Table 2 The relative EAG values of mated female Ostrinia furnacalis to 24 compounds
3 讨论
昆虫与植物挥发性物质的关系一直是昆虫学和害虫防治学研究的重要内容之一,植物挥发物按照生物合成途径的不同,主要分为绿叶性气味化合物、萜类化合物和芳香族化合物等;而玉米的上述化合物依次由脂氧合酶途径、类异戊二烯途径和莽草酸途径这3个途径合成[19-21]。
通过溶剂漂洗法和气相色谱—质谱联用技术,在玉米苗期和吐丝期分别鉴定出38种、42种化合物,与其他学者的结果存在着差异。例如Buttery和Ling从玉米上提取出包括顺-3-己烯-1-醇和顺-3-己烯基乙酸酯在内的24种化合物[9];而尹姣等在玉米苗上共分离出顺-3-己烯-1-醇、顺-3-己烯基乙酸酯和十七烷等13种化合物[10];这可能是由于收集方法及玉米品种的不同,导致结果也存在一定的差异。国内外有关甘蔗叶片挥发物提取的研究未见报道,而关于茎秆挥发物提取的研究也较少。Perez等利用Porapak Q吸附剂从甘蔗茎秆中提取出乙酸乙酯、丙酸乙酯和丁酸乙酯等10种化合物[22];随后Rochat等通过SPME方法在甘蔗茎秆中分离出乙醛、乙醇和丙酸乙酯等17种化合物[23]。本文首次利用溶剂漂洗法提取出了叶片表面的次生代谢产物,并在甘蔗苗期和茎伸长期依次分离出45种、44种化合物。
不同生育时期玉米的挥发物不同,同样甘蔗挥发物在不同生育时期也存在差异;这与Agelopoulos等关于马铃薯不同生育时期挥发物存在差异的结果一致[24]。这可能是植物的生长发育和各种环境选择压相互作用导致植物资源分配结果不同,从而使挥发物具有植物种类、品种和生育时期的特异性、多样性和可变性的特点[25]。在甘蔗和玉米不同生育时期叶片中均存在顺-3-己烯-1-醇、十四烷酸和二十九烷等25种化合物,这些物质可能是禾本科植物分泌的一般性化合物,是由植物常见的生物合成途径产生[25];方差分析结果表明,这些物质的含量在甘蔗、玉米上存在着差异,这可能是由于这2种植物对环境的适应能力不同导致的。在甘蔗和玉米叶片漂洗结果中,玉米特有化合物为异长叶烯、9-十八碳烯酸、对甲氧基桂酸-2-乙基己酯及4,8,12,16-四甲基十七烷基-4-内酯,而甘蔗特有化合物包括十八烷酸甲酯、十八碳二烯酸乙酯、十八酰胺和2-二十五烷酮等12种化合物;这些特异性植物挥发物可能是由植物次生代谢物裂解而产生的具有高度特异性的化合物,存在于有亲缘关系的植物中[25]。这些挥发物质组成和结构的复杂性是生物多样性的组成部分,也是长期生物进化的结果。
研究结果表明玉米或者甘蔗不同生育时期的绿叶性气味化合物存在着差异,可能是由于该物质的合成与寄主植物叶片的幼嫩程度相关。甘蔗和玉米叶片的萜烯类化合物含量均较低,可能是由于该化合物与植物的抗性相关,在植物间接防御反应中起重要作用,未受虫害的植株释放量较少[26];当植物受到虫害诱导时,释放量会大幅度增加[27]。
昆虫的嗅觉在昆虫的寄主定位、取食、求偶及产卵场所的选择等方面具有重要意义,其嗅觉感受器主要分布在触角上[28],而触角电位技术是直接检测昆虫对挥发物化学信号反应的电生理方法。本研究结果表明亚洲玉米螟交配雌蛾对绿叶气味的EAG反应值较大,这与付晓伟等的研究结果一致[29];可能是由于绿叶气味引起了昆虫寻找食物和产卵场所等的欲望反应,可作为昆虫远距离定位的线索[29]。Huang等的研究发现绿叶气味顺-3-己烯-1-醇能引起亚洲玉米螟雌成虫的电生理反应[30],这与本文的研究结果一致;且顺-3-己烯-1-醇对亚洲玉米螟幼虫取食和成虫产卵均有作用[30]。本研究中能引起亚洲玉米螟交配成虫EAG反应的十四烷酸、十六烷酸,被证明是对亚洲玉米螟产卵有驱避作用的玉米螟卵块和幼虫粪便中的主要成分[31-32]。虽然亚洲玉米螟对烃类化合物EAG反应值较小,但有研究发现二十六烷、二十七烷、二十八烷、二十九烷等化合物对欧洲玉米螟[Ostrinia nubilalis(Hübner)]产卵有引诱作用[17],由此推测这些来自叶片表面蜡质层上的弱挥发物性烷烃类化合物可能是玉米螟近距离寄主定向行为、产卵行为等的信号物质。
鉴于昆虫与植物信息交流的复杂性,在明确甘蔗、玉米叶片漂洗物成分、含量及其对亚洲玉米螟EAG反应影响的基础上,下一步将通过室内生物测定和田间试验确定各活性物质对亚洲玉米螟行为的影响,在此基础上筛选出适宜的植物信息素引诱剂或者驱避剂,对亚洲玉米螟进行无污染生态控制。
4 结论
甘蔗和玉米不同生育时期挥发物种类主要包括萜类、绿叶气味、醛类、酮类、酸类、醇类、酯类、酰胺类和烃类,且这些化合物的含量在甘蔗和玉米不同生育时期之间存在着差异。亚洲玉米螟交配雌蛾对检测的24种挥发物均可产生EAG反应,表现出绿叶气味>萜类和醛类化合物>酸类和烃类化合物的总体反应趋势,且其对同一类化合物的嗅觉辨识能力较差。
参考文献
[1] 全国玉米螟综合防治研究协作组.我国玉米螟优势种的研究[J].植物保护学报,1988,15(3):145-152.
[2] 王振营,鲁新,何康来,等.我国研究亚洲玉米螟历史、现状与展望[J].沈阳农业大学学报,2000,31(5):402-412.
[3] 张颖,付晓伟,赵国强,等.蕉藕与几个玉米品种对亚洲玉米螟产卵的诱集作用[J].生态学报,2010,30(2):408-415.
[4] Risch S J.Intercropping as cultural pest control:prospects and limitations[J].Environmental Management,1983,7(1):9-14.
[5] Zhu Y Y,Chen H R,Fan J H,et al.Genetic diversity and disease control in rice[J].Nature,2000,406:718-722.
[6] 侯本军,林力,王敏芬,等.套种玉米对甘蔗的影响及经济效益分析[J].广东农业科学,2012(15):9-10,13.
[7] 李曲,钟东凯,林家贵.甘蔗套种玉米高产栽培技术[J].农技服务,2009,26(9):4,6.
[8] 董文霞,徐宁,肖春.作物多样性种植对植食性昆虫行为的影响[J].应用昆虫学报,2013,50(4):1133-1140.
[9] Buttery R G,Ling L C.Corn leaf volatiles:Identification using Tenax trapping for possible insect attractants[J].Journal of Agricultural and Food Chemistry,1984,32(5):1104-1106.
[10]尹姣,曹雅忠,罗礼智,等.草地螟对寄主植物的选择性及其化学生态机制[J].生态学报,2005,25(8):1844-1852.
[11]包家爱,林琳.甘蔗间套种鲜食玉米的可行性及关键技术[J].广西农学报,2011,26(3):29-31,35.
[12]宋彦英,周大荣,何康来.亚洲玉米螟无琼脂半人工饲料的研究与应用[J].植物保护学报,1999,26(4):324-328.
[13]吴银明,彭克智,黄久凯,等.攀西地区甘蔗苗期病虫害的发生、危害及防治建议[J].四川甘蔗,1991(1):46-51.
[14]郭良珍,冯荣杨,梁恩义,等.甘蔗螟虫发生危害与药剂防治[J].植物保护,2000,26(1):23-25.
[15]田翠.鲁南地区夏玉米苗期虫害危害特征与防治对策[J].山东省农业管理干部学院学报,2012,29(1):153,181.
[16]王振营,何康来,文丽萍,等.特用玉米及其病虫害发生与防治对策[J].植物保护,2003,29(3):12-14.
[17]Udayagiri S,Mason C E.Epicuticular wax chemicals in Zea mays influence oviposition in Ostrinia nubilalis[J].Journal of Chemical Ecology,1997,23(7):1675-1687.
[18]付晓伟,郭线茹,罗梅浩,等.烟夜蛾和棉铃虫对高浓度烟草挥发物的电生理和行为反应[J].昆虫学报,2008,51(9):902-909.
[19]Matsui K.Green leaf volatiles:Hydroperoxide lyase pathway of oxylipin metabolism[J].Current Opinion in Plant Biology,2006,9(3):274-280.
[20]Tholl D.Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J].Current Opinion in Plant Biology,2006,9(3):297-304.
[21]Pichersky E,Noel J P,Dudareva N.Biosynthesis of plant volatiles:Nature’s diversity and ingenuity[J].Science,2006,311(5762):808-811.
[22]Perez A L,Campos Y,Chinchilla C M,et al.Aggregation pheromones and host kairomones of west Indian sugarcane weevil,Metamasius hemipterus sericeus[J].Journal of Chemical Ecology,1997,23(4):869-888.
[23]Rochat D,Meillour P N L,Esteban-Duran J R,et al.Identification of pheromone synergists in American palm weevil,Rhynchophorus palmarum,and attraction of related Dynamis borass[J].Journal of Chemical Ecology,2000,26(1):155-187.
[24]Agelopoulos N G,Chamberlain K,Pickett J A.Factors affecting volatile emissions of intact potato plants Solanum tuberosum:Variability of quantities and stability of ratios[J].Journal of Chemical Ecology,2000,26(2):497-511.
[25]戴建青,韩诗畴,杜家纬.植物挥发性信息化学物质在昆虫寄主选择行为中的作用[J].环境昆虫学报,2010,32(3):407-414.
[26]娄永根,程家安.虫害诱导的植物挥发物:基本特性、生态学功能及释放机制[J].生态学报,2000,20(6):1097-1106.
[27]蔡晓明,孙晓玲,董文霞,等.虫害诱导植物挥发物(HIPVs):从诱导到生态功能[J].生态学报,2008,28(8):3969-3980.
[28]Bruynede M,Baker T C.Odor detection in insects:volatile codes[J].Journal of Chemical Ecology,2008,34(7):882-897.
[29]付晓伟,郭线茹,罗梅浩,等.两近缘种夜蛾对低浓度烟草挥发物的触角电位反应[J].生态学报,2009,29(6):2962-2970.
[30]Huang C H,Yan F M,Byers J A,et al.Volatiles induced by the larvae of the Asian corn borer(Ostrinia furnacalis)in maize plants affect behavior of conspecific larvae and female adults[J].Insect Science,2009,16(4):311-320.
[31]Li G Q,Ishikawa Y.Oviposition deterrents in larval frass of four Ostrinia species fed on an artificial diet[J].Journal of Chemical Ecology,2004,30(7):1445-1456.
[32]Li G Q,Ishikawa Y.Oviposition deterrents from the egg masses of adzuki bean borer,Ostrinia scapulalis and Asian corn borer,O.furnacalis[J].Entomologia Experimentalis et Applicata,2005,115(3):401-407.
Leaf volatiles of sugarcane and corn during different growth stages and electroantennogram response of the Asian corn borer Ostrinia furnacalis to them
Jiang Xingchuan, Xie Xingwei, Dong Wenxia, Xiao Chun,Chen Bin, Yan Naisheng, Li Xiang, Li Zhengyue
(College of Plant Protection,Yunnan Agricultural University,Key Laboratory of Agro-Biodiversity and Pest Management,founded by Education Ministry of China,Yunnan Key Laboratory of Agro-Biodiversity and Conservation,Kunming 650201,China)
The volatile chemicals were collected by rinsing the leaves of sugarcane(Saccharum officinarum)and corn(Zea mays)with dichloromethane during different growth stages,and were analyzed by gas chromatographymass spectrometry(GC-MS).The electro-physiological response of the Asian corn borer Ostrinia furnacalis to 24 selected volatile compounds was recorded by electroantennogram(EAG).The results indicated that 45 and 38 compounds were identified in the seedling stage of the sugarcane and the corn,respectively,while 44 and 42 com-pounds were found in the stem elongation stage of the sugarcane and the corn silking stage,respectively.Among the identified compounds,25 compounds were found in both corn and sugarcane leaves during different stages. And 4 compounds were found only in the corn leaves,while 12 compounds were present merely in the sugarcane leaves.The volatiles from the leaves of sugarcane and corn were terpenoids,green leaves,aldehydes,ketones,acids,alcohols,esters,amides,and hydrocarbons,and their contents differed between corn and sugarcane during different stages.However,the content of hydrocarbons was the most both in sugarcane and corn.All of the 24 tested volatile compounds elicited EAG responses of mated female moths.The green leaf volatiles elicited strong response,and(Z)-3-hexenyl acetate elicited the largest EAG value.The terpenoids and aldehydes elicited moderate responses,and acids and hydrocarbons elicited weak responses.The EAG values of the mated females to the compounds of the same type(except green leaf volatiles)showed no differences,and it suggested that the Asian corn borer did not discriminate the compounds of the same type effectively by olfaction.The study provides the basis for exploring the effect of plant volatiles on the behaviors of the Asian corn borer on corn and sugarcane.
sugarcane(Saccharum officinarum); corn(Zea mays); growth stage; plant volatile; Asian corn borer(Ostrinia furnacalis); electroantennogram(EAG)
S 435.132
A
10.3969/j.issn.0529-1542.2014.03.003
2013-10-08
2013-10-25
国家“973”计划项目(2011CB100404);云南农业大学学生科技创新创业基金项目(2013ZK031)
致 谢: 感谢中国科学院昆明植物研究所余珍老师在植物挥发物鉴定上给予的帮助。
*通信作者 E-mail:lizhengyue@263.net
# 对本文同等贡献,为并列第一作者。

