西瓜枯萎病菌侵染西瓜根茎部的组织病理学观察
魏君革, 孙海燕, 李 伟, 邓渊钰, 张爱香, 陈怀谷*
(1.南京农业大学植物保护学院,南京 210095;2.江苏省农业科学院植物保护研究所,南京 210014)
西瓜枯萎病菌侵染西瓜根茎部的组织病理学观察
魏君革1,2, 孙海燕2, 李 伟2, 邓渊钰2, 张爱香2, 陈怀谷1,2*
(1.南京农业大学植物保护学院,南京 210095;2.江苏省农业科学院植物保护研究所,南京 210014)
摘要为探明西瓜枯萎病菌侵染西瓜根系及茎的过程,本研究选取一株致病力较强的西瓜枯萎病菌FO1022,利用绿色荧光蛋白基因(GFP)标记该菌株,观察病原菌侵染西瓜根茎部的组织学过程。结果表明,用GFP标记的病菌接种感病西瓜品种‘苏蜜1号’,接种后2 d,显微观察显示病原菌的分生孢子附着于西瓜根系表皮细胞并萌发,沿细胞间层定殖生长;接种后5 d,在西瓜根部维管束导管中观察到大量菌丝和大型分生孢子,在根部表皮细胞上观察到大量厚垣孢子,在茎部部分维管束导管中也观察到少量的菌丝,此时48.6%的幼苗表现萎蔫症状;接种后9 d,茎部所有维管束导管都充斥着密集的菌丝体,此时91.7%的幼苗表现枯萎和死亡。与侵染感病品种相比,该菌株在侵染中抗品种和高抗品种时,在侵染时间上要明显滞后。本研究从组织病理学的角度观察并分析了GFP标记的西瓜枯萎病菌侵染西瓜根茎部的过程,为研究西瓜枯萎病菌的致病机理提供参考。
关键词西瓜枯萎病菌; 侵染过程; 绿色荧光蛋白
西瓜[Citrullus lanatus(Thunb.)Matsum&Nakai]枯萎病是由尖孢镰刀菌西瓜专化型(Fusarium oxysporum f.sp.niveum,FON)侵染引起的一种世界性真菌土传病害[1-2]。近年来,由于种植制度的改变(如高产连作),该病害已成为影响我国瓜类优质、高效生产的主要障碍[3]。目前,西瓜枯萎病的研究主要集中在生理小种分化、遗传多样性及其抗病育种等方面[4-9],对于其侵染过程和发病机制的研究还较少。
近年发展起来的绿色荧光蛋白(GFP)标记系统和荧光显微技术是研究病原菌在寄主体内侵染扩展以及两者之间互作的重要方法。2002年Lagopodi等人研究了GFP标记的番茄枯萎病菌(Fusarium oxysporum f.sp.radicis-lycopersici)在番茄根部定殖和侵染的过程[10],发现枯萎病菌在侵染番茄根部时,先与根毛相接触。在根部表皮细胞定殖时,主要沿细胞间层定殖生长,在侵染过程中没有发现形成特异的侵染结构。2011年又有研究报道了香蕉枯萎病菌(Fusarium oxysporum f.sp.cubense)侵染香蕉根系的过程,其与番茄枯萎病菌的侵染过程相似,但并没有发现病菌先与根毛相接触[11-12]。国内也有少数单位研究了FON的侵染过程,李春强[13]的研究发现FON经过48 h侵染即可进入西瓜的根维管束,第3天便进入茎维管束,第4天进入叶维管束,但是对整个侵染过程的描述还不够详细。
本研究选取一株致病力较强的西瓜枯萎病菌,利用GFP基因标记该菌株,通过激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察了该菌株在西瓜幼苗根茎部的侵染和扩展过程,并分析了病菌在感病和抗病西瓜品种的侵染过程差异,旨在为西瓜抗枯萎病基因的发掘和西瓜枯萎病菌致病机理的研究提供基础。
1 材料与方法
1.1 菌株和质粒
西瓜枯萎病菌FO1022由本实验室在江苏省高邮市西瓜种植大棚内采集、分离、单孢纯化和鉴定,按照常规方法保存于PDA斜面上。携带GFP基因的质粒SK1044由本实验室保存,GFP基因受构巢曲霉的三磷酸甘油醛脱氢酶启动子(Pgpd A)和色氨酸合成基因的终止子(Ttrp C)调控,该质粒以潮霉素B抗性基因(hyg)作为选择标记基因。
1.2 植物材料
‘苏蜜1号’(感病品种)、‘Charleston Gray’(中抗品种)和‘Calhoun Gray’(高抗品种),由江苏省农业科学院蔬菜研究所提供。
1.3 GFP基因转化西瓜枯萎病菌和转化子检测
采用农杆菌(Agrobacterium tumefaciens)介导法[10,14],将GFP基因转化到野生型西瓜枯萎病菌FO1022中,在含潮霉素B(200μg/m L)的PDA培养基上获得转化子,经纯化后保存待用。提取转化子的基因组DNA,用GFP基因(GFP-F:5′-CAAGTTCAGCGTGTCCG-3′和GFP-R:5′-CCAGCAGGACCATGTGA-3′)和潮霉素B抗性基因hyg(Hyg-F:5′-TGGAGCGAGGCGATGTTC-3′和Hyg-R:5′-CTTCTGCGGGCGATTTGT-3′)的特异性引物扩增,检测GFP基因和hyg基因是否插入到转化子基因组中。PCR循环参数为95℃预变性5 min;95℃30 s,58℃或62℃(GFP或hyg)30 s,72℃1 min,35个循环;最后72℃延伸10 min,用1%琼脂糖凝胶电泳检测PCR产物。利用荧光显微镜(Nikon,DS-Fi1,日本)观察转化子的荧光表达。表达荧光的转化子(命名为FO1022-GFP)在不含潮霉素B的PDA培养基上继代培养5次,然后再转接至含潮霉素B(200μg/mL)的PDA培养基上,以确定插入基因GFP在转化子中的遗传稳定性。
1.4 西瓜枯萎病菌FO1022-GFP对西瓜幼苗侵染的观察
选取1株生物学特性和致病力与野生菌株相似的转化子,采用蘸根接种法[5]接种西瓜品种‘苏蜜1号’、‘Charleston Gray’和‘Calhoun Gray’。接种菌液孢子浓度为5×105个/mL,当鉴别寄主子叶平展时,用无菌水冲净西瓜幼苗根部,将其根在孢子悬浮液中浸泡10 min,然后移栽到盛有灭菌土的塑料营养钵中。分别在接种后1、2、3、5、7、9和21 d取根和茎部,用无菌水冲洗,观察样本的横切面和纵切面的徒手切片。利用CLSM(蔡司LSM710,德国)观察,激发光波长为488 nm,发射波长为540 nm。
2 结果
2.1 转化子分子检测和稳定性测定
利用农杆菌介导法将GFP基因整合到西瓜枯萎病菌FO1022菌株基因组中,获得绿色荧光蛋白基因标记的菌株FO1022-GFP。利用GFP和hyg基因特异性引物从转化子菌株FO1022-GFP基因组DNA中能扩增到590 bp和290 bp的目的片段,而野生型FO1022菌株中无扩增片段(图1a,b),表明GFP基因已经转入西瓜枯萎病菌FO1022菌株的基因组中。转化子在不含潮霉素的PDA平板上继代培养5代后,仍然能够发出绿色荧光并且也能够在含潮霉素的平板上生长。
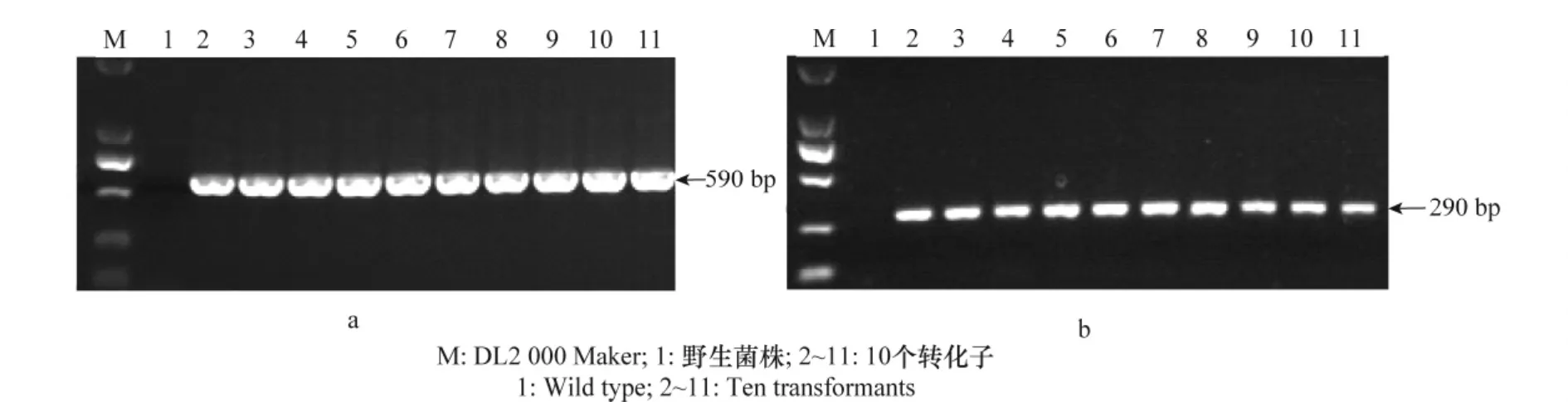
图1 转化子中GFP基因(a)和hyg基因(b)的PCR检测Fig.1 PCR amplification of the transformants of GFP(a)and hyg(b)gene fragments
2.2 FO1022-GFP在西瓜幼苗根茎部的侵染观察
选取其中1株生物学特性和致病力与野生菌株相似的转化子菌株FO1022-GFP用于侵染观察,FO1022-GFP无论在PDA上还是在西瓜幼苗根茎部组织中都能发出明亮的绿色荧光,并且在CLSM分析时并没有出现荧光减弱的现象。在进行CLSM分析时,为了更清晰地观察FO1022-GFP在植株内的侵染和扩展过程,将西瓜幼苗自发的荧光标注为红色。
接种1 d后,选取西瓜幼苗的根为试验材料,用无菌水将其冲洗干净,将其中一整条根系放在载玻片上,滴加蒸馏水,盖上盖玻片,直接进行显微观察,发现病原菌的分生孢子随机附着于根系表皮细胞并开始萌发(图2a,b)。接种2 d后,刚萌发的幼嫩菌丝体开始在根部表皮细胞进行侵染(图2c),沿着细胞间隙生长(图2d),未观察到菌丝体侵入到表皮细胞内,根部的维管束导管中未观察到菌丝侵染,在侵入过程中没有观察到附着胞,只是菌丝顶端表现略微膨大,病原菌在3个品种上未表现出侵染差异。
接种后3 d,‘苏蜜1号’幼苗根部的维管束导管中可观察到不连贯的少量菌丝(图2e),在‘Charleston Gray’和‘Calhoun Gray’幼苗根部的维管束导管中未观察到菌丝侵染,所有品种的幼苗植株都未表现发病症状。接种后5 d,50%左右的‘苏蜜1号’幼苗表现萎蔫症状,显微观察显示其根部维管束导管中以及周围组织中可观察到大量菌丝体生长(图2f),在维管束导管中有大量的大型分生孢子产生(图2h),将根系切断后并滴加蒸馏水,大量的分生孢子从根部的维管束中流淌出来(图2i),并且在根部表皮上可观察到大量的厚垣孢子产生(图2l,m)。‘苏蜜1号’幼苗茎基部组织的维管束导管中也观察到少量的菌丝侵染。‘Charleston Gray’和‘Calhoun Gray’的幼苗仅根部维管束导管中及周围组织中观察到菌丝侵染和分生孢子的产生,其植株未表现发病症状。
接种后7 d,80%左右的‘苏蜜1号’幼苗都表现萎蔫症状,其中30%左右的幼苗已经开始枯萎死亡,显微观察显示其茎部维管束导管中出现大量的菌丝体,同时‘Charleston Gray’和‘Calhoun Gray’幼苗也开始出现萎蔫症状,其茎部部分维管束导管中也观察到菌丝体侵染(图2j)。接种后9 d,90%左右的‘苏蜜1号’幼苗枯萎死亡,显微观察显示其茎部所有的维管束导管都充斥着密集的菌丝体(图2k),并且菌丝体从维管束导管向周围组织扩展,在堵塞的维管束导管中同时也发现大量的厚垣孢子产生。此时部分‘Charleston Gray’和‘Calhoun Gray’幼苗也开始出现萎蔫枯萎死亡症状,显微观察显示其茎部维管束导管中可观察到大量的菌丝体,但还未充斥所有的维管束导管,而部分未表现症状的‘Charleston Gray’和‘Calhoun Gray’幼苗根部维管束导管中也观察到少量的菌丝。
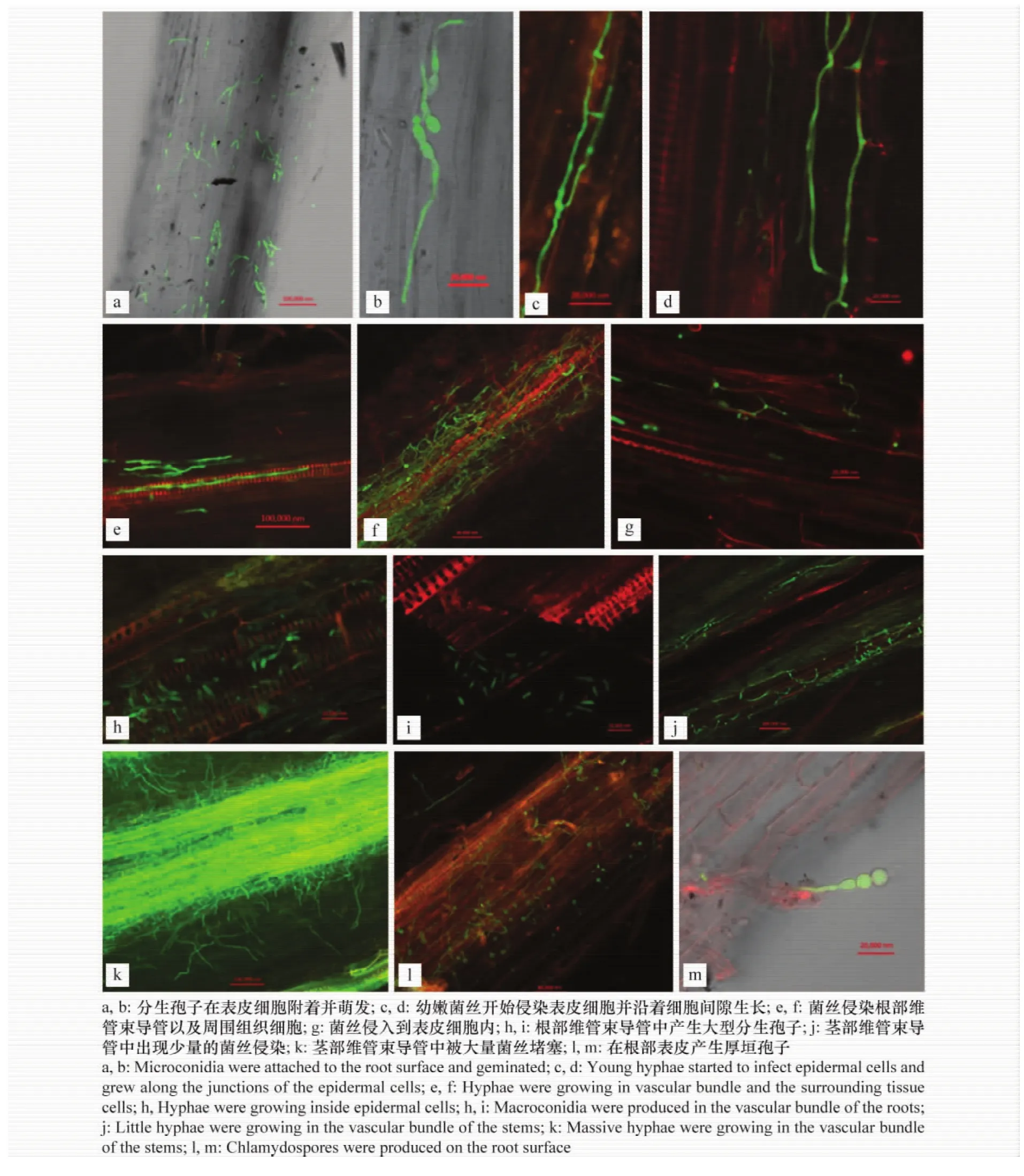
图2 FO1022-GFP在西瓜幼苗根茎部的侵染过程Fig.2 Infection process of FO1022-GFP in watermelon root and stem
3 讨论
本研究成功将西瓜枯萎病菌FO1022进行GFP标记,获得的转化子无论在离体培养基上还是西瓜植株上均能发出明亮的绿色荧光,说明GFP基因已经转入到菌株FO1022基因组中并且能够稳定遗传。关于土传病害侵染寄主时初始发生位置,不同的病原菌中是不一样的,大丽轮枝菌初始侵染位点既可以为寄主的根毛区和根尖伸长区,也可以是侧根萌发处[15-16]。番茄枯萎病菌侵染番茄时初始侵染位点主要位于寄主的根毛区[10],香蕉枯萎病菌侵染香蕉时未观察到病原菌对根系根毛的侵染或附着[11-12]。本研究发现分生孢子是随机附着在根部表皮细胞上的,分生孢子萌发后有少量的菌丝会附着在根毛上,大部分菌丝附着在根部表皮细胞上沿着细胞间层侵染。但定殖在根尖区、根冠区以及其他位置萌发的菌丝是否都能侵入到根部表皮细胞或根部维管束中进行系统侵染这还需要进一步的研究观察。病原真菌在侵染寄主细胞过程中,通常产生附着胞以提高其侵染的能力。本研究发现在侵染抗病和感病西瓜幼苗根部过程中,孢子首先萌发形成芽管,芽管延伸产生菌丝,这些菌丝主要在细胞间隙内扩展,侵染中后期观察到有部分菌丝在细胞内侵染,在侵染细胞过程中没有检测到附着胞,但有些菌丝在根部表皮细胞间隙侵染时顶端会表现得略为膨大,这与番茄枯萎病菌侵染番茄根部以及香蕉枯萎病菌侵染香蕉根部时是相一致的。
西瓜枯萎病菌FO1022既可以侵染感病品种,也可以侵染抗病品种,但抗病品种能够明显地抑制病原菌的侵染和扩展,这种抗病反应主要体现在侵染时间上明显滞后。本研究显微观察发现接种后3 d,只有‘苏蜜1号’根部维管束导管中发现少量菌丝,而在‘Charleston Gray’和‘Calhoun Gray’根部维管束导管中没有发现菌丝侵入;接种后5 d,‘苏蜜1号’茎部维管束导管观察到菌丝,而‘Charleston Gray’和‘Calhoun Gray’只在根部维管束中观察到菌丝;直到接种后7 d,在‘Charleston Gray’和‘Calhoun Gray’的茎部维管束中才观察到菌丝。从西瓜幼苗发病的症状来看,‘Charleston Gray’和‘Calhoun Gray’幼苗接种后7 d才开始表现症状,接种后10 d才开始死亡,而‘苏蜜1号’幼苗在接种9 d后已基本死亡。而其他的侵染差异还需要进行进一步的研究观察。
参考文献
[1] 吴学宏,卢志军,王品品,等.西瓜枯萎病综合防治研究进展[J].植物保护,2011,37(4):27-32.
[2] 吕桂云,郭绍贵,张海英,等.西瓜与枯萎病菌非亲和互作的表达序列标签分析[J].中国农业科学,2010,43(9):1883-1894.
[3] 于丰年,朱天成.西瓜枯萎病的发生与综合防治[J].现代农业科技,2010(6):177.
[4] 安美君,吴凤芝,刘博.黑龙江省西瓜枯萎病菌生理小种鉴定及部分西瓜品种抗病鉴定[J].上海交通大学学报,2009,27(5):494-500.
[5] 耿丽华,郭绍贵,吕桂云,等.西瓜枯萎病菌生理小种鉴定技术体系的建立和验证[J].中国蔬菜,2010(20):52-60.
[6] 郭绍贵.西瓜枯萎病R基因同源序列的克隆与分析[D].扬州:扬州大学,2005:23-25.
[7] 王汉荣,方丽,任海英,等.西瓜枯萎病防治药剂筛选[J].植物保护,2011,37(1):150-152.
[8] 许勇,欧阳新星,张海英,等.与西瓜野生种质抗枯萎病基因连锁的RAPD标记[J].植物学报,1999,41(9):952-955.
[9] 段会军,张彩英,李喜焕,等.河北省西瓜枯萎病菌生理小种鉴定与AFLP分析[J].中国农业科学,2007,40(5):925-931.
[10]Lagopodi A L,Ram A F J,Lamers G E M,et al.Novel aspects of tomato root colonization and infection by Fusarium oxysporum f.sp.radicis-lycopersici revealed by confocal laser scanning microscopic analysis using the green fluorescent protein as a marker[J].Molecular Plant-Microbe Interactions,2002,15(2):172-179.
[11]Li C Y,Chen S,Zuo C W,et al.The use of GFP-transformed isolates to study infection of banana with Fusarium oxysporum f.sp.cubense race 4[J].European Journal Plant Pathology,2011,131(2):327-340.
[12]殷晓敏,徐碧玉,郑雯,等.香蕉枯萎病菌侵染香蕉根系的组织学过程[J].植物病理学报,2011,41(6):570-575.
[13]李春强,梁慧施,夏亦荠,等.GFP标记的尖孢镰刀菌西瓜专化型侵染西瓜过程观察[J].热带作物学报,2011,32(10):1935-1939.
[14]肖荣凤,朱育菁,李燕丹,等.西瓜尖孢镰刀菌FOV-135的绿色荧光蛋白基因转化[J].福建农业学报,2009,24(6):521-524.
[15]Vallad G E,Subbarao K V.Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein tagged isolate of Verticillium dahliae[J].Phytopathology,2008,98(8):871-885.
[16]Maruthachalam K,Klosterman S J,Anchieta A,et al.Colonization of spinach by Verticillium dahliae and effects of pathogen localization on the efficacy of seed treatments[J].Phytopathology,2013,103(3):268-280.
中图分类号:S 436.5
文献标识码:A
DOI:10.3969/j.issn.0529-1542.2014.03.006
收稿日期:2013-11-13
修订日期:2013-12-03
基金项目:江苏省农业科技自主创新项目(CX(11)4014)
*通信作者Tel:025-84390386;E-mail:huaigu@hotmail.com
Jistological observation of watermelon root and stem infected by Fusarium oxysporum f.sp.niveum
Wei Junge1,2, Sun Haiyan2, Li Wei2, Deng Yuanyu2, Zhang Aixiang2, Chen Huaigu1,2
(1.College of Plant Protection,Nanjing Agricultural University,Nanjing 210095,China;2.Institute of Plant Protection,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
AbstractIn order to observe the infection process of Fusarium oxysporum f.sp.niveum(FON)in watermelon root and stem,the strain FO1022 with high virulence was selected and the green fluorescent protein was transformed into this pathogen to observe the infection process.The results showed that in the susceptible cultivar‘Sumi No.1’two days after inoculation,conidia of FO1022-GFP were found to attach the watermelon root epidermis and germinated;the preferential colonization sites on the root surface were the grooves along the junctions of adjacent epidermal cells.At day 5 after inoculation,massive hyphae and macroconidia of the fungal pathogen were observed in xylem vessels of the watermelon root,and massive chlamydospores were observed in the root epidermis,while only a few hyphae were observed in xylem vessels of the watermelon stem;at this stage,48.6%of the seedlings appeared to wilt.At day 9 after inoculation,all xylem vessels of the watermelon stem were clogged by massive hyphae,and 91.7%of the seedlings appeared to exsiccate.Compared to the infection process in susceptible cultivar,this pathogen infected more slowly in the moderately-resistant or resistant cultivar.The infection process of FO1022-GFP in watermelon root and stem was observed and analyzed by histopathological observation,which provides a reference for exploring the pathogenic mechanism of this pathogen.
Key wordsFusarium oxysporum f.sp.niveum;infection process;green fluorescent protein

