猕猴桃灰霉病病原菌鉴定及室内药剂筛选
李 诚, 蒋军喜*, 赵尚高, 李帮明, 余 强, 涂贵庆
(1.江西农业大学农学院,南昌 330045;2.江西省奉新县农业局,奉新 330700)
猕猴桃灰霉病病原菌鉴定及室内药剂筛选
李 诚1, 蒋军喜1*, 赵尚高2, 李帮明2, 余 强2, 涂贵庆2
(1.江西农业大学农学院,南昌 330045;2.江西省奉新县农业局,奉新 330700)
摘要通过病原菌形态特征、致病性测定及rDNA-ITS的同源性分析,确定江西奉新猕猴桃灰霉病的病原菌为Botrytis cinerea(有性态Botryotinia fuckeliana),该病菌在5~30℃的温度范围内均能正常生长,且该病菌只能通过伤口接种引起猕猴桃发病。采用菌丝生长速率法测定11种杀菌剂对该病原菌的毒力大小,结果表明,肟菌·戊唑醇水分散粒剂、氟硅唑乳油、异菌脲悬浮剂、苯醚甲环唑水分散粒剂、戊唑醇悬浮剂和吡唑醚菌酯乳油对其菌丝生长有较强的抑制作用,EC50值分别为0.118 0、0.288 6、0.355 2、1.541 8、1.760 2和1.778 4μg/mL。
关键词猕猴桃灰霉病; Botrytis cinerea; 毒力测定
猕猴桃(Actinidia chinensis Planch.)为猕猴桃科、猕猴桃属多年生木质落叶藤本植物[1]。我国于20世纪70年代从新西兰引进优良品种开始规模化种植猕猴桃以来,到目前为止已发展成为全球最大的猕猴桃生产国[2]。我国的猕猴桃主要分布在陕西、河南、四川、江西等省的亚热带中高海拔地区。江西奉新自20世纪80年代开始对猕猴桃进行品种选育和栽培以来,到目前为止栽培面积超过2 600 hm2,猕猴桃产业已成为奉新农业的主导产业[3]。然而,随着奉新猕猴桃生产规模的逐年扩大,猕猴桃灰霉病也日益突出。该病害在奉新主要发生在猕猴桃果实贮藏期,在花期和挂果期较少发生,病果率通常在10%左右,严重时可达20%以上。果实受害时常从果蒂处开始变褐腐烂,逐渐向脐部扩展而造成全果发病,病果表面常出现白色至灰色霉层,有时可见黑色不规则形菌核。灰霉病已对奉新猕猴桃果实贮藏产生了较大影响。鉴于目前国内对猕猴桃灰霉病研究相对较少的现状,笔者对奉新猕猴桃灰霉病进行了病菌分离鉴定,并就温度对病菌菌丝生长的影响和不同药剂对其室内毒力大小进行了测定,以期增进对猕猴桃灰霉病的了解,并为该病害的防控提供理论依据。
1 材料与方法
1.1 供试材料
病果:分别从江西奉新县农业局冷藏库和江西新叶有机农产品有限公司冷藏库中采集具典型灰霉病症状的猕猴桃病果(‘金魁’),各采集25个,采回后立即进行病菌分离。
供试药剂:共11种,分别为25%吡唑醚菌酯乳油,50%烯酰吗啉可湿性粉剂,50%啶酰菌胺水分散粒剂,均由巴斯夫(中国)有限公司生产;75%肟菌·戊唑醇水分散粒剂,50%异菌脲悬浮剂,43%戊唑醇悬浮剂,均由拜耳作物(中国)有限公司生产;40%氟硅唑乳油,52.5%噁唑菌酮·霜脲氰水分散粒剂,均由上海杜邦农化有限公司生产;10%苯醚甲环唑水分散粒剂,由先正达(中国)投资有限公司生产;50%福美双可湿性粉剂,由河北赞峰生物工程有限公司生产;70%甲基硫菌灵可湿性粉剂,由江苏龙灯化学有限公司生产。
1.2 病原菌的分离培养
在超净工作台上,用70%乙醇擦拭消毒病果表皮,待乙醇挥发后撕去病果皮,将发病果肉移于备好的PDA平板上,置于25℃培养箱中培养,待果肉四周长出菌丝体后,挑取菌落边缘菌丝体,将其转移至新的PDA平板上对其进行纯化获得纯培养。将所获得的纯培养分别置5、10、15、20、25、30和35℃7个不同温度中进行培养,跟踪观测菌落形态和颜色变化,并测量不同温度下的菌丝生长速率。斜面甘油保存菌种于4℃冰箱备用。
1.3 致病性测定
按照柯赫氏法则,对分离得到的病菌在离体猕猴桃(‘金魁’)上进行致病性测定。方法如下:接种分刺伤和非刺伤两种方式进行。刺伤接种:去除供试果接种面的果毛后用乙醇擦拭消毒,待乙醇风干后用无菌打孔器打取一个直径约5 mm的伤口面,以直径为5 mm的菌饼为接种体,将接种体菌丝面紧贴伤口面进行接种,设无菌PDA基块作对照,每处理3次重复,接种后用无菌湿棉球保湿,置25℃培养箱中逐日观测接种果发病情况,待果实发病后从病部再次分离病原菌。非刺伤接种,直接将接种体菌丝面紧贴果实消毒面进行接种,其余方法步骤同刺伤接种。
1.4 病原菌的分子鉴定
采用CTAB法提取病原菌基因组DNA[4],并用真核生物通用引物对ITS1(ITS1 5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′,)扩增r DNA-ITS序列[5]。扩增反应体系:ITS1(10 pmol/L)1μL、ITS4(10 pmol/L)1μL、DNA模板2μL、2×Taq PCR Master Mix 25μL,加dd H2O 21μL至终体积50μL。混匀后按以下程序进行PCR扩增:94℃3 min;94℃30 s,60℃30 s,72℃1 min,35个循环;72℃10 min。阴性对照用dd H2O取代DNA模版。扩增产物经1%琼脂糖凝胶电泳检测后,委托天根生化(北京)有限公司进行测序,测序结果经DNAStar(Madison Wisconsin,USA)软件进行序列分析去除两端引物后BLAST与NCBI数据库中已知序列进行相似性比较,确定病原菌归属。
1.5 室内毒力测定方法
采用菌丝生长速率法测定11种药剂对猕猴桃灰霉病菌的抑菌作用[6]。具体方法如下:用无菌水将各药剂按有效成分分别稀释为1.0×104、2.5× 103、6.3×102、1.6×102、3.9×101、1.0×101、2.4× 100、6.1×10-1、1.5×10-1μg/m L 9个不同浓度的药液,取1 m L药液与9 m L约50℃的PDA混匀配制含不同浓度的含药PDA平板,以无菌水作为对照,用直径5 mm的无菌打孔器在适龄菌落边缘同一圆周上打取菌饼,将其接至PDA平板中央,每平板接一个菌饼,每处理3个重复,接菌后置25℃培养箱培养72 h后用十字交叉法测量菌落直径,计算抑菌率,用DPS软件进行统计分析,求得毒力回归方程、EC50和相关系数,根据EC50大小评价杀菌剂的抑菌效果。

2 结果与分析
2.1 病菌分离及形态特征
共对50个发病猕猴桃进行病菌分离,经纯化后观测比较发现,所有菌株的形态特征一致,因此将其视为同一种真菌,选取一个代表性菌株编号HM-1,对其形态特征描述如下:在25℃条件下,菌落蓬松绒毛状,初为白色,后逐渐变为灰白色,边缘不整齐,生长速率为20.17 mm/d,培养15 d后平板上可见大小约(1~4)mm×(1~2)mm的不规则黑色菌核,25 d后可见菌核上产生大量的灰色菌丝体(图1a~b),显微镜检分生孢子梗丛生,大小约为(200~300)μm×(11~16)μm,淡褐色,顶端分枝,其上附着分生孢子,分生孢子脱落后露出棒头状小柄(图1c),分生孢子卵圆形或椭圆形,无色或淡灰褐色,单胞,大小为(8.75~13.75)μm×(6.25~8.75)μm(图1d),该病菌在5~30℃的温度范围内均能正常生长,最适生长温度为20℃(生长速率25.11 mm/d),大于35℃时菌落停止生长(图2)。根据病原的形态特征结合相关文献报道,初步将该病原菌鉴定为灰葡萄孢菌(Botrytis cinerea)。
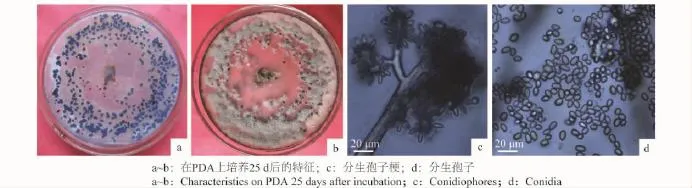
图1 病原菌HM-1形态学特征Fig.1 Morphological characteristics of HM-1
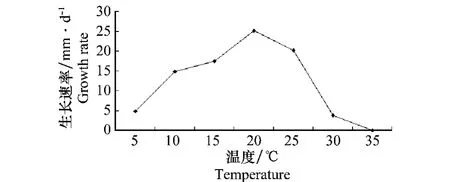
图2 温度对HM-1菌丝生长的影响Fig.2 Effects of temperature on mycelial growth of HM-1
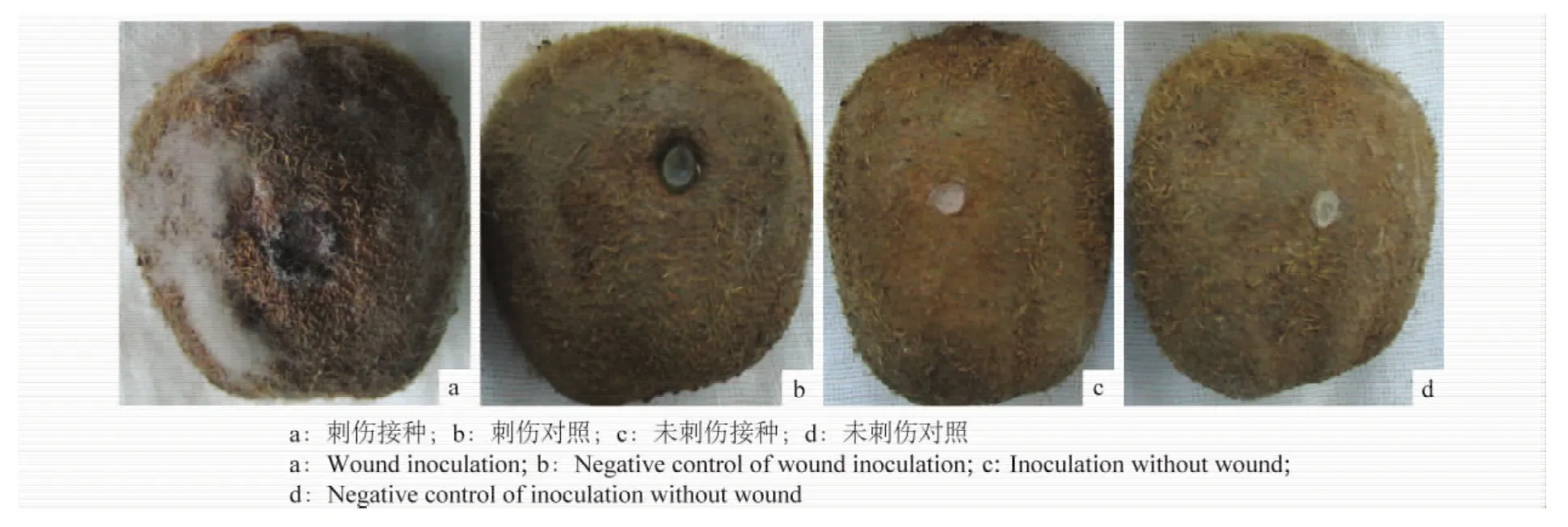
图3 HM-1菌株对猕猴桃的致病性测定Fig.3 Pathogenicity assays of HM-1 to kiwifruit
2.2 致病性测定
致病性测定结果表明:接种96 h后,刺伤接种的猕猴桃开始发病,从接种口开始有大量绒状灰白色菌丝产生,接种口周围果实发软腐烂(图3a),刺伤对照接种和非刺伤接种均不表现出发病症状(图3b~d)。对接种发病的猕猴桃再次进行病菌分离,分离结果获得与接种菌一致的病原菌。
2.3 病原菌的分子鉴定
以供试菌株HM-1基因组DNA为模板,用引物ITS1/ITS4对其rDNA-ITS序列进行PCR扩增,扩增产物经测序去除两端引物后获得大小为500 bp的片段(GenBank登录号为JX885685),经BLAST与NCBIGenBank中已有序列进行相似性比较分析,分析结果表明该菌株与一株来自西班牙的Botryotinia fuckeliana(GenBank登录号为FN812726)菌株大小均为500 bp,且无碱基差异,相似性为100%。根据序列分析结果将其菌株HM-1鉴定为Botryotinia fuckeliana。
由于Botrytis cinerea的有性态即为Botryotinia fuckeliana,所以结合病菌的形态学特征、致病性测定和分子鉴定结果,确定引起猕猴桃灰霉病的病原菌为灰葡萄孢菌(Botrytis cinerea)(有性态为富氏葡萄核盘菌Botryotinia fuckeliana)。
2.4 不同药剂对猕猴桃灰霉病菌的抑菌效果
室内毒力测定结果表明,不同药剂对猕猴桃灰霉病菌菌丝生长均表现出不同程度的抑制作用(表1),其中,肟菌·戊唑醇、氟硅唑和异菌脲的抑菌效果很好,EC50分别为0.118 0、0.288 6和0.355 2μg/mL;其次为苯醚甲环唑、戊唑醇和吡唑醚菌酯,EC50分别为1.541 8、1.760 2和1.778 4μg/m L;噁唑菌酮·霜脲氰和烯酰吗啉的抑菌效果较差,其EC50分别高达86.381和415.22μg/mL。
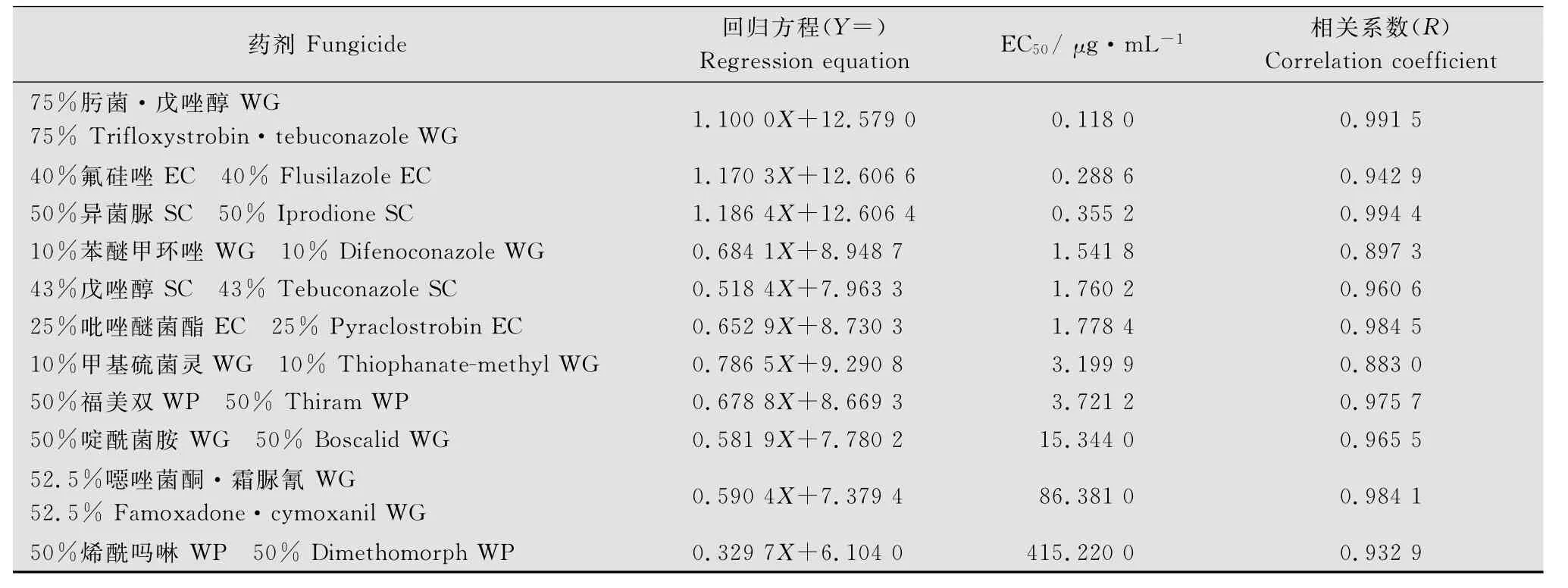
表1 11种药剂对猕猴桃灰霉病菌的毒力回归方程Table 1 Toxicity regression equation of 11 fungicides against gray mold pathogen of kiwifruit
3 讨论
随着分子生物学的发展,rDNA-ITS序列分析已成为植物病原真菌分类鉴定研究中一种常用、快速、灵敏且准确可靠的手段。本研究应用r DNAITS序列分析和病原的形态特征相结合,确定引起奉新猕猴桃灰霉病的病原菌为灰葡萄孢菌(Botrytis cinerea)(有性态为富氏葡萄核盘菌B.fuckeliana),两种方法鉴定结果相互印证,使病原鉴定结果可靠性更强。
Botrytis cinerea(有性态B.fuckeliana)属半知菌类,丝孢纲,丛梗孢目,丛梗孢科,葡萄孢属真菌,是一类重要的植物致病菌,主要危害包括猕猴桃在内的苗圃植物、蔬菜、观赏园艺植物、田间(果园)作物、储藏和运输过程中的农产品等[7]。由Botrytis cinerea(B.fuckeliana)引起的猕猴桃灰霉病是猕猴桃生长期和采后储藏期的重要病害之一,该病害自20世纪80年代初在美国、意大利和新西兰被发现报道以来[8-10],到目前为止已在日本、韩国、智利和土耳其等多个国家和地区被陆续报道发现[7,11-13]。该病害在报道的国家和地区都曾带来严重的产量和经济损失,如20世纪90年代在美国加利福尼亚州和新西兰猕猴桃种植区发生时造成当地约20%~30%的经济损失[14],我国于1990年在陕西周至县发现该病害,造成约450 hm2猕猴桃有不同程度的发病,发病率高达8.7%,给当地猕猴桃产业的发展带来较大的损失[15]。
目前国内对猕猴桃灰霉病研究相对甚少,防治该病目前仍以化学防治为主,烟剂2号(陕西动物研究所研制)、乙烯菌核利、异菌脲和二甲酰亚胺是目前国内防治猕猴桃灰霉病的常用药剂[16-17]。国外的研究已从传统的化学防治逐渐向植物源农药和生物防治方面发展。化学防控方面,Michailides和Bardas等人研究表明乙烯菌核利、啶酰菌胺和吡唑醚菌酯对猕猴桃灰霉病具有较好的防控作用[14,18];Minas等人研究表明在冷库中用臭氧处理可以大大降低猕猴桃灰霉病的发生[19]。植物源农药方面,Fatemia和Shirzad等报道从百里香、茴香、夏得薄荷、葛缕子和茴芹等植物中提取的香油精对猕猴桃灰霉病菌具有很好的抑菌作用[20-21];Kulakiotu等对欧洲葡萄和美洲葡萄挥发物进行研究后得出美洲葡萄挥发物对猕猴桃灰霉病具较好的防治作用[22]。生物防控方面,Boyd-wilson等研究表明Alternaria、Epicoccum和Ulocladium spp.三类真菌与猕猴桃灰霉病菌具有很好的竞争作用,可以减弱猕猴桃灰霉病菌的致病力[23]。
目前生物防治和植物源农药在猕猴桃灰霉病的防治方面在国内尚未被推广,具体防效如何未知,所以化学防治还是首选的防控措施。在本研究所筛选出的6种药剂中,异菌脲和吡唑醚菌酯,前人已有报道在田间具有较好的防控作用[17-18],而肟菌·戊唑醇、氟硅唑、苯醚甲环唑和戊唑醇为首次有针对性地开展对猕猴桃灰霉病菌的药剂筛选研究。由于本研究是在室内完成,所以在推广到田间病害防控之前,还需进一步做田间防效试验,此外还需考虑药剂的成本、对猕猴桃生长和环境是否有影响,力争施用低毒、低残留、低成本的高效环保型杀菌剂。
参考文献
[1] 贾爱平,王飞,张潮红,等.中华猕猴桃品种间亲和性研究[J].园艺学报,2010,37(11):1829-1835.
[2] 姜转宏.猕猴桃产业演化发展探析[J].西北农林科技大学学报(社会科学版),2007,7(2):109-112.
[3] 李诚,蒋军喜,冷建华,等.奉新县猕猴桃果实腐烂病病原菌分离鉴定[J].江西农业大学学报,2012,34(2):259-263.
[4] Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[5] White T J,Burns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]∥Innis M A,Gelfand D H,Sninsky J J,ed.PCR Protocols:A guide to methods and applications.Academic Press,1990:315-322.
[6] 李诚,蒋军喜,冷建华,等.6种杀菌剂对猕猴桃主要腐烂病菌的室内毒力测定[J].中国南方果树,2012,41(1):27-29.
[7] Karakaya A,Bayraktar H.Botrytis disease of kiwifruit in Turkey[J].Australasian Plant Disease Notes,2009,4:87-88.
[8] Sommer N F,Fortlage R J,Edwards D C.Minimizing postharvest diseases of kiwifruit[J].California Agriculture,1983,37(1-3):16-18.
[9] Bisiach M,Minervini G,Vercesi A.Biological and epidemiological aspects of the kiwifruit(Actinidia chinensis Planchon)rot caused by Botrytis cinerea Pers[J].Rivista Patologia Vegetale Serie IV,1984,20:38-55.
[10]Pennycook S R.Spraying kiwifruit for control of Botrytis storage rot[J].Orchardist of New Zealand,1984,57:33.
[11]Ieki H.Kiwifruit diseases in Japan[J].Japan Pesticide Information,1993,61:11-13.
[12]Koh Y J,Jung S,Hur J S.Current status of occurrence of major diseases on kiwifruits and their control in Korea[J].Acta Horticulturae,2003,610:437-443.
[13]Niklis N,Sfakiotakis E,Thanassoulopoulos C C.Ethylene biosynthesis in“Hayward”kiwifruit infected by Botrytis cinerea[J].Current Plant Science and Biotechnology in Agriculture,1993,16:255-256.
[14]Michailides T J,Elmer P A G.Botrytis gray mold of kiwifruit caused by Botrytis cinerea in the United States and New Zealand[J].Plant Disease,2000,84(3):208-223.
[15]杨永州,张秦生,王慧琴.西安发现猕猴桃灰霉病[J].植物检疫,1991,5(5):400.
[16]陈川,惠伟,郭小霞,等.烟剂防治储藏期猕猴桃灰霉病之效果初探[J].中国农学通报,2005,21(11):80-81.
[17]李爱华,郭晓成.猕猴桃灰霉病发生规律及防治[J].西北园艺,2003(2):41.
[18]Bardas G A,Veloukas T,Koutita O,et al.Multiple resistance of Botrytis cinerea from kiwifruit to SDHIs,Qols and fungicides of other chemical groups[J].Pest Management Science,2010,66:967-973.
[19]Minas L S,Karaoglanidis G S,Manganaris G A,et al.Effect of ozone application cold storage of kiwifruit on the development of stem-end rot caused by Botrytis cinerea[J].Post harvest Biology and Technology,2010,58:203-210.
[20]Fatemia H,Aminifarda M H,Mohammadia S.Efficacy of plant essential oils on post-harvest control of rot caused by Botrytis cinerea on kiwifruits[J].Archives of Phytopathology and Plant Protection,2013,46(5):536-547.
[21]Shirzad H,Hassani A,Ghosta Y,et al.Assessment of the antifungal activity of natural compounds to reduce postharvest gray mould(Botrytis cinerea Pers:Fr)of kiwifruit(Actinidia deliciosa)during storage[J].Journal of Plant Protection Research,2011,51(1):1-6.
[22]Kulakiotu E K,Thanassoulopoulos C C,Sfakiotakis E M.Postharvest biological control of Botrytis cinerea on kiwifruit by volatiles of‘Isabella’grapes[J].Phytopathology,2004,94(12):1280-1285.
[23]Boyd-wilson K S H,Perry J H,Walter M.Persistence and survival of saprophytic fungi antagonistic to Botrytis cinerea on kiwifruit leaves[C].Proceedings of the 51st New Zealand Plant Protection Society,1998:96-101.
中图分类号:S 436.634
文献标识码:A
DOI:10.3969/j.issn.0529-1542.2014.03.008
收稿日期:2013-07-10
修订日期:2013-08-31
基金项目:江西省教育厅科学技术研究项目(GJJ13269);国际合作项目(200DFA31050)
*通信作者E-mail:jxau2011@126.com
Identification of the pathogenic fungus of kiwifruit gray mold and indoor screening of fungicides
Li Cheng1, Jiang Junxi1, Zhao Shanggao2, Li Bangming2, Yu Qiang2, Tu Guiqing2
(1.College of Agronomy,Jiangxi Agricultural University,Nanchang 330045,China;2.Agricultural Bureau of Fengxin County,Fengxin 330700,China)
AbstractThe pathogen causing gray mold on kiwifruit in Fengxin County of Jiangxi Province was identified as Botrytis cinerea(anamorph Botryotinia fuckeliana)by morphological characteristics,pathogenicity test and sequence homology analysis of r DNA-ITS.The pathogenic fungus could normally grow at 5-30℃,and penetrate fruit of kiwifruit only through wound infection.Following identification of the pathogen,toxicity test of 11 fungicides to B.cinerea was carried out in the laboratory by using mycelium growth rate method,and the results showed that trifloxystrobin·tebuconazole WG,flusilazole EC,rovral SC,difenoconazole WG,tebuconazole SC and pyraclostrobin EC had higher inhibition effects to the pathogen.The EC50values were 0.118 0μg/m L,0.288 6μg/m L,0.355 2μg/m L,1.541 8μg/m L,1.760 2μg/m L and 1.778 4μg/m L,respectively.
Key wordsgray mold of kiwifruit; Botrytis cinerea; toxicity test

