茄子绒菌斑病病原菌鉴定及生物学特性研究
刘志恒, 郑 川, 黄欣阳, 唐爽爽, 李健冰, 焦 俊
(1.沈阳农业大学植物保护学院,沈阳 110866;2.辽宁省沈阳市农业技术推广站,沈阳 110034)
茄子绒菌斑病病原菌鉴定及生物学特性研究
刘志恒1*, 郑 川1, 黄欣阳2, 唐爽爽1, 李健冰1, 焦 俊1
(1.沈阳农业大学植物保护学院,沈阳 110866;2.辽宁省沈阳市农业技术推广站,沈阳 110034)
摘要本文针对辽宁省近年茄子设施栽培生产上趋重发生的叶部病害——绒菌斑病,对该病的病原菌进行了鉴定及其生物学特性研究。通过病原菌形态学鉴定,柯赫氏法则证病,并对病菌经r DNA-ITS测序,鉴定该病致病菌为真菌灰毛茄钉孢[Passalora nattrassii(Deighton)U.Braun&Crous]。病菌生物学特性测定结果表明:病菌菌丝生长以PDA+茄叶煎汁培养基为最适;适宜菌丝生长的碳源和氮源分别为可溶性淀粉和胰蛋白胨;适宜温度为25℃;最适p H为6;黑暗条件下菌丝生长较好;菌丝致死温度为59℃,10min。病菌分生孢子萌发试验结果表明,茄叶汁能明显促进其萌发,碳源以麦芽糖、氮源以硫酸铵最适于孢子萌发,孢子萌发的适宜温度为30℃;最适p H为5;光暗交替条件下萌发情况较好;分生孢子致死温度为57℃,10min。
关键词茄子绒菌斑病; 灰毛茄钉孢; 鉴定; rDNA-ITS测序; 生物学特性
茄子(Solanum melongena Linn.)是世界设施蔬菜栽培的重要作物之一。我国茄子生产在全世界栽培面积最大,总产量最高;其中设施栽培面积约100余万hm2。在辽宁,茄子是设施栽培中广泛种植的主要蔬菜作物,具有重要的经济价值。近10余年来,茄子绒菌斑病在辽宁省茄子生产上日趋严重,造成大批叶片枯死,植株早衰,严重影响产量。
茄子绒菌斑病是由真菌灰毛茄钉孢(Passalora nattrassii)引起的病害。早在1859年,Nattrass于肯尼亚的黄水茄上首次发现茄子叶霉病[1]。在我国,最早于1932年在广东省记载了茄子叶霉病的发生,其后在四川(1941年)、山西(1943年)、内蒙古(1944年)、河南(1959年)、台湾(1959年)等省区相继报道了该病危害[1]。历史上,相关专家将其病原菌鉴定为真菌黄褐孢[Fulvia fulva(Cooke)Cif.],与番茄叶霉病病菌相同[1-2]。2006年李龙生等认为,在我国发生的茄子叶霉病应称为茄子绒菌斑病,并将其病原菌订正为灰毛茄菌绒孢(Mycovellosiella nattrassii Deighton)[3]。
迄今,有关茄子绒菌斑病的发生危害和病害防治的研究报道较多,而对于病菌生物学特性的系统研究少见报道。鉴于此,本文对辽宁省茄子绒菌斑病的病原菌进行了鉴定,并经柯赫氏法则进行验证,通过病菌r DNA-ITS测序,鉴定明确了茄子绒菌斑病的致病菌为真菌灰毛茄钉孢(Passalora nattrassii)。并进一步对该病病原菌生物学特性进行了系统研究,以期为病害的深入研究及实践防控提供理论依据。
1 材料与方法
1.1 供试材料
供试病害叶片标样采自辽宁省8个市区设施栽培茄子,按常规组织分离方法,分离病菌,经纯化获得纯培养。
1.2 病害症状描述
根据茄子绒菌斑病田间危害症状特点进行描述记载。
1.3 病原菌鉴定
1.3.1 病原菌形态特征观察
刮取病原菌,显微观察,并参考《中国真菌志》[4]及《The genera of hyphomycetes》[5]描述其形态特征。同时随机测量1 000个分生孢子大小及分生孢子梗的尺度,计测自然生长的病菌分生孢子单胞、双胞、3胞及以上各类孢子所占比例。
将纯化的病菌单孢菌株移植于PDA平板,25℃恒温箱培养,观察其菌落颜色、形状以及菌丝疏密程度。产孢后随机测量1 000个分生孢子大小及分生孢子梗的尺度,计测人工培养条件下病菌分生孢子的单胞、双胞、3胞及以上各类孢子所占比例,并与自然生长的病菌孢子进行比较。
1.3.2 柯赫氏法则证病
供试茄子品种为‘西安绿茄’,选用其苗期6~8片真叶的植株进行致病性测定。病菌接种设3种处理:无伤接种、针刺接种和孢子悬浮液(无菌水配制浓度为1×107个/m L)接种。以清水接种为对照。每处理3次重复,每次重复5个叶片。在26~28℃,相对湿度85%的条件下保湿培养。观察并记录接菌植株发病情况。
1.3.3 病原菌r DNA-ITS序列分析
采用天根新型植物基因组DNA提取试剂盒提取菌株基因组DNA。采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对病原菌的基因组DNA进行PCR扩增。
反应体系25.0μL:10×PCR buffer 2.5μL,MgCl22.0μL,d NTP 1.5μL,Taq酶(5U/L)0.2μL,ITS1(10μmol/L)2.0μL,ITS4(10μmol/L)2.0μL,模板DNA 2.0μL,dd H2O 12.8μL。扩增所用试剂DL2000、dNTPs、Taq酶购于TaKaRa。
r DNA-ITS基因PCR扩增反应的条件为:94℃预变性5 min;94℃变性30 s,51℃退火40 s,72℃延伸90 s,30个循环;72℃延伸7 min,最后于4℃保存。
PCR产物经琼脂糖凝胶电泳检测后,委托上海生工生物工程技术服务有限公司进行测序,测序结果在Gen Bank数据库中进行BLAST比对分析。
1.4 生物学特性测定
1.4.1 不同条件对病菌菌丝及产孢量的影响
培养基的影响 供试培养基9种:PDA、PSA、OM、SNA、PDA+茄叶煎汁[6]、PDA+茄果煎汁、PDA+番茄叶煎汁、查氏和V8汁。将病菌单孢移入上述培养基平板中央,25℃恒温培养。40 d后采用十字交叉法测量菌落直径,利用纽鲍尔(Neubauer)血球计数板测定产孢量。进行方差分析和多重比较。每处理5次重复。
碳源的影响 以查氏培养基为基础培养基,分别将蔗糖等量替换淀粉、葡萄糖、甘露醇、麦芽糖、果糖和乳糖6种不同碳源。病菌移植方法、菌丝生长及产孢量测量方法同上,25℃恒温培养。每处理5次重复。
氮源的影响 以查氏培养基为基础培养基,分别将KNO3等量替换蛋白胨、干酪素、牛肉膏、胰蛋白胨、脲、硫酸铵和氯化铵7种不同氮源。病菌移植方法、菌丝生长及产孢量测量方法同上,25℃恒温培养。每处理5次重复。
温度的影响 将病菌单孢移入PDA培养基平板中央,分别置于4、10、15、20、25、30和35℃7个不同温度下恒温培养。每处理5次重复。菌丝生长及产孢量测量方法同上。
p H的影响 采用PDA培养基,用HCl(1 mol/L)和NaOH(1 mol/L)将其p H分别调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0计9个梯度。病菌移植方法、菌丝生长及产孢量测量方法同上,25℃恒温培养。每处理5次重复。
光照的影响 设置24 h/d光照、(12 h光照与12 h黑暗)/d光暗交替、24 h/d黑暗3种处理条件,将病菌单孢移入PDA培养基平板中央,25℃恒温培养。每处理5次重复。菌丝生长及产孢量测量方法同上。
菌丝致死温度测定 将直径5 mm的菌片置于装有10 m L无菌水的试管中,将试管置于40~60℃(间隔梯度5℃)恒温水浴锅中处理10 min(预热1 min),测得致死温度范围后,间隔1℃设置梯度,重复上述操作,确定最终致死温度。每处理5次重复。
1.4.2 病菌分生孢子萌发条件测定
不同培养液的影响 供试培养液3种:25%的茄叶汁、番茄叶汁和辣椒叶汁,将分生孢子配成浓度为10~20个/视野(10×40倍显微镜)孢悬液。采用凹载片萌发法,以无菌水作对照。经预备试验后,确定于30℃恒温保湿培养,24 h后测定孢子萌发率。每处理重复5次,每次随机计测100个孢子。
碳源的影响 供试培养液8种:1%淀粉、甘露醇、葡萄糖、果糖、蔗糖、山梨酸、乳糖和麦芽糖溶液,置于30℃条件下保湿培养。24 h后测定孢子萌发率,方法同上。
氮源的影响 供试培养液8种:1%硝酸钾、氯化铵、硫酸钾、脲、甲硫氨酸、天冬氨酸、丙氨酸和谷氨酸溶液,置于30℃条件下保湿培养。24 h后测定孢子萌发率,方法同上。
温度的影响 将分生孢子悬浮液分别置于4、10、15、20、25、30和35℃不同温度下恒温培养。24 h后测定孢子萌发率,方法同上。
p H的影响 用HCl(1 mol/L)和NaOH(1 mol/L)将分生孢子悬浮液p H调配为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0共9个梯度,30℃恒温培养。24 h后镜检孢子萌发率,方法同上。
光照的影响 将分生孢子悬浮液滴在载玻片上,分别置于24 h/d光照、24 h/d黑暗条件以及12 h/d光照12 h/d黑暗3种光照条件下培养。24 h后测定孢子萌发率,方法同上。
分生孢子致死温度测定 无菌水配制孢悬液装入试管中(5 m L/管),将试管置于35~60℃(梯度为5℃)恒温水浴锅中处理10 min(预热1 min左右),采用凹载片萌发法进行孢子萌发测定,30℃条件下保湿培养,24 h后测定孢子萌发率。测得致死温度范围后,以1℃为梯度求得准确的致死温度。
1.4.3 统计分析方法
运用SPSS17.0软件对数据进行差异显著性分析(SSR法)。
2 结果与分析
2.1 病害症状描述
通过田间调查,发现在茄子旺盛结果期,棚内处于高温高湿条件下,茄子绒菌斑病的发生率显著增加;幼苗期病害发生率较低。近年来,该病害的发生呈上升趋势。
茄子绒菌斑病主要侵染叶片。发病初期,叶片正面出现黄色褪绿斑点,后逐渐扩展形成黄色、近圆形至不规则形病斑,病斑直径一般为3~10 mm,病斑周缘具有黄色晕圈。湿度大时,病斑背面产生白色至灰白色霉状物,其后霉层颜色逐渐加深,变成黄褐色,最后成棕褐色、深褐色甚至墨绿色。条件适宜时,叶片正面也可产生霉层。严重时病叶逐渐变黄脱落(图1)。

图1 茄子绒菌斑病田间发病症状Fig.1 Field symptoms on eggplant leaves caused by Passalora nattrassii
2.2 病原菌鉴定结果
2.2.1 病原菌形态特征
在茄子寄主上自然生长的病菌,菌丝淡褐色,分隔明显。分生孢子梗褐色或深褐色,不分支或偶尔分支,直或微弯,光滑,孢子梗一侧有节状膨大。分生孢子链生并具支链,长椭圆形或短圆柱形,褐色至深褐色,表面光滑,0~7个隔膜,(8~82)μm×(2~11)μm(图2a,2b)。经分离纯化后人工单孢移植培养的病菌,菌落生长缓慢,生长速度仅为1 mm/d左右。该病菌孢子在培养皿内易于散播,形成多个大小不等的菌落。病菌在PDA培养基上于25℃单孢培养30 d后,培养基上出现直径为25~25.5 mm的圆形深绿色菌落,初期菌落正面为深绿色,随着培养时间的增长,菌落中间产生白色次生菌丝(图2c)。
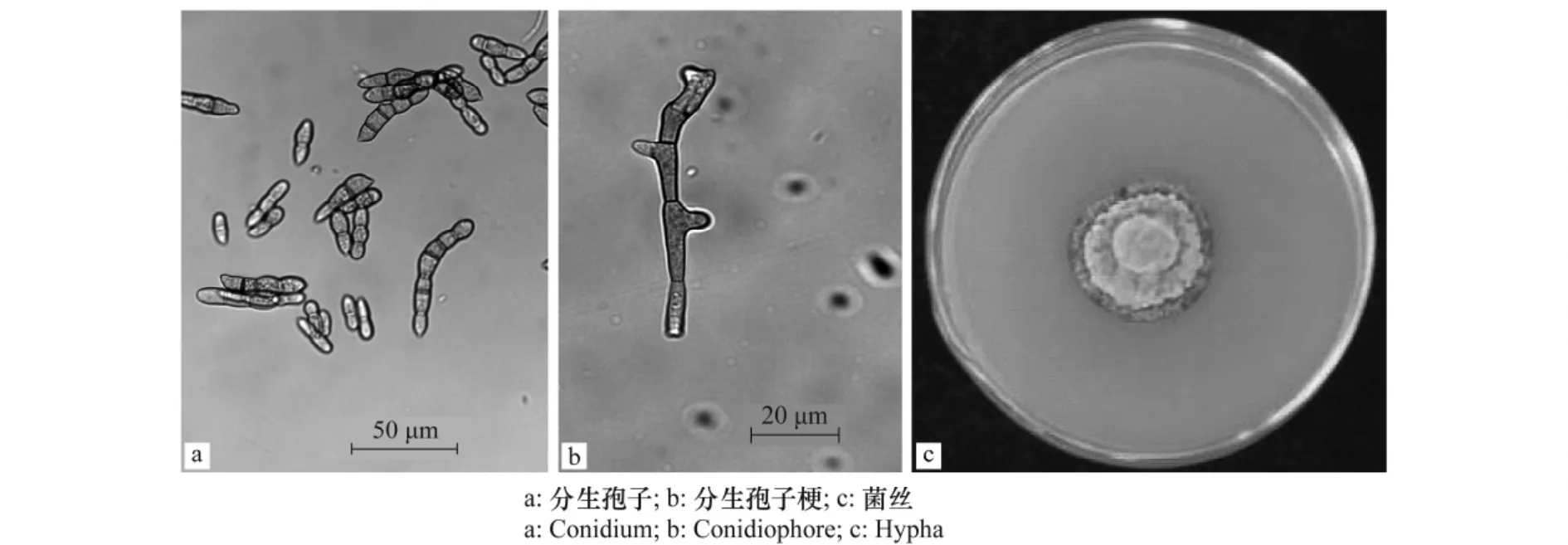
图2 茄子绒菌斑病病原菌形态Fig.2 The shape of Passalora nattrassii
病菌在茄子寄主上自然生长条件和PDA培养基上培养相比较,分生孢子大小和细胞数目及其比例大致相近,不同细胞数目孢子的比例均以2、3、4胞者为多,三者比例占90%左右;相对而言,人工培养条件下,分生孢子大小和细胞数略小于自然寄主上的测量值(表1)。
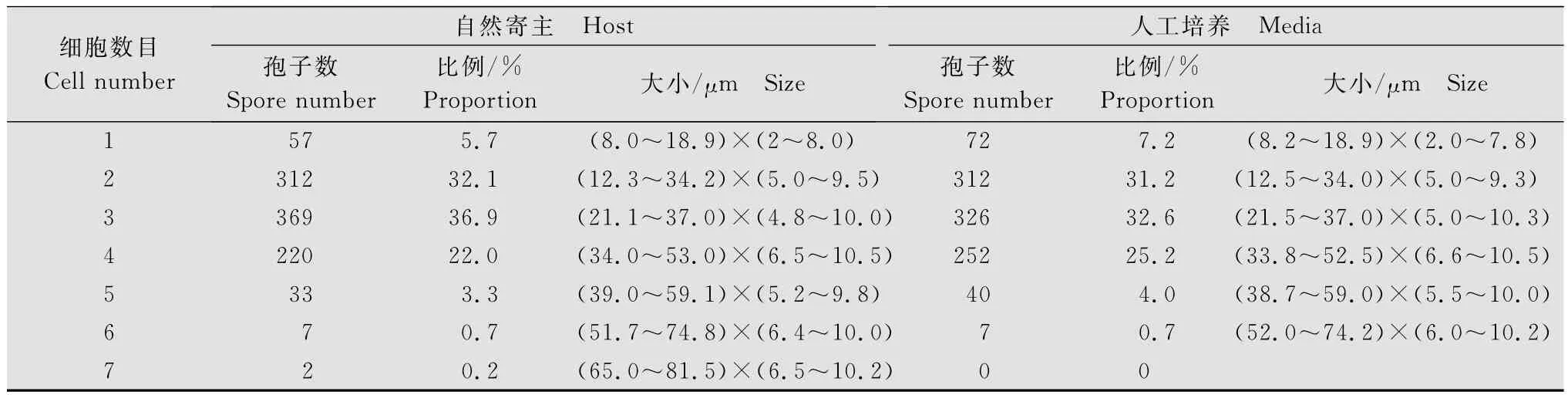
表1 茄子绒菌斑病病菌在自然寄主和培养基上孢子细胞数目和大小比较Table 1 Comparison of spore cell number and size of Passalora nattrassii on the host and the media
2.2.2 柯赫氏法则证病结果
经3种方法接种处理后,均引致了茄子植株发病,而清水对照未发病。接种20 d后叶片正面出现黄色褪绿斑点,后逐渐扩展形成黄色、不规则形病斑,症状表现与田间症状一致。试验发现,针刺接种较其他2种接种方法发病显症快。取接种发病叶片再次分离,获得了与原接种菌株相同的病原菌。证实了该菌为茄子绒菌斑病的致病菌。
2.2.3 病原菌r DNA-ITS序列分析结果
利用引物对ITS1/ITS4对菌株r DNA-ITS进行PCR扩增,扩增出一条519 bp的片段(图3a)。将测序结果上传到NCBI进行BLAST比对分析。该菌与GenBank中已登录AB531500灰毛茄钉孢菌(Passalora nattrassii)序列相似性达到99%。鉴定该菌为灰毛茄钉孢菌[P.nattrassii(Deighton)U.Braun&Crous]。
2.3 环境条件对病菌菌丝生长和产孢量的影响
2.3.1 培养基的影响
由图4可以看出,病菌菌丝在PDA+茄叶煎汁培养基中生长最快,其次为燕麦培养基,在PDA+番茄叶煎汁培养基中生长速度最慢。从菌落形态和颜色看,菌丝在燕麦、查氏和SNA培养基上相对稀薄,在PDA+茄叶煎汁、PDA+茄果煎汁、PDA和PSA培养基上生长相对缓慢,菌丝稠密且孢子形态较接近寄主上的孢子形态。该病菌在不同培养基上的产孢量存在一定差异,其中在PDA+茄叶煎汁、PDA+茄果煎汁和V8汁植物源的培养基中产孢量较多,而在燕麦和SNA培养基中产孢量较少。

图3 病原菌的ITS序列PCR扩增产物电泳图Fig.3 Electrophoresis of PCR products of Passalora nattrassii DNA
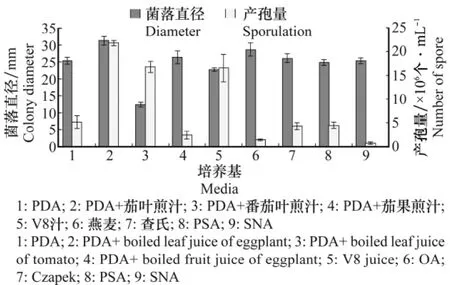
图4 不同培养基对病菌菌丝生长和产孢量的影响Fig.4 Effects of different media on mycelium growth and sporulation of P.nattrassii
2.3.2 碳源对菌丝生长的影响
病菌可以利用多种形式的碳源,在可溶性淀粉中菌丝生长最快,形成的菌落平辅,菌丝层薄;其次为甘露醇;在乳糖中生长最慢,仅为5.2 mm。此外在以淀粉为碳源的培养基上病菌产孢量最大,在以乳糖为碳源的培养基中,病菌不产孢(图5)。
2.3.3 氮源对菌丝生长的影响
病菌可以利用无机氮源和有机氮源,有机氮源更有利于菌丝扩展。在胰蛋白胨中菌丝生长最快,在氯化铵中菌丝生长最慢;病菌在以胰蛋白胨为氮源的培养基中产孢量最大,其次为蛋白胨,在氯化铵中产孢量最小。但从供试7种氮源整体利用趋势看,菌丝生长速度与产孢量没有正相关性(图6)。
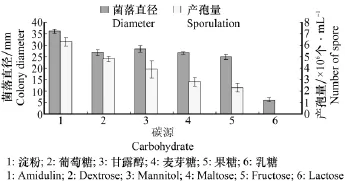
图5 不同碳源对病菌菌丝生长和产孢量的影响Fig.5 Effect of different carbohydrate on mycelium growth and sporulation of P.nattrassii

图6 不同氮源对病菌菌丝生长和产孢量的影响Fig.6 Effects of different nitrogen sources on mycelium growth and sporulation of P.nattrassii
2.3.4 温度对菌丝生长的影响
图7试验结果表明,温度对病菌菌丝生长和产孢量影响显著,菌丝在10~25℃范围内均能生长,最适宜温度为25℃。低于4℃或高于30℃病菌菌丝均不生长。病菌随着温度的升高在25℃时产孢量达到最大,低于4℃或高于30℃均不产孢。

图7 不同温度对病菌菌丝生长和产孢量的影响Fig.7 Effects of different temperatures on mycelium growth and sporulation of P.nattrassii
2.3.5 p H对菌丝生长的影响
图8试验结果表明,病菌菌丝在p H范围为3~11之间均可生长,最适p H为6;病菌在p H范围为3~10之间均可产孢,当p H为6时产孢量最大,说明偏酸性的条件有利于病菌菌丝生长及产孢。

图8 不同p H对病菌菌丝生长和产孢量的影响Fig.8 Effects of different p H values on mycelium growth and sporulation of P.nattrassii
2.3.6 光照对菌丝生长的影响
试验结果表明,菌丝生长对光照条件要求不高,在持续光照、黑暗、光暗交替条件下生长差异不大,在黑暗条件下菌丝生长及产孢情况较好。
2.3.7 菌丝致死温度测定
测定结果表明,当处理温度达59℃时,菌丝停止生长,由此确定该菌菌丝致死温度为59℃,10 min。
2.4 环境条件对分生孢子萌发的影响
2.4.1 不同培养液的影响

图9 不同培养液对病菌分生孢子萌发的影响Fig.9 Effects of different media on spore germination of P.nattrassii
由图9可以看出,3种不同培养液对病菌分生孢子的萌发都有一定的促进作用,其中茄叶汁培养液能够有效地促进孢子萌发,分生孢子的萌发率最高为55.4%。芽糖中孢子的萌发率最高,可达到40.17%;其次为葡萄糖、可溶性淀粉;在果糖、乳糖和甘露醇中萌发率较低,都低于10%,说明双糖有利于病菌分生孢子的萌发(图10)。

图10 不同碳源对病菌分生孢子萌发的影响Fig.10 Effects of different carbohydrate sources on spore germination of P.nattrassii
2.4.3 氮源的影响
病菌分生孢子可以在多种氮源中萌发,在硫酸铵中孢子的萌发率最高,可达到65.55%,其次为丙氨酸,分生孢子的萌发率为11.18%,在其他5种氮源中萌发率偏低,都低于5%。这与偏酸性的条件有利于病菌分生孢子的萌发的研究结论相吻合(图11)。
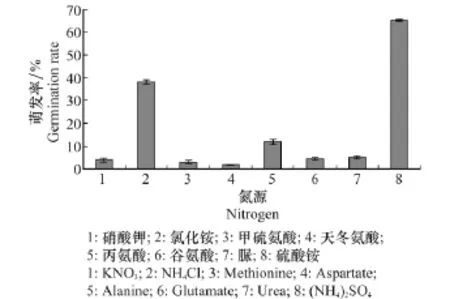
图11 不同氮源对病菌分生孢子萌发的影响Fig.11 Effects of different nitrogen sources on spore germination of P.nattrassii
2.4.4 温度的影响
图12试验结果表明,温度对病菌分生孢子萌发具有较大影响,30℃为萌发最适温度,萌发率为51.59%,在4~30℃之间,孢子萌发率随着温度的升高而增高;在30~35℃之间孢子萌发率随着温度的升高而降低。

图12 不同温度对病菌分生孢子萌发的影响Fig.12 Effects of different temperatures on spore germination of P.nattrassii
2.4.5 p H的影响
由图13可以看出,病菌分生孢子在p H范围为3~11之间均可萌发,最适p H为5,分生孢子的萌发率可达到54.05%。说明偏酸性的条件有利于病菌分生孢子的萌发。

图13 不同p H对病菌分生孢子萌发的影响Fig.13 Effects of different p H values on spore germination of P.nattrassii
2.4.6 光照的影响
光照对于病菌分生孢子萌发的影响较小,在光暗交替条件下,分生孢子萌发率较高,可达到10.36%;在黑暗条件下萌发率相对较低,仅为4.7%。表明该菌分生孢子萌发能力较弱。
2.4.7 分生孢子致死温度测定
测定结果表明,当处理温度≥57℃时,病菌分生孢子均不萌发,由此确定该菌分生孢子致死温度为57℃,10 min。
3 结论与讨论
本研究通过形态学鉴定、柯赫氏法则证病及ITS测序,最终鉴定明确辽宁省茄子绒菌斑病的致病菌为灰毛茄钉孢菌[Passalora nattrassii(Deighton)U.Braun&Crous]。
查阅文献,有关茄子绒菌斑病致病菌的归属曾有过一定变动。1972年Deighton对发生在日本高知县的茄子绒菌斑病病原菌做出鉴定,认为是由菌绒孢属(Mycovellosiella)引起的病害。在我国,有专家认为该病病菌为黄褐孢[Fulvia fulva(Cook)Cif.],与番茄叶霉病病菌相同[1-2]。2006年李龙生等对发生在我国的茄子叶霉病菌作出订正,认为病原菌应为灰毛茄菌绒孢(Mycovellosiella nattrassii Deighton)。本研究采集我国辽宁省茄子栽培地茄子绒菌斑病病原菌,经常规组织分离获得病菌纯培养,通过形态学鉴定、柯赫氏法则证病及ITS测序,并参考《中国真菌志》及《The genera of hyphomycetes》的相关描述,最终将该致病菌鉴定为灰毛茄钉孢菌(P.nattrassii)。
生物学特性研究结果表明,该菌最适生长温度为30℃,最适碳源为淀粉,最适氮源为胰蛋白胨,最适p H为6,光照条件对病菌生长影响较小,病原菌菌丝致死温度为59℃、10 min。该菌分生孢子萌发的最适条件为30℃、1%麦芽糖、1%硫酸铵、最适p H为5。病原菌分生孢子致死温度为57℃、10 min。试验研究发现,该病菌菌落生长缓慢,经单孢移植培养,菌丝生长速度仅为1 mm/d左右,结果与报道的飞机草菌绒孢菌[6]及番茄叶霉病菌[7]菌丝生长速度相似。
试验还表明,病菌分生孢子萌发需要时间较长(24 h萌发率最高为65.55%,48 h萌发率达到100%),但产孢量非常大,故适宜条件下病菌扩散蔓延较快,短时间即可对温室茄子生产造成严重危害。在茄汁培养液中能够有效促进病菌孢子萌发,茄子叶片加入培养基中能够促进病菌的生长与繁殖,由此说明原寄生的营养条件对病菌生长具有较强的促进作用。
灰毛茄钉孢菌的适宜生长范围在10~25℃,最适温度25℃,分生孢子萌发最适温度为30℃,这与温室高温高湿有利于病害迅速传播蔓延和危害发展有着直接关系。该病菌能够利用多种碳源和氮源进行生长与繁殖,所有供试碳源、氮源除乳糖外均能满足该菌生长的需要,但是菌丝生长、分生孢子萌发对营养成分的需求存在一定差异,并且菌丝生长速度与其产孢能力无正相关关系,最有利于病原菌生长的碳源为可溶性淀粉,最佳供试氮源为胰蛋白胨;最有利于孢子萌发的碳源为麦芽糖,最佳供试氮源为硫酸铵。菌丝生长和孢子萌发对于酸碱度的要求较为一致,在偏酸性条件下生长和萌发情况较好,说明偏酸性的条件利于该病的发生与危害。病菌菌丝的致死温度为59℃、10 min,分生孢子致死温度为57℃、10 min。由此认为,该病菌可能具有很强的耐热能力,是一种抗逆性很强的病菌。
本研究结果明确了茄子绒菌斑病的致病菌,为研究该病害流行规律及病害防治提供了一定的理论依据。
参考文献
[1] 李明远,严红,张涛涛,等.辽宁发现茄子叶霉病[J].植物保护,1997,23(6):45-46.
[2] 刘永.茄子叶霉病综合防治技术[J].植保技术与推广,2001,21(10):17.
[3] 李龙生,李宝聚,朱辉,等.中国茄子绒菌斑病病原菌的订正[J].菌物学报,2006,25(3):505-508.
[4] 郭英兰,刘锡琎.中国真菌志(第二十卷)[M].北京:科学出版社,2003.
[5] Keith S,Gareth M J,Walter G,et al.The genera of hyphomycetes[M].The Netherlands:CBS-KNAW Fungal Biodiversity Centre:2011:145-147,303-304,331-332.
[6] 郭光远,杨宇容,马俊,等.飞机草菌绒孢菌生物学性状研究[J].生物防治通报,1992,8(3):120-124.
[7] 顾沛雯,张军翔,徐红敏.番茄叶霉病菌生物学特性研究[J].宁夏农学院学报,2004,25(3):21-23.
[8] Yamaguchi J I,Inada M,Matsuzaki M.Environmental factors for release and dispersal of conidiospores of Mycovellosiella nattrassii Deighton,causal fungus of leaf mold of eggplant[J].Annals of the Phytopathological Society of Japan,2000,66(1):5-11.
[9] Yamaguchi J I,Inada M,Matsuzaki M.Thermal death range of conidiospores of Mycovellosiella nattrassii Deighton,the casual fungus of leaf mold on eggplant[J].Proceedings of the Association for Plant Protection of Kyushu,1999,45:27-29.
[10]Jamjan Meeboon,Iman Hidayat,Chaiwat To-anun.An annotated list of cercosporoid fungi in Northern Thailand[J].Journal of Agricultural Technology,2007,3(1):51-63.
中图分类号:S 436.411
文献标识码:A
DOI:10.3969/j.issn.0529-1542.2014.03.010
收稿日期:2013-08-09
修订日期:2013-12-16
*通信作者E-mail:lzhh1954@163.com
Pathogen identification and biological characteristics of eggplant leaf mold
Liu Zhiheng1, Zheng Chuan1, Huang Xinyang2, Tang Shuangshuang1, Li Jianbing1, Jiao Jun1
(1.College of Plant Protection,Shenyang Agricultural University,Shenyang 110866,China;2.Shenyang Agricultural Technology Promotion Station,Liaoning 110034,China)
AbstractThe identification and biological characteristics of eggplant leaf mold caused by Passalora nattrassii was studied.Pathogen identification was conducted according to Koch’s postulates,morphology and molecular method. The results showed that the pathogen of eggplant leaf mold was Passalora nattrassii.The biological characteristics test showed that the optimal temperature for growth was 25℃and the optimal p H was 7.The best medium was PDA added with boiled leaf juice of eggplant.The mycelia grew best in soluble starch as carbon source and in peptone as nitrogen source.The mycelia grew better in darkness,and the lethal temperature was 59℃for 10min. The fresh leaf juice of eggplant could significantly promote the rate of conidia germination.The optimal temperature for conidia germination was 30℃and the optimal p H was 5.The conidia germinated best in maltose as carbon source and in ammonium sulfate as nitrogen source.The conidia germinated better under conditions of alternating light and dark,and the lethal temperature was 57℃for 10min.
Key wordseggplant leaf mold; Passalora nattrassii; pathogen identification; r DNA-ITS; biological characteristics

