肉鸡源弯曲菌的分离、多重PCR鉴定及其耐药性分析
朱冬梅,刘书亮,2,彭 珍,赖海梅,韩新锋,2
弯曲菌,尤其是空肠弯曲菌(Campylobacterjejuni)和结肠弯曲菌(Campylobactercoli)是引起人类急性细菌性胃肠炎最常见的原因之一[1],主要导致人急性胃肠炎,并可能进一步引发格林-巴利综合征(Guillain-Barré)、急性神经肌肉瘫痪及反应性关节炎等疾病。其广泛分布在各种温血动物体内,其中以家禽、家畜和野禽的带菌量最多,人主要通过食用被其污染的食物及其制品和水源患病,其感染率已经超过了沙门氏菌、志贺氏菌和大肠杆菌O157∶H7[2],对公共卫生安全构成严重威胁。由于弯曲菌的培养条件苛刻、生化鉴定方法操作繁琐、耗时长,因此建立弯曲菌准确、快速的检测方法尤为重要。近年来,PCR方法因其快速、灵敏度高、特异性强等优点广泛应用于细菌鉴定中,尤其是多重PCR技术在食源性致病菌的检验和鉴定上已得到较好应用[3]。
随着抗菌药在食品动物养殖过程中的大量使用,弯曲菌的耐药性逐渐增强[4],且其耐药性可通过食物链传播到人群[5-6],对弯曲菌感染的治疗难度加大。目前,国内外主要针对空肠弯曲菌的耐药性做了较多研究,很少同时针对空肠、结肠弯曲菌及其他弯曲菌的耐药性进行分析,尤其在肉鸡屠宰过程中,弯曲菌的污染和耐药性方面尚少见报道。
因此,本研究旨在分析肉鸡屠宰加工过程中弯曲菌的污染及其耐药性情况,为弯曲菌的分离鉴定提供方法参考,同时,为肉鸡屠宰加工企业和相关机构防制弯曲菌污染及其耐药性安全评价提供基础数据。
1 材料与方法
1.1材料
1.1.1样品 在四川某肉鸡屠宰加工厂,用无菌剪刀剪取鸡盲肠2~4 cm,置于保鲜袋中;用无菌棉签擦拭净膛后肉鸡胴体表面、分割后鸡肉表面,并置于5 mL増菌液中;所有样品置于低温冰盒中4 h内运回实验室。该屠宰场的肉鸡均为该企业自育的优质白羽肉鸡,采用网上养殖的方式,饲养日龄35-42 d出栏后,送屠宰场统一屠宰。
1.1.2菌株 空肠弯曲菌(Campylobcrterjejuni)ATCC33560、结肠弯曲菌(Campylobcrtercoli)ATCC33559、大肠杆菌(Escherichiacoli)ATCC25922、金黄色葡萄球菌(Staphylococcusaureus)ATCC29213由课题组提供。
1.1.3培养基 改良Skirrow氏琼脂基础、CCDA琼脂基础、Bolton肉汤、布氏肉汤、哥伦比亚血琼脂基础、M-H培养基、营养琼脂购自青岛海博生物技术有限公司;标准新生级牛血清、脱纤维羊血购自成都微克生物技术有限公司。
1.1.4主要试剂 过氧化氢、四甲基对苯二胺盐酸盐为国产分析纯试剂;Bio West琼脂糖购自成都微克生物技术有限公司;DL 2000 DNA Marker、2× long Taq PCR MasterMix、GoldviewTM核酸染料均购自北京天根生化有限公司;其余试剂均为分析纯或生化试剂。
1.1.5抗生素 氨基糖苷类:庆大霉素(gentamicin, GEN)、链霉素(streptomycin, STR);四环素类:四环素(tetracycline, TET);氯霉素类:氟苯尼考(florfenicol, FLO);喹诺酮类:环丙沙星(ciprofloxacin, CIP);左氧氟沙星(levofloxacin,LEV);大环内酯类:红霉素(erythromycin,EM);林可胺类:克林霉素(clindamycin,CLI)。以上药物均为原粉,由课题组提供。头孢哌酮、万古霉素、三甲氧苄氨嘧啶乳酸盐、多粘菌素B均购自成都奥克生物技术有限公司。
1.1.6主要仪器 BSC-1300ⅡA2型生物安全柜(苏州安泰空气技术有限公司);DHP-9162恒温培养箱(上海一恒科技有限公司);3111二氧化碳培养箱(Thermo公司);SORVALL离心机(美国科俊仪器有限公司);Milli-Q超纯水系统(Millipore公司);C1000 Thermal Cycler PCR仪(Bio-RAD);PowerPac Basic电泳仪(Bio-RAD);水平电泳槽(Bio-RAD);凝胶成像系统(Bio-RAD)等。
1.2方法
1.2.1菌株的分离 用棉签蘸取少许粪样,划线于Skirrow血平板上,42 ℃微需氧条件(5% O2、10% CO2、85% N2)下培养48 h;取0.5 mL样品増菌液加入含5%脱纤维绵羊血的9.5 mL新鲜増菌液中,42℃微需氧増菌48 h后,划线Skirrow血平板;挑取符合弯曲菌典型形态的菌落划线于CCDA平板上,培养48 h后,在平板上挑取灰色、扁平、像水珠的菌落划线于哥伦比亚血平板上进行纯化培养。
1.2.2菌株的生化初步鉴定 对分离菌株进行革兰氏镜检,并按照GB/T 4789.9-2008方法对分离菌株进行氧化酶实验和过氧化氢酶实验。
1.2.3菌株的三重PCR鉴定
1.2.3.1PCR引物设计 参考Denis M等[7]的报道,针对弯曲菌属16SrRNA基因的引物(16S-F和16S-R)和结肠弯曲杆菌CeuE基因的引物(CeuE-F和CeuE-R)合成2对引物;根据GenBank公布的空肠弯曲杆菌HipO基因序列,设计一对引物(HipO-F和HipO-R),由(大连)宝生物公司合成。

表1 靶基因名称、引物序列及扩增产物大小
1.2.3.2PCR模板的制备 将纯化培养后的菌种接种于布氏肉汤中,42 ℃微需氧培养48 h,离心收集菌体,采用ISABEL M[8]等的方法提取细菌的DNA。
1.2.3.3PCR扩增 根据预试验结果,设置三对引物浓度比例为16SrRNA:HipO:CeuE=4∶2∶1,PCR反应体系为25 μL,其中包括2× long Taq PCR MasterMix 12.5 μL ,模板1 μL,16SrRNA、HipO、CeuE基因上下游引物的终浓度分别为0.8 μmol/L、0.4 μmol/L 、0.2 μmol/L,补双蒸水至终体积25 μL。PCR循环参数:95 ℃,预变性10 min;95 ℃,30 s,50 ℃,30 s,72 ℃,60 s,35个循环;72 ℃,延伸10 min。PCR产物于1.5%的琼脂糖(0.5×TBE)凝胶电泳后,观察并成像。
1.2.3.4三重PCR特异性实验 取空肠弯曲菌ATCC33560、结肠弯曲菌ATCC33559、大肠杆菌ATCC25922的DNA,同时设计不加模版、只加单侧引物两组对照,进行三重PCR引物特异性试验。
1.2.3.5扩增产物测序鉴定 对空肠弯曲菌标准菌株ATCC33560及随机选取的空肠弯曲菌阳性菌株12-JF97的16S rRNA、HipO基因以及结肠弯曲菌标准菌株ATCC33559及随机选取的空肠弯曲菌阳性菌株13-JF74的CeuE扩增片段进行胶回收后由invitrogen公司克隆测序,并进行序列分析。
1.2.3.6弯曲菌分离率的统计 经鉴定为弯曲菌阳性的菌株,采用终浓度20%的甘油,-80℃冻藏。经上述分离鉴定出弯曲菌的样品为阳性样品,从每一份阳性样品中获得并保存一株弯曲菌菌株。分离率计算如下:分离率=(弯曲菌分离阳性样品数/样品总数)×100%。
1.2.4药敏试验 采用美国临床和实验室标准化研究所(CLSI)推荐的琼脂稀释法,对弯曲菌分离株进行8种临床常用抗生素的MIC值测定,以空肠弯曲菌ATCC33560为质控菌株,按照CLSI标准[9]和文献[10-11]进行操作和结果判断。

表2 弯曲菌的药敏试验判定标准
2 结 果
2.1分离纯化 在哥伦比亚血培养基上挑取不溶血、扁平、灰色、半透明、有时沿接种线向外扩散生长的菌落,在CCDA培养基上为有光泽、灰白、湿润的菌落。经涂片作革兰氏染色镜检为G—菌,如小逗点状,两菌体的末端相连时,呈S形、海鸥形或螺旋状。
2.2生化初步鉴定 具备以下特征:镜检符合弯曲菌形态、氧化酶试验阳性、过氧化氢酶试验阳性、可在血平板上生长而营养琼脂平板不生长,可初步鉴定为弯曲菌。据此从651份样品中,分离纯化得到333株弯曲菌疑似菌株。
2.3PCR引物特异性实验结果 对所设计的三对引物进行特异性验证,结果如图1所示,空肠弯曲菌ATCC33560在857 bp和600 bp处,分别获得预期的两条条带,结肠弯曲菌ATCC33559在857 bp和462 bp处,分别获得预期的两条条带,当空肠弯曲菌和结肠弯曲菌DNA混合时,能获得预期的三条条带,其余对照均未扩增出片段,说明所设计的两对引物特异性可靠。

图1弯曲菌多重PCR特异性验证电泳图
Fig.1ElectrophoresisofspecificitytestofmultiplexPCR
M: DL2000 DNA marker; 1:E.coliATCC25922; 2: No template; 3: No primer; 4:Campylobactercoli; 5:Campylobacterjejuni; 6:CampylobactercoliandCampylobacterjejuni.
2.4扩增产物基因序列分析 以空肠弯曲菌ATCC33560、结肠弯曲菌ATCC33559的DNA为模板,扩增的16SrRNA、HipO、CeuE基因PCR产物纯化后克隆测序分别得到长约为857 bp、600 bp和462 bp的片段,与设计大小相符,测得序列已在NCBI注册,登录号分别为KF541294、KF541296和KF541298;采用BLAST和DNASTAR MegAlign进行基因比对分析,ATCC33560的16SrRNA(KF541294)与弯曲菌登录号JX912519.1、GQ167678.1、 KC197219.1等的16SrRNA基因序列有97.9%~98.2%的同源性; ATCC33560的HipO(KF541296)基因与空肠弯曲菌登录号FJ655194.1、FJ654193.1、AY168302.1等的马尿酸钠酶相应基因序列有99.0%~99.5%的同源性;ATCC33559的CeuE(KF541298)基因与结肠弯曲菌登录号FJ946065.1、X88849.1的基因序列均有98.7%~99.3%的同源性,进一步表明该方法正确和特异。
2.5三重PCR鉴定方法应用 采用建立的三重PCR方法,对分离的疑似弯曲菌进行PCR鉴定(图2),并随机挑取菌株号为12-JF97的的16SrRNA和HipO基因以及13-JF74的CeuE基因产物进行序列分析,结果表明,12-JF97的16SrRNA(KF541293)基因序列与本实验ATCC33560的16SrRNA同源性为99.6%,12-JF97的HipO(KF541295)基因序列与本实验ATCC33560的HipO同源性为100%,13-JF74的CeuE(KF541297)基因序列与本实验ATCC33559的CeuE同源性为100%,表明被鉴定的阳性菌株结果正确。利用该方法,从333株疑似弯曲菌中,鉴定出空肠弯曲菌160株、结肠弯曲菌130株,其他弯曲菌11株,弯曲菌总分离率为46.24%,其中空肠弯曲菌和结肠弯曲菌的分离率分别为24.58%(160/651)、19.97%(130/651);屠宰前、屠宰过程中及屠宰后弯曲菌的分离率分别为56.10%、31.00%、17.00%,其中空肠弯曲菌在三个环节中的分离率分别为34.59%、4.00%、0,结肠弯曲菌在屠宰前、中、后3个环节中的分离率分别为19.29%、26.00%、17.00%。
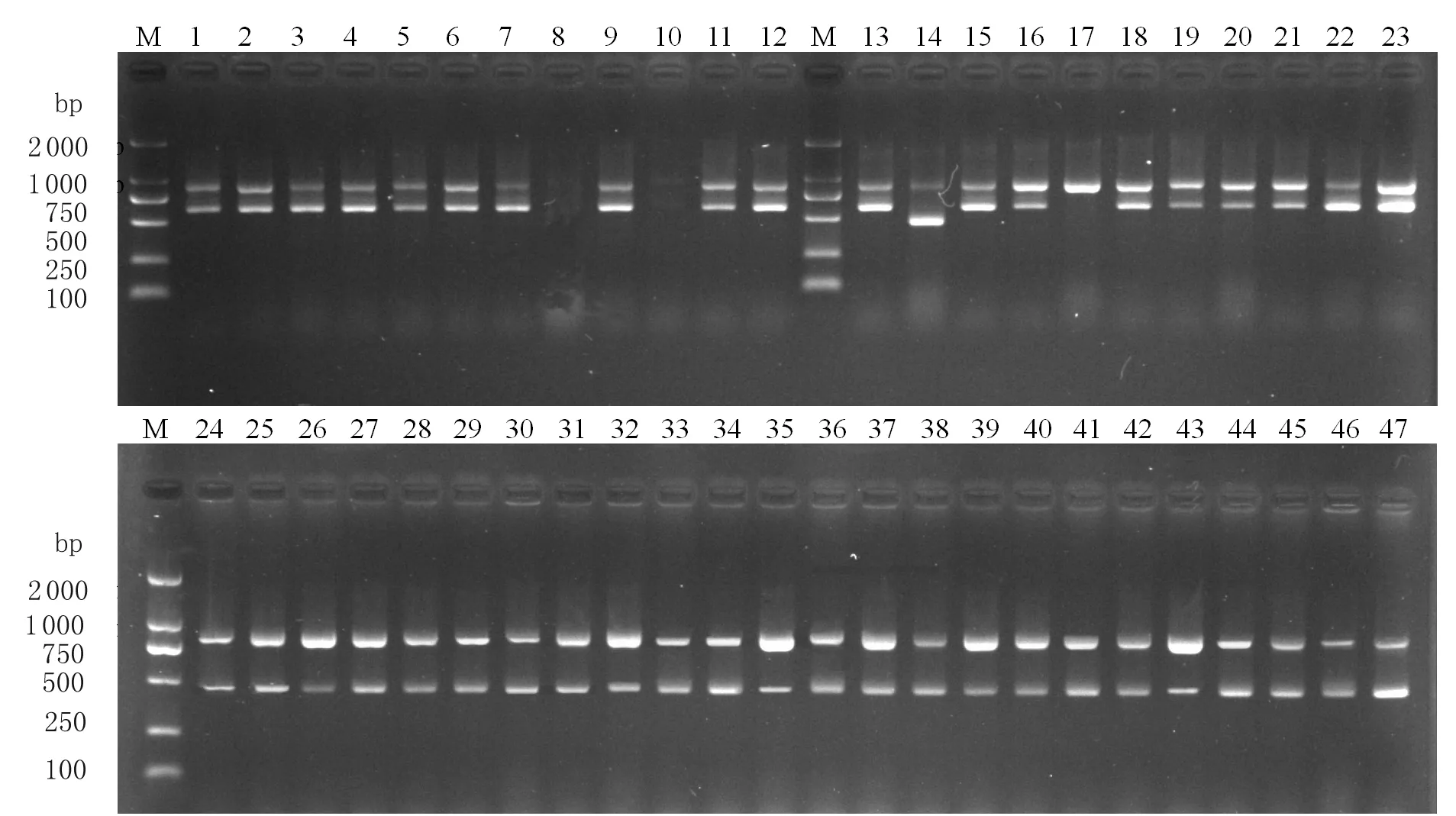
图2部分疑似弯曲菌三重PCR产物的电泳图
Fig.2ElectrophoresisoftriplexPCRamplifiedproductsfrompartisolatedCampylobacter
M: DL2000 DNA marker; 1-47: Part of samples
2.6弯曲菌分离菌株的耐药情况 根据CLSI(2010)标准,本研究中301株弯曲菌对8种抗生素的耐药率统计见图3。弯曲菌分离株对CIP的耐药率最高(93.02%),对TET、LEV以及CLI的耐药率较高,分别为87.71%、87.71%、80.07%,对GEN(67.11%)、EM(49.50%)、STR(31.89%)的耐药率居中,对FLO(13.29%)的耐药率较低。本研究还发现, 空肠弯曲菌和结肠弯曲菌对同一抗生素的耐药性有所不同,但均对CIP的耐药率最高,分别为88.13%、100.00%,对FLO的耐药率均较低,分别为16.25%、8.46%;实验结果表明,空肠弯曲菌对EM的耐药性较低,仅为14.38%,结肠弯曲菌对其耐药性较高,为93.85%,与相关文献[12]报道相符;总体说来,结肠弯曲菌的耐药率高于空肠弯曲菌。
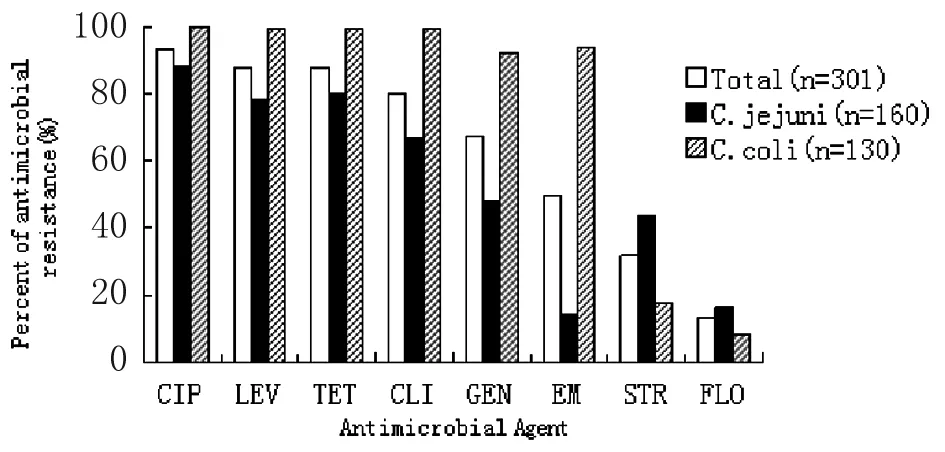
图3肉鸡源弯曲菌对不同抗生素的耐药率
Fig.3DrugresistancerateofchickensourceCampylobacterspp.againstdifferentantimicrobialagents
2.7弯曲菌的多重耐药性及耐药谱 肉鸡屠宰过程中分离的301株弯曲菌对8种抗生素产生了52种耐药谱,耐药谱CIP LEV GEN TET CLI EM优势明显,占所有菌株的33.89%(102/301);CIP LEV GEN STR TET CLI EM 和CIP LEV TET CLI均为占8.31%(25/301);CIP LEV TET I占6.98%(21/301)。屠宰前,鸡盲肠中分离的弯曲菌共产生了52种耐药谱、屠宰环节及屠宰后成品鸡肉中弯曲菌的耐药谱分别为8种、2种,从屠宰上游环节到下游环节,弯曲菌耐药谱有明显缩小的趋势,且其优势耐药谱均为CIP LEV GEN TET CLI EM,分别占分离株的26.88%(68/253)、64.52%(20/31)、82.35%(14/17)。
本研究结果显示,弯曲菌分离株对8种抗生素产生不同程度的耐药性,多重耐药(耐受三种及其以上抗生素)率为93.69%(282/301),耐6种药物的菌株最多,为42.19%(127/301),耐3种、4种、7种药物的菌株较多,分别为12.96%(39/301)、15.28%(46/301)、11.63%(35/301)(图4),5重耐药菌株占所有菌株的9.63%(29/301),有6株(1.99%)对8种抗生素具有耐药性。其中空肠弯曲菌和结肠弯曲菌多重耐药率分别为91.25%(146/160)、99.23%(129/130),其余弯曲菌的多重耐药率为63.64%(7/11);其中,空肠弯曲菌主要集中在3、4、5、6重耐药,为12.64%、13.95%、7.97%、9.30%,结肠弯曲菌主要集中在6重和7重耐药,为32.23%、7.97%。

图4肉鸡源弯曲菌的多重耐药分布情况
Fig.4Multi-antimicrobialresistancedistributionofchickensourceCampylobacterspp.
3 讨 论
3.1弯曲菌为微需氧菌,对营养和培养条件要求比较苛刻,且很容易进入VBNC(Viable but Nonculturable) 状态,无法继续用常规培养方法检测,但这些细胞仍然是“活”的,通过环境或食物链进入动物或人体[13],对食品安全构成严重威胁。因此,在空肠弯曲菌和结肠弯曲菌的分离过程中,应当注意样品的保存和运输,保证其生长所需要的微需氧环境;且可以通过在选择性培养基中添加抗生素(如万古霉素、乳酸甲氧苄啶、多粘菌素B等),以提高其分离率。
3.2弯曲菌培养周期长、生化鉴定较为繁琐,且检测结果常常不典型,特别是空肠弯曲菌和结肠弯曲菌较难通过常规生化鉴定方法区别,其差别仅在于是否分解马脲酸。由于PCR技术特异性强、灵敏度高、操作简单等优点,常用于细菌的鉴定中。HipO(马脲酸酶基因)基因为空肠弯曲菌(包括空肠亚种和德莱亚种)所特有,陈荀[14]等应用16S rRNA和HipO基因从183份样品中鉴定了21株空肠弯曲杆菌;Huo-Shu H等[15]针对空肠弯曲菌和结肠弯曲菌ceuE基因,设计两对引物,建立了检测了空肠、结肠弯曲菌的二重PCR方法,可以扩增两条大小不一的特异性片段,能有效的区分空肠弯曲菌和结肠弯曲菌。因此,本文针对弯曲菌属的16S rRNA、空肠弯曲菌的HipO和结肠弯曲菌的CeuE基因设计引物,通过三重PCR的方法对空肠弯曲菌和结肠弯曲菌的鉴定,特异性强,操作较为简单,检测时间短,能特异性的鉴定空肠弯曲菌和结肠弯曲菌,进一步表明多重PCR方法可以用于常规实验室和临床弯曲菌的检测中。
3.3本实验应用GB/T4789.9-2008中的增菌培养、选择性平板分离、弯曲菌属初步鉴定及建立的空肠弯曲菌和结肠弯曲菌的三重PCR鉴定的检测方法,从333株弯曲菌疑似菌株中,准确鉴定出301株弯曲菌,其中,空肠弯曲菌160株、结肠弯曲菌130株,其他弯曲菌11株,弯曲菌总分离率为46.24%,空肠弯曲菌和结肠弯曲菌的占弯曲菌分离株的96.35%,与Debretsion A(77.0%)[16]、Kiseon Han(37.7%)[17]、Kovalenko K(92.5%)[18]等的报道有差异,可能是不同地区弯曲菌的污染情况不一;娜仁高娃[19]等建立了一套同时检测空肠和结肠弯曲菌的三重PCR方法,并利用该方法,分析了鸡粪中弯曲菌的污染情况,其发现鸡粪中空肠弯曲菌和结肠弯曲菌的污染率为33.7%,低于本实验结果,说明该地区鸡粪中弯曲杆菌的污染情况较为严重,同时说明本实验建立的方法能够有效的提高鸡粪中弯曲菌的分离率。
3.4本实验中空肠、结肠弯曲菌占弯曲菌阳性菌株的96.35%,与文献报道一致[20]。结肠弯曲菌占弯曲菌阳性菌株的43.19%,高于瞿伟华[21](24.21%)、杨毓环[22](27.67%)、娜仁高娃(20.31%)等的报道,但与Zhao CW(41.30%)等人的结果相似,说明肉鸡屠宰中,弯曲菌污染主要集中在空肠弯曲菌和结肠弯曲菌,应引起重视。实验结果表明,在肉鸡屠宰过程中,屠宰前、屠宰过程中及屠宰后弯曲菌的分离率分别为56.10%、31.00%、17.00%,说明从屠宰上游环节到下游环节,弯曲菌的污染可能存在传播趋势,尚需进一步采用PFGE进行溯源分析。
3.5药敏试验结果表明弯曲菌的耐药情况较严重,与国内外有关弯曲菌耐药情况的报道较为相近[23-26]。本实验结肠弯曲菌分离株对四环素的耐药率为99.23%,与Qin SS[23]等的实验结果(95%)较为一致,但明显高于许紫建[24]的研究(50.79%);本实验弯曲菌分离株对红霉素的耐药率(49.50%),与Luangtongkum T[25](80%)的报道差异较大,但与Sato k[26]的结果(45%)较为一致,可能是菌株来源地区和来源样品不同,以及国内外对抗菌药在食品动物中的使用标准不一,导致弯曲菌的耐药性有所差异。
尽管弯曲菌的流行已引起各国关注,但是由于其爆发少、致死率低、且其培养条件苛刻,很多国家尚未建立起对弯曲菌的监测系统,因此本研究建立了实用的检测方法,为相关部门分析弯曲菌的流行提供了参考,并为动物性食品源弯曲菌污染的防制提供了基础数据。
参考文献:
[1]Wataru Y, Masumi T, Masanori I, et al. Development and evaluation of a loop-mediated isothermal amplification assay for rapid and simple detection ofCampylobacterjejuniandCampylobactercoli[J]. J Med Microbiol, 2008, 57(4): 444-451. DOI:10.1099/jmm.0.47688-0
[2]Alfredson DA, Korolik V. Antibiotic resistance and resistance mechanisms inCampylobacterjejuniandCampylobactercoli[J]. FEMS Microbiol Lett, 2007, 277(2): 123-132. DOI: 10.1111/j.1574-6968.2007.00935.x
[3]Shao BY, Chen B, Tang MY, et al. Development of multiplex PCR detection nethod forSalmonella[J]. Food Sci, 2007, 28(10): 489-492. (in Chinese)
邵碧英, 陈彬, 汤敏英, 等. 沙门氏菌多重PCR检测方法的建立[J]. 食品科学, 2007, 28(10): 489-492.
[4]Mozina SS, Kurincic M, Klancnik A, et al.Campylobacterand its multi-resistance in the food chain[J]. Trends Food Sci Technol, 2010, 22(2-3): 91-98. DOI: 10.1016/j.tifs.2010.09.003
[5]Mukhopadhyaya BB, Hishya SK. Incidence of colibacillosis in chicks in some poultry pockets of west Bengal[J]. Indian J Poul Sci, 1992, 27(2): 103-107.
[6]Ma HX, Deng XM, Ouyang HS. Research progress in molecular mechanisms of multiple drug-resistant bacteria[J]. World Not Antibiot, 2002, 23(3): 102-106. DOI:10.3969/j.issn.1001-8751.2002.03.002(in Chinese)
马红霞,邓旭明, 欧阳红生. 细菌多重耐药分子机制的研究进展[J].国外医药抗生素分册, 2002, 23(3): 102-106.
[7]Denis M, Soumet C, Rivoal K, et al. Development of a m-PCR assay for simultaneous identification ofCampylobacterjejuniandC.coli[J]. Lett Appl Microbiol, 1999, 29: 406-410. DOI:10.1046/j.1472-765X.1999.00658.x
[8]Isabel M, Susana AS, Elsa J, et al. Comparative study of DNA extraction methods for soybean derived food products[J]. Food Ctrl, 2008, 19(12): 1183-1190. DOI: 10.1046/j.1365-2672.2001.01380.x
[9]Clinical and Laboratory Standars Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twentith Informational Supplement[S]. M100-S20. 2010.
[10]Chen X, Naren GW, Wu CM, et al. Prevalence and antimicrobial resistance ofCampylobacterisolates in broilers from China[J]. Vet Microbiol, 2010, 144(1-2): 133-139. DOI: 10.1016/j.vetmic.2009.12.035
[11]Lehtopolku M, Nakari UM, Kotilainen P, et al. Antimicrobial susceptibilities of multidrug-resistantCampylobacterjejuniandC.colistrains:invitroactivities of 20 antimicrobial agents[J]. Antimicrob Agents Chemother, 2010, 54(3): 1232-1236. DOI: 10.1128/AAC.00898-09
[12]Xue F, Huang JL, Jiang Y, et al. Advance in antimicrobial resistance ofCampylobacter[J]. Anim Husbandry Vet Med, 2009, 41(1): 97-100. (in Chinese)
薛峰, 黄金林, 蒋原, 等. 弯曲菌耐药性的研究进展[J]. 畜牧与兽医, 2009, 41(1): 97-100.
[13]Castillo A, Escartin EF. Survival ofCampylobacterjejunion sliced watermelon and papaya[J]. Food Prot, 1994, 57: 166-1681.
[14]Chen X, Zhang XL, Liu SL. Development and application of multiplex PCR assay for the detection ofCampylobacterjejuniin animal origin food[J]. Food Ferment Industries, 2011, 37(2): 155-159. (in Chinese)
陈荀, 张晓利, 刘书亮. 动物性食品源空肠弯曲杆菌二重PCR检测方法的建立及应用[J]. 食品与发酵工业, 2011, 37(2): 155-159.
[15]Huo-Shu H, Sethsabrtr O, Nirdnoy W, et al. Development of a ceuE E-based multiplex polymerase chain reaction assay for direct detection and differentiation of Campylobacter jejuni andCampylobactercoliin Thailand[J]. Diagnositic Microbiol Inf Dis, 2004, 40: 11-19. DOI: 10.1016/S0732-8893(01)00251-6
[16]Aradom D, Tsegaye H, Saul W. Real-time PCR assay for rapid detection and quantification ofCampylobacterjejunion chicken rinses from poultry processing plant[J]. Mol Cell Probes, 2007, 21: 177-181. DOI: 10.1016/j.mcp.2006.10.006
[17]Kiseon H, Sung SJ, Euiyoung C, et al. Prevalence, genetic diversity and antibiotic resistance patterns ofCampylobacterjejunifrom retail raw chickens in Korea[J]. Int J Food Microbiol, 2007, 114(1): 50-59. DOI: 10.1016/j.ijfoodmicro.2006.10.042
[18]Kovalenko K, Roasto M, Liepins E, et al. High occurrence ofCampylobacterspp. in Latvian broiler chicken production[J]. Food Ctrl, 2012, 29(1): 188-191. DOI: 10.1111/j.1863-2378.2008.01176.x
[19]Na R, Chen X, Wu CM. Isolation, multiple PCR identificationofCampylobacterjejuniandCampylobactercolifrom chicken[J]. Chin J Vet Drug, 2010, 1(46): 38-39. (in Chinese)
娜仁高娃, 陈霞, 吴聪明. 鸡源空肠弯曲菌和结肠弯曲菌的临床分离及多重PCR鉴定[J]. 中国兽医杂志, 2010, 1(46): 38-39.
[20]Tanxe RV. Epidemiology ofCampylobacterjejuniinfections in the United States and other industrialized nations[A]. Washington: American Society for Microbiology, 1992, 9-12.
[21]Zhai WH, Jiao Y, Huang JL, et al. Contaminating status and research advances ofCampylobacterin poultry meat[J]. Progr Vet Med, 2010, 31(S): 180-184. DOI:10.3969/j.issn.1007-5038.2010.z1.046(in Chinese)
瞿伟华, 焦杨, 黄金林, 等. 禽肉中弯曲菌污染现状和防控措施研究进展[J]. 动物医学进展, 2010, 31(S): 180-184.
[22]Yang YH, Ma QF, Chen WW, et al. Surveillance and analysis on food contamination byC.jejuni andC.coliin Fujian Province from 2003 to 2005[J]. Chin J Food Hyg, 2007, 1(19): 15-18. (in Chinese)
杨毓环, 马群飞, 陈伟伟, 等. 福建省2003-2005年食品中空肠和结肠弯曲菌的监测与分析[J]. 中国食品卫生杂志, 2007, 1(19): 15-18.
[23]Qin SS, Wu CM, Wang Y, et al. Antimicrobial resistance inCampylobactercoliisolated from pigs in two provinces of China[J]. Int J Food Microbio, 2011, 146(1): 94-98. DOI:10.1016/j.ijfoodmicro.2011.01.035
[24]Xu ZJ, Yang B, Qin XJ, et al. Isolation and antimicrobial susceptibility ofCampylobacterin pig[J]. Chin J Zoonoses, 2013, 29(3): 237-241. DOI: 10.3969/cjz.j.issn.1002-2694.2013.03.006 (in Chinese)
许紫建, 杨兵, 覃湘婕, 等. 猪源弯曲菌的分离鉴定及耐药性分析[J]. 中国人兽共患病学报, 2013, 29(3): 237-241.
[25]Luangtongkum T, Morishita TY, Ison AJ, et al. Effect of conventional and organic production practices on the prevalence and antimicrobial resistance ofCampylobacterspp. in poultry[J]. Appl Environ Microbiol, 2006, 72(5): 3600-3607. DOI:10.1128/AEM.72.5.3600-3607.2006
[26]Sato K, Bartlett PC, Kaneene JB, et al. Comparison of prevalence and antimicrobial susceptibilities ofCampylobacterspp. isolates from organic and conventional dairy herds in Wisconsin[J]. Appl Environ Microbiol, 2004, 70(3): 1442-1447. DOI: 10.1128/AEM.70.3.1442-1447.2004

