孤独症模型动物认知能力与胃肠功能发育状况的观察
张兴,李丽娜,林孟柯,宁艳哲,凌雅睿,田小珑,王茂晋,张忠
孤独症又称自闭症,是一种由于神经系统失调导致的发育障碍,其表现为不能进行正常的语言表达和社交活动,常做一些刻板和重复性的动作和行为。认知障碍是孤独症的核心症状之一,可引起严重学习、记忆障碍,同时伴有失语、失用、失认或失行等改变。值得注意的是,25%~84%的孤独症患儿有胃肠道症状,而且胃肠道症状与疾病的严重程度相关[1-6]。
最近一项研究结果显示,与正常组儿童对比,孤独症患儿便秘和挑食现象更多见[7]。这些现象提示孤独症与胃肠症状的产生可能有相同的机制。目前这方面的研究还局限于临床,实验研究较少。罕见关于孤独症模型动物胃肠功能改变的报道。笔者对孤独症大鼠发育过程中认知与胃肠功能的变化规律进行了观察,希望能为后续的机制研究奠定实验基础。
1 材料与方法
1.1 实验动物 成年健康清洁级SD大鼠(购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2012-0001),雌性,240~260 g 2只,雄性280 g 1只。于北京中医药大学科研中心实验动物饲养中心清洁级大鼠饲养室适应性饲养1周。1周后,每日下午5时,将雄性大鼠与雌性大鼠1只合笼,次日早晨7时观察饲养笼内的阴栓有无,以确定雌性大鼠是否受孕,以观察到阴栓出现为受孕第1天。雄鼠休息5 d后,与另一只雌鼠重复此操作。所孕幼鼠出生后即为实验动物。
1.2 实验材料 微量电子秤,恒温水箱,大鼠避暗穿梭箱(北京众实迪创科技发展有限责任公司,编号:201202098),旷场实验视频分析系统(荷兰Noldus公司EthoVision系统),5 mL注射器,灌胃针,活性炭(国药集团北京化学试剂公司),生理盐水,注射用丙戊酸钠。
1.3 实验方法
1.3.1 孤独症模型建立 12.5 d时对孤独症模型孕鼠进行尾静脉注射丙戊酸钠(注射用水稀释为250 g/L,600 mg/kg),其所生幼鼠为孤独症模型组;对照组孕鼠妊娠12.5 d时注射等剂量生理盐水,其所生幼鼠为对照组。
1.3.2 孤独症大鼠模型发育情况 (1)分别测量对照组、模型组幼鼠出生第7、14、21、56天的体质量情况。(2)观察生后第9、11、13天时幼鼠在25 ℃恒温箱中的游泳情况,每次1只,观察5~10 s,计分依据:0分:头和鼻子均在水下;1分:头在水上,鼻子在水下;2分:头和鼻子在水上或与水面齐,但双耳在水下;3分:水位线在双耳中间;4分:水位线在耳朵以下。测试后将幼鼠擦干放回笼内。
1.3.3 胃肠感觉和运动功能 (1)结肠疼痛阈值:参考文献[8]方法并加以改进测定结肠疼痛感觉阈值:以超薄橡胶膜制作气囊,固定于聚丙烯塑料管上,塑料管一端与气囊相通,另一端与压力计和注射器相连接。将带气囊的塑料管插至大鼠降结肠,固定。向气囊内缓慢注气直至出现腹部肌肉收缩,此时压力即为疼痛感觉压力阈值。每只大鼠重复测试5次,每两次间隔5 min,结果取均值。(2)胃肠通过时间:采用活性炭灌胃法测定首粒黑便排出时间作为胃肠道通过时间,判断胃肠运动功能。实验前禁食24 h,次日上午9:00开始用质量浓度为0.1 g/L的活性炭悬液灌胃,观察幼鼠首粒黑便的排出时间。
1.3.4 学习与记忆能力——避暗反应实验 避暗仪暗室底部铜栅通36 V、50 Hz交流电,先将幼鼠放入避暗仪反应箱中训练3 min,正式测试开始时将幼鼠背对洞口放入明室,幼鼠进入暗室则受到电击,避暗仪自动记录5 min内幼鼠进入暗室的次数,即为错误次数,和首次进入暗室的时间,即为避暗潜伏期。第1天上午9:00开始训练实验,次日上午9:00(训练实验24 h后)进行测试,记录5 min内幼鼠避暗潜伏期和错误次数。
1.3.5 自发行为与探索行为——旷场实验 小动物行为学分析系统中将旷场分析箱从左上开始,按左到右顺序以不同颜色编号为相同的25个小格,其中7、8、9、12、13、14、17、18、19为中央区域,其余为外周格,13号格为正中格。每次实验时捏住大鼠尾巴距根部2/3处轻放入13号格中,显示器中观察其3 min内活动情况,每次测定结束将动物排泄物清除干净,每只仅测定1次。实验时间结束录像分析,软件统计。
1.4 统计学方法 采用SPSS 18.0统计学软件进行数据分析,数据符合正态性分布,采用t检验;不满足正态性分布,采用非参数检验(Mann-WhitneyU检验)。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠发育状况
2.1.1 体质量情况 见表1。

表1 孤独症大鼠与正常大鼠不同时间体质量比较
注:与对照组比较,az=-2.14,P<0.05,bz=-4.12,-3.89,P<0.01。
表1数据显示,孤独症模型组大鼠体质量在各个时期的平均水平均低于对照组,其中第7、14、21天低于对照组,差异有统计学意义(P<0.05,0.01)。
2.1.2 游泳能力 见表2。
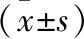
表2 幼鼠游泳能力评分
注:与对照组比较,at=-3.19,-4.42,-3.55,P<0.01。
表2数据显示,第9、11、13天,孤独症模型组游泳能力评分明显低于对照组,差异有统计学意义(P<0.01)。
2.2 胃肠感觉与运动功能
2.2.1 结肠疼痛阈值 见表3。

表3 幼鼠结肠疼痛阈值
注:与对照组比较,az=-2.41,-2.14,P<0.05,bz=-2.74,-3.23,P<0.01。
表3数据显示,孤独症模型组在第29、36、43、57天与对照组比较,差异有统计学意义(P<0.05,0.01)。对照组幼鼠结肠痛阈基本恒定,而孤独症模型组结肠痛阈低于对照组,提示孤独症幼鼠发育过程中存在胃肠感觉超敏状况。
2.2.2 胃肠通过时间 见表4。

表4 幼鼠胃肠通过时间
注:与对照组比较,az=-2.41,P<0.05,bz=-3.34,P<0.01。
表4数据显示,随着幼鼠的生长发育,对照组与孤独症模型组的胃肠通过时间均逐渐延长,孤独症模型组的胃肠通过时间除在第36天长于对照组;其余各时点均短于对照组,第43天胃肠通过时间明显短于对照组,差异有统计学意义(P<0.05,0.01)。
2.3 学习与记忆能力——避暗反应实验 见表5、6。

表5 幼鼠避暗潜伏期
注:与对照组比较,az=-3.06,-2.78,-3.04,P<0.01。

表6 幼鼠避暗错误次数次)
注:与对照组比较,az=-3.07,-3.55,-3.31,P<0.01。
表5、6数据显示,与对照组比较,孤独症模型组在初次受到伤害性刺激时,记忆形成不稳固,错误次数增多。而多次受到伤害性刺激后,记忆稳固,避暗潜伏期在第37、44、51天均长于对照组,差异有统计学意义(P<0.01)。而避暗错误次数仅在第23天高于正常对照组,第30天与对照组基本一致,而第37、44、51天均低于对照组,差异有统计学意义(P<0.01)。两项数据均显示,第58天两组比较差异无统计学意义(P>0.05)
2.4 旷场试验 孤独症模型组第29、50天运动距离少于对照组;孤独症模型组第50天穿格次数少于对照组,差异均有统计学意义(P<0.05)。见表7、8。

表7 幼鼠总运动距离
注:与对照组比较,az=-2.03,-2.14,P<0.05。
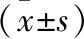
表8 幼鼠穿格次数
注:与对照组比较,az=-2.22,P<0.05。
3 讨论
本实验结果显示,孤独症模型在幼年发育过程中,其体质量增长低于对照组;运动发育和运动协调能力均低于正常水平,游泳能力的不足正说明了这一点。
很早以前,研究者就注意到孤独症患儿中存在的胃肠功能障碍[9]。也有研究者认为,伴有胃肠功能障碍的孤独症是孤独症的一个亚型。有研究结果提示,一些基因可能是孤独症和胃肠功能障碍之间的联系[10-12],但孤独症与胃肠功能障碍之间的关系仍有待于进一步探索。这方面的研究对于阐明孤独症的病因病理具有重要的意义。
目前虽然已经建立了多种孤独症动物模型,以研究孤独症的病理改变机制,但大多数研究都集中在认知障碍方面,很少有关于胃肠功能障碍的机制研究。笔者观察丙戊酸钠致孤独症幼鼠胃肠功能和认知能力的发育过程,发现该模型幼鼠体质量减轻,在出生第29天就出现胃肠功能障碍,表现为结肠痛阈降低,结肠敏感性增强,胃肠通过时间缩短或延长,胃肠运动障碍。这些与临床患儿胃肠症状相似。说明丙戊酸钠致孤独症大鼠模型可用于研究胃肠功能障碍与孤独症内在联系。
值得注意的是,避暗反应实验中,孤独症幼鼠仅在第1次实验中错误次数高于对照组,第2次实验错误次数与对照组持平,其后各次实验中,错误次数均显著少于对照组。提示孤独症动物对伤害性刺激记忆深刻,这可能是由于模型动物感觉超敏所致。而第37天之后避暗反应潜伏期延长可能与模型动物对伤害性刺激的记忆有关。
旷场实验中,对照组和孤独症模型组幼鼠运动距离随日龄增加而延长。孤独症模型组幼鼠运动距离低于对照组,提示孤独症幼鼠自发活动减少。另外,对照组和孤独症模型组幼鼠穿格次数均随日龄增加而延长,孤独症模型组幼鼠穿格次数低于对照组,提示幼鼠探索行为减少。
[1] Horvath K,Perman JA.Autistic disorder and gastrointestinal disease[J].Curr Opin Pediatr,2002,14(5):583-587.
[2] Rapin I.The autistic-spectrum disorders[J].N Engl J Med,2002,347(5):302-303.
[3] Hsiao EY. Gastrointestinal issues in autism spectrum disorder[J].Harv Rev Psychiatry,2014,22(2):104-111.
[4] Coury DL, Ashwood P, Fasano A, et al. Gastrointestinal conditions in children with autism spectrum disorder: developing a research agenda[J].Pediatrics,2012,130 Suppl 2:S160-168.
[5] Wakefield AJ,Murch SH,Anthony A,et al.Ileal-lymphoid-nodular hyperplasia,non-specific colitis,and pervasive developmental disorder in children[J].Lancet,1998,351(9103):637-641.
[6] Wakefield AJ,Anthony A,Murch SH,et al.Enterocolitis in children with developmental disorders[J].Am J Gastroenterol,2000,95(9):2285-2295.
[7] Ibrahim SH,Voigt RG,Katusic SK,et al.Incidence of gastrointestinal symptoms in children with autism:a population-based study[J].Pediatrics,2009,124(2):680-686.
[8] 杨颖,童玲,左科,等.内源性阿片肽系统在快眼动睡眠剥夺所致大鼠内脏感觉降低中的作用[J].胃肠病学,2007,12(4):218-223.
[9] Goodwin MS,Cowen MA,Goodwin TC.Malabsorption and cerebral dysfunction:a multivariate and comparative study of autistic children[J].J Autism Child Schizophr,1971,1(1):48-62.
[10] Amir RE,Van den Veyver IB,Wan M,et al.Rett syndrome is caused by mutations in X-linked MECP2,encoding methyl-CpG-binding protein 2[J].Nat Genet,1999,23(2):185-188.
[11] Motil KJ,Schultz RJ,Browning K,et al.Oropharyngeal dysfunction and gastroesophageal dysmotility are present in girls and women with Rett syndrome[J].J Pediatr Gastroenterol Nutr,1999,29(1):31-37.
[12] Campbell DB,Buie TM,Winter H,et al.Distinct genetic risk based on association of MET in families with co-occurring autism and gastrointestinal conditions[J].Pediatrics,2009,123(3):1018-1024.

