鸡肌球蛋白质的提取方法优化研究
张秋会, 赵改名, 李苗云, 田 玮, 岳喜庆, 柳艳霞, 高晓平, 魏 鑫
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.沈阳农业大学食品学院,辽宁 沈阳 110866)
随着经济的发展,高蛋白、低脂肪、低胆固醇的鸡肉制品越来越受到消费者的喜欢,但目前鸡肉制品的种类单一、深加工产品较少,而鸡肉蛋白质的功能特性研究是鸡肉制品开发的基础和关键[1,2].肌肉蛋白质不仅赋予产品特有的风味、口感和营养,还决定了制品的品质.肌球蛋白质约占肌肉蛋白质的1/3[3],在肉制品加工中起重要作用,它的凝胶特性[4~6]不仅决定了肉制品的质构品质[7],而且也对产品的保水性[8]、乳化性[9]等有很大作用.而多数相关研究集中在盐溶蛋白质凝胶的品质特性上,缺乏单一肌球蛋白质功能特性研究,关于提取方法的研究报道更少.肌球蛋白质的提取方法最早是由NAUSS等[10]提出的,其基本原理是利用肌球蛋白质的不溶于水,而溶解于中性盐溶液,在饱和(NH4)2SO4溶液中可盐析沉淀,可与肌动蛋白质结合形成肌动球蛋白等物理化学特性[3]构建的,后续的相关研究[11~15]多参考他的方法进行的,只是在缓冲溶液种类、离心速度、硫酸铵分级沉淀的饱和度以及抑制蛋白质水解和肌动球蛋白生成上有所不同.但在肌球蛋白提取过程中,离心速度、硫酸铵分级沉淀的饱和浓度以及肌动球蛋白沉淀上仍然存在不足.林丽军[16]、韩敏仪等[17]对其进行了改进,使肌球蛋白质的提取方法更加具有可操作性.本试验主要是在前人研究的基础上,借助于SDS-PAGE,针对肌球蛋白质提取过程中肌动球蛋白的沉淀次数和硫酸铵分级沉淀的饱和度条件进行优化研究,为肌球蛋白凝胶品质特性研究奠定一定的基础.
1 材料与方法
1.1试验材料
6~8周的三黄鸡;购于河南省郑州市某批发市场.
1.2化学材料
电泳试剂为进口分装产品;SDS-PAGE蛋白质相对分子质量标准为TAPARA公司的Premixed Protein Marker(broad),货号DPP530A.其他所使用的化学试剂均为分析纯,市售.
1.3试验仪器
MJ-250PP01B绞肉机,广东省美的生活电器制造有限公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限公司;WH-866漩涡涡流搅拌器,江苏省太仓市华美生化仪器厂制造;PXSJ-216 pH计,上海精科仪器有限公司;ALLLEGRA-64A高速冷冻离心机,BECKMAN COULTER;DYY-5稳压稳流电泳仪,北京市六一仪器厂;DYCZ-24 DN型电泳槽;EC3 Imaging System,Ultra-Violet Products Ltd..
1.4试验方法
1.4.1 鸡肌球蛋白的提取 健康的三黄鸡(6~8周),采用刺杀放血法放血,取下鸡胸脯肉(烫毛僵直之前),除去可视结缔组织和脂肪,称重,切碎,用绞肉机绞约2~3 min,形成肉糜.
肌球蛋白质的提取参照NAUSS等[10]及林丽军[16]的方法进行.肌球蛋白溶液于0~4 ℃贮存(至多1周),备用.
1.4.2 蛋白质浓度测定 蛋白质浓度测定采用双缩脲法[18],标准蛋白采用牛血清白蛋白进行.
1.4.3 肌球蛋白SDS-PAGE电泳 采用LAEMMLI[19]的不连续SDS-PAGE系统和郭尧君[20]、王家政等[21]的进行,分离胶质量分数为17 %,聚合胶质量分数为5 %,电泳初始电压为80 V,进入分离胶后调整电压至120 V.
电泳结束后,小心取下分离胶,室温染色过夜,再在室温下脱色,每隔3~4 h换1次脱色液,至背景无色,采用凝胶成像分析系统进行分析.
1.4.4 试验设计 采用单因素试验,分别测定了肌动球蛋白的去除次数以及硫酸铵分级沉淀中硫酸铵的饱和度对肌球蛋白质纯度的影响,试验设计见表1.

表1 试验设计因素水平表
1.5数据统计分析
利用SPSS19.0的ANOVA进行方差分析,差异显著性P<0.05.
2 结果与分析
2.1标准曲线
按照上述肌球蛋白质浓度测定方法建立标准曲线,见图1.标准曲线方程为y=0.2342x,R2=0.9997.提取的肌球蛋白质量浓度为20~40 g·L-1,提取率在1%左右.
2.2肌球蛋白质SDS-PAGE
图2是肌球蛋白SDS-PAGE图谱.从图中可以看出,上述的蛋白质电泳方法对蛋白质的分离效果良好.肌球蛋白在电泳过程中变性分解为多条亚基,参照标准marker的相对分子质量,计算所得7条亚基相对分子质量分别为174.5,43.94,36.7,31.85,25.0,18.5,16.1 kD.
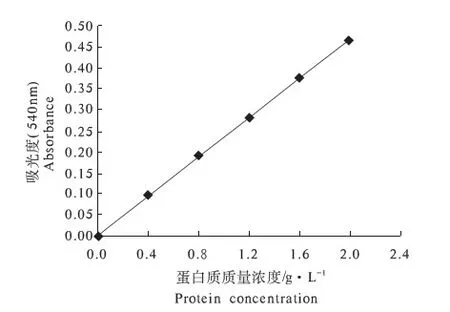
图1 标准曲线
肌球蛋白相对分子质量为470~510 kD,由2条分子量205 kD的重链和4条轻链(16,18,22,30 kD)组成[22,23],也有学者认为肌球蛋白质由1条重链和3条轻链组成[11,17,24].综合他人研究结果分析认为,肌球蛋白的两条重链没有完全分开,而且存在一定的计算误差,分子质量为174.5 kD,43.94 kD和36.7 kD的亚基条带是杂条带,可能是没有完全沉淀去除的肌动球蛋白中的肌动蛋白质亚基和肌钙蛋白[3],因此可以针对杂蛋白进行提取条件的优化研究;其他4条带(31.85,25.0,18.5,16.1 kD)为肌球蛋白质的轻链.按照2条重链和4条轻链分子质量计算,肌球蛋白亚基占亚基总量的86.44 %,因此,有待于对肌球蛋白的提取方法进行优化研究,以期提高肌球蛋白质的纯度.

S为样品蛋白,M为标准蛋白.
2.3肌动球蛋白沉淀次数对肌球蛋白质纯度的影响
肌动球蛋白是肌动蛋白与肌球蛋白结合形成的不溶于水的复合体,具有ATP酶活性,Mg2+能激活[3].因此,利用这些特性,通过在提取过程中添加Mg2+和焦磷酸钠来激活和分离肌球蛋白和肌动蛋白,最终来提高肌球蛋白的纯度.通过增加肌动球蛋白沉淀次数来提高肌球蛋白质纯度的优化研究尚未见相关报道.肌动球蛋白沉淀次数对肌球蛋白纯度的影响见表2.
由表2可知,随着纯化次数的增加提高,肌球蛋白纯度显著提高.因此,随着肌动球蛋白的沉淀次数增加可以显著提高肌球蛋白质的纯度,但随着沉淀次数的增多,肌球蛋白质的提取率会有所下降,蛋白质溶液的浓度也会降低,可能会影响肌球蛋白的得率,从而影响后期肌球蛋白凝胶制备时原材料量的制备效果.为了确保肌球蛋白凝胶特性研究的可靠性,研究肌球蛋白蛋白质的提取率和纯度是关键,因此,选择合适的沉淀次数尤为重要,综合考虑得率和纯度,建议选择沉淀次数为3次.
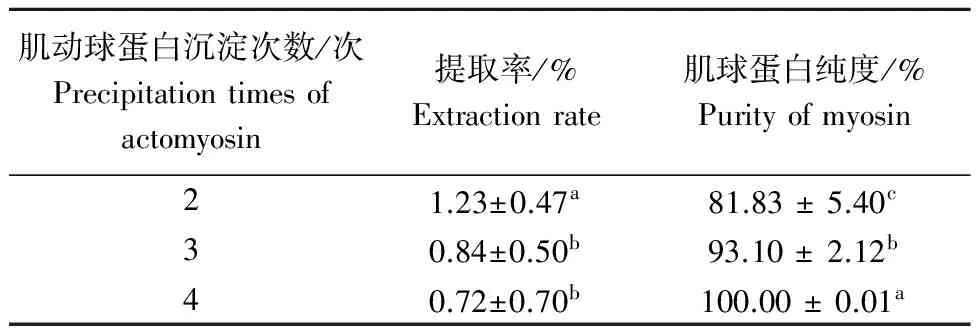
表2 肌动球蛋白沉淀次数对肌球蛋白纯度的影响
2.4硫酸铵饱和浓度对肌球蛋白质纯度的影响
盐析在试验室中常常被用来纯化分离蛋白质.不同的蛋白质溶解度不同,可以通过加入无机盐来控制蛋白质的溶解度,实现蛋白质的沉淀[25,26].随着无机盐加入量的增加,不同蛋白质在析出顺序上有先后差异,因此可以通过控制无机盐加入量,以分级盐析的方式,实现蛋白质的分离纯化.硫酸铵具有溶解度大,随温度变化小,对蛋白质有保护作用,价格低廉等优点,是盐析最常用的无机盐[27].在肌球蛋白质提取过程中,调整硫酸铵饱和度即可分离目的蛋白质.
硫酸铵初始饱和度对肌球蛋白纯度的影响结果见表3.从结果中可以看出,随着硫酸铵初始饱和度的增加,肌球蛋白的纯度呈现先升高,再下降的整体变化趋势;在硫酸铵初始饱和度为33%~37%时,肌球蛋白的纯度显著高于其他各水平,其中35%时,肌球蛋白的纯度最高.

表3 硫酸铵初始饱和度对肌球蛋白纯度的影响
硫酸铵终饱和度对肌球蛋白纯度的影响结果见表4.从结果中可以看出,随着硫酸铵终饱和度的增加,肌球蛋白的纯度呈现先升高,再下降的整体变化趋势;硫酸铵终饱和度为42%~48%时,肌球蛋白的纯度随着终饱和度的增加而升高,但各水平之间差异不显著,其中48%时,肌球蛋白的纯度最高;在50%~54%时,肌球蛋白纯度随着终饱和度的增加而降低,但各水平之间差异均不显著.

表4 硫酸铵终饱和度对肌球蛋提取纯度的影响
3 结论
本试验所建立的电泳试验条件可以用于肌球蛋白的纯度分析.肌动球蛋白的沉淀次数增多可以显著提高肌球蛋白的纯度,但沉淀次数增多就降低了提取率,较低的蛋白质浓度不利于凝胶的制备.因此,采用肌动球蛋白的沉淀次数为3 次比较具有实际意义.硫酸铵分级沉淀中初始饱和浓度为35 %,终饱和浓度为48 %时,肌球蛋白质纯度较高,这些肌球蛋白质的提取方法中涉及的因子和条件的优化为肌球蛋白质凝胶的品质特性研究奠定了基础.
参考文献:
[1]亢春雨,赵春青.鸡胸肉盐溶蛋白热诱导凝胶保水性和超微结构的研究[J].食品科学, 2007,28(1):50-53.
[2]SANO T, NOGUCHI S F, MARSUMOTO J J, et al. Thermal gelation characteristics of myosin subfragments[J]. Journal of Food Science, 1990, 55:55-58,70.
[3]周光宏.畜产品加工学[M]. 北京:中国农业出版社, 2002:35,40,101.
[4]OSADA Y, GONG J P. Nano-biomachine from actin and myosin gels[J]. Polymer Science: Series A, 2009, 51(6): 689-700.
[5]KAKUGO A, SUGIMOTO S, SHIKINAKA K, et al. Characteristics of chemically cross-linked myosin gels[J]. Journal of Biomaterials Science, 2005, 16(2): 203-218.
[6]IWASAKI T, WASHIO M, YAMAMOTO K, et al. Reological and morphological comparison of thermal and hydrostatic pressure-induced filamentous myosin gels[J]. Journal of Food Science,2005,70(7):432-436.
[7]XIONG Y L. Structure-function relationships of muscle protein[M]//DAMODARAN S, PARAF A. Food protein and their application. New York: Marcel Dekker, Inc., 1997: 341-392.
[8]BERTRAM H C, KRISTENSEN M, ØSTDAL H, et al. Does oxidation affect the water functionality of myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2342-2348.
[9]SIEGEL D G, CHURCH K E, SCHMID G R. Gel structure of non-meat proteins as related to their ability to bind meat pieces[J]. Journal of Food Science, 1979,44:1276-1279,1284.
[10]NAUSS K M, KITAGAWA S,GERGELY J. Pyrophosphate binding to and adenosine triphosphatase activity of myosin and its proteolytic fragments[J].Journal of Biological Chemistry, 1969, 244(3): 755-765.
[11]SMYTH A B, SMITH D M, VEGA-WARNER V, et al. Thermal denaturation and aggregation of chicken breast muscle myosin and subfragments[J]. Journal of Agricultural Food Chemistry, 1996, 44: 1005-1010.
[12]WANG S F, SMITH D M. Heat induced denaturation and rheological properties of chicken breast myosin and F-actin in the presence and absence of pyrophosphate[J]. Journal of Agricultural Food Chemistry. 1994, 42, 2665-2670.
[13]WANG S F, SMITH D M. Dynamic rheological properties and secondary structure of chicken breast myosin as influenced by isothermal heating[J]. Journal of Agricultural Food Chemistry. 1994, 42,1434-1439.
[14]WANG S F, SMITH D M. Gelation of chicken breast muscle actomyosin as influenced by weight ratio of actin to myosin[J]. Journal of Agricultural Food Chemistry. 1995, 43, 31-336.
[15]HERMANSSON A M, HARBITZ O, LANGTON M. Formation of two types of gels from bovine myosin[J]. Journal of the Science of Food and Agriculture, 1986,37:69-84.
[16]林丽军.肌球蛋白的ATPase活性及热凝胶特性研究[D].南京:南京农业大学, 2004.
[17]韩敏仪,徐幸莲,林丽军,等.兔骨骼肌肌球蛋白的纯化及溶解度和溶液浊度研究[J].食品科学,2004,25(12):50-54.
[18]张龙翔,张廷芳,李令媛,等.生物化学实验方法和技术[M]. 第2版.北京:高等教育出版社,1997,136-137.
[19]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacerio phage T4[J].Nature, 1970,227:680-685.
[20]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005:63-78.
[21]汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2001: 47-51.
[22]STARR R, OFFER G. Polypeptide chains of intermediate molecular weight in myosin preparations[J].FEBS Letters, 1971, 15(1): 40-44.
[23]白 云,钟国良,周光宏,等.蛋白浓度对兔腰大肌肌球蛋白热凝胶特性的影响[J].食品科学,2009,30(21):83-86.
[24]鲁云霞,周 青,汪惠园,等.兔骨骼肌肌球蛋白轻链的分离纯化[J].安徽医科大学学报, 2000,35(1):14-17.
[25]HEBERT E A, PELHAM P L, PITTMAN B. Determination of the optimal ammonium sulfate concentration for the fractionation of rabbit, sheep, horse and goat antisera[J]. Appl Microbiol, 1973, 25(1): 26-36.
[26]HEBERT E A. Ammonium sulfate fractionation of sera: mouse, hamster, guinea pig, monkey, chimpanzee, swine, chicken, and cattle[J]. Appl Microbiol, 1974, 27(2): 389-394.
[27]罗 磊,朱雅东,丁霄霖.聚丙烯酰胺凝胶电泳研究猪血清蛋白硫酸铵分级盐析[J].食品科学, 2006, 27(2):218-222.

