缺锌玉米植株的傅立叶变换红外光谱研究
王盛锋, 刘云霞, 高丽丽, 韩 亚, 黄金生,Hilman, 刘荣乐, 汪 洪*
(1 中国农业科学院农业资源与农业区划研究所, 农业部植物营养与肥料重点开放实验室, 北京 100081;2 中国农业科学院研究生院, 北京 100081)
锌是植物必需的微量元素,对植物体内碳水化合物、 蛋白质、 生长素等物质代谢以及生长发育具有重要作用[1-2]。世界上缺锌土壤面积约占30%[3],甚至可能高达50%[4]。据1997年公布的全国土壤普查数据,我国缺锌土壤面积约有0.63亿公顷,占当时耕地总面积45.7%。Yang等[5]和Zou等[6]估计我国缺锌土壤面积约在40%以上。北方石灰性土壤上,作物缺锌尤为普遍[7]。玉米对缺锌敏感,缺锌时常表现为茎节间缩短、 新叶失绿黄化,严重时出现坏死性斑点[1-2]。
傅里叶变换红外光谱(fourier transform infrared spectroscopy, FTIR)是一种基于化合物中官能团和极性键振动的结构分析技术,FTIR技术可对样品进行定性和定量分析,具有灵敏度高,制样方法简单,样品用量少,测试时间短等优点[8]。植物体内生物大分子如核酸,脂类和碳水化合物,具有特征性的官能团和独特的分子振动模式(振动的指纹)[9]。通过分析红外光谱吸收位置、 宽度和强度,有助于了解植物体内有机物分子官能团的组成和结构特征[10-11]。欧全宏等[12]利用FTIR研究水稻稻瘟病叶、 玉米和蚕豆锈病叶,发现主要由多糖、 蛋白质的振动吸收谱带组成,叶片中主要成分糖类、 蛋白质和脂类化合物在正常叶片和感病叶片之间存在明显差异。Shi[13]研究发现玉米锈病发病叶和正常叶片的FTIR图谱在酰胺I和II吸收带上差异明显,认为病程相关蛋白在抵抗病原体侵染中起着重要作用。薛生国等[14]进行了紫茉莉对铅胁迫生理响应的FTIR 研究,结果表明, 根组织在3420、 2920、 1610和1060 cm-1等处峰高随铅处理浓度表现为先上升后下降趋势,说明低铅处理下植株体内蛋白质、 氨基酸、 糖类、 羧酸等含量较高,但随铅处理浓度增加,植株体内有机物含量逐渐下降; 叶组织在1650 cm-1处峰高随铅处理浓度升高而升高,这可能与紫茉莉叶中蛋白质和氨基酸等物质含量升高有关。
利用FTIR研究缺锌胁迫下植物体内化学组分的变化,尚未见到有关文献。本试验选择农大108和郑单958两个玉米品种为供试作物,进行营养液培养,研究缺锌胁迫下玉米幼苗生长和锌吸收,利用FTIR对玉米植株不同器官的化学组成进行研究,以期为缺锌影响玉米生长与生理代谢的机理研究提供参考。
1 材料与方法
选取农大108和郑单958两个玉米品种,饱满一致的玉米种子经10% H2O2表面消毒15 min,去离子水洗净,浸泡12 h后,转移到铺有湿滤纸的培养皿中,上盖一层湿纱布,25℃黑暗中催芽1天。选择发芽一致的种子播于洗净的石英砂中,室温下育苗。7天后(两叶一心),选择长势一致的幼苗,去掉胚乳,移栽到500 mL玻璃培养管中进行营养液培养,每管1株。玻璃培养管直径为5 cm,高20 cm,外用黑色塑料布包裹遮光。
基础营养液配方为(mol/L): Ca(NO3)22.0×10-3、 K2SO47.5×10-4、 MgSO46.5×10-4、 KH2PO42.5×10-4、 EDTA-Fe(Ⅱ)1.0×10-4、 H3BO31.0×10-6、 MnSO41.0×10-6、 CuSO41.0×10-7、 (NH4)6Mo7O245.0×10-9。设置缺锌(0 μmol/L)和正常供锌(1 μmol/L)两个处理,代号分别为-Zn 和+Zn。锌以ZnSO4形式供给,每个处理4次重复。营养液pH用NaOH或HCl调到6.2,每隔两天换一次营养液。幼苗培养在人工气候箱进行,控制条件光照时间 12 h,光照强度24000 lx,昼夜温度为25℃/20℃,相对湿度70%。
营养液处理20天后,玉米缺锌症状明显表现为生长矮小、 节间缩短、 叶片黄化。将地上部和根系分开,用直尺测量长度,获得株高和根长; 植株样品经105℃杀青1 h,再在80℃下烘干至恒重,测干重。烘干至恒重的植株样品用HNO3-HClO4(3 ∶1)消煮,原子吸收分光光度计(型号WFX-120C,北京瑞利分析仪器公司)测定消煮液中锌浓度,计算植株中锌含量和锌积累量。收获玉米根系放入FAA固定液(70%酒精 ∶38%甲醛 ∶乙酸体积比=90 ∶5 ∶5)中,利用扫描仪(EsponV 700)扫描根系样品获取数字化图像,利用用WinRHIZO根系分析软件(Regent Instruments Inc., Canada)对图像进行分析,获得根长、 根面积、 根体积等指标。

对数据进行方差统计分析(ANOVA),采用Duncan新复极差方法检验不同处理之间数据的差异显著性(P<0.05)。
2 结果与分析
2.1 生物量和锌含量
缺锌严重影响玉米的生长,植株生长矮小,节间缩短,株高下降,新叶基部出现黄化后白化,并出现坏死性褐色斑点。
表1结果表明,施锌增加地上部干重,而缺锌导致地上部干物质重降低,锌营养对地上部影响显著,而对根系生物量影响不明显。缺锌时根冠比增大,两个品种比较,缺锌条件下农大108具有更大根冠比。不施锌玉米植株地上部和根系中锌含量明显降低。根系锌含量高于地上部锌含量。
缺锌与施锌地上部生物量比值: 农大108为0.45,小于郑单958(0.64),缺锌胁迫下农大108生物量下降较郑单958多。
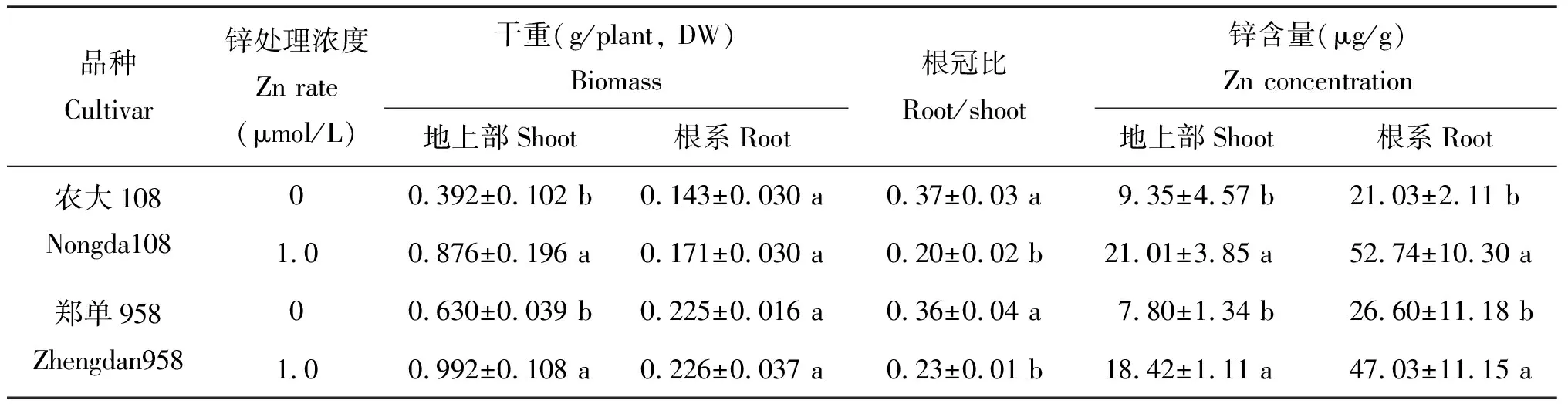
表1 缺锌和施锌处理下玉米生物量和锌含量
2.2 根系形态
与供锌处理相比,缺锌明显降低了农大108根系长、 根面积、 根体积; 郑单958根系各项指标在缺锌和供锌处理之间差异不显著(表2)。

表2 缺锌和施锌处理下玉米根系形态
2.3 FTIR谱图分析
2.3.1 根 FTIR谱分析 图1可以看出,缺锌和施锌处理根系红外光谱的特征峰位置基本相同,但透过率有差异。缺锌根系红外光谱在3410、 2920、 1650、 1380、 1055 cm-1附近透过率较低。
3410 cm-1是自由羟基的伸缩振动峰,主要来自于多糖、 纤维素、 半纤维素等碳水化合物[15]; 1055 cm-1是C-O-C伸缩振动,来源于多糖类[16-18],缺锌条件下两处透过率的升高表明根系碳水化合物的减少。

两品种比较, 农大108根系在缺锌和加锌处理间1540、 1380、 1240 cm-1附近透过率的差异大于郑单958根系,表明农大108根系中蛋白质、 核酸受缺锌影响更大。
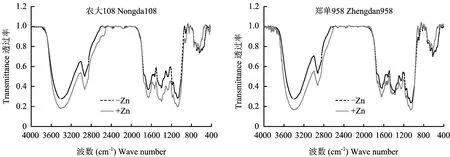
图1 缺锌和施锌处理下农大108和郑单958根FTIR谱图Fig.1 FTIR spectra of roots of maize cultivars, Nongda108 and Zhengdan 958, with and without zinc application
2.3.2 茎FTIR谱分析 图2表明缺锌和供锌处理茎的红外光谱特征峰对应的波数基本相同,缺锌农大108茎的红外光谱在3410、 2920、 1655、 1380、 1240和1055 cm-1附近透过率降低,表明碳水化合物、 脂类、 蛋白质和核酸含量升高。缺锌下郑单958茎的红外光谱在3410、 2920、 1655、 1380 cm-1附近透过率降低,表明碳水化合物、 脂类、 蛋白质含量升高。两品种比较,农大108在3420、 1655、 1380、 1240、 1055 cm-1附近透过率差异较大,郑单958在1240和1055 cm-1透过率基本相同。
缺锌农大108茎中碳水化合物、 脂类、 蛋白质含量增加较多,郑单958茎中核酸和多糖含量受到影响较小。

图2 缺锌和施锌处理下农大108和郑单958茎FTIR谱图Fig.2 FTIR spectra of stems of maize cultivars, Nongda108 and Zhengdan 958, with and without zinc application
2.3.3 叶片FTIR谱分析 从图3可以看出, 与正常供锌处理相比,两个品种缺锌条件下叶片FTIR谱在3420与2920 cm-1处透过率升高,糖类、 纤维素类碳水化合物、 脂类等物质含量下降。
农大108叶片FTIR谱中1655、 1380、 1240和1050 cm-1处透过率升高,蛋白质、 核酸和多糖含量下降。郑单958缺锌叶片红外图谱中1380 cm-1透过率下降,主要是蛋白质中甲基和亚甲基C-H弯曲振动和羧基中C-O弯曲振动减少,蛋白含量受到一定影响,而1650、 1240、 1055 cm-1附近与加锌处理相比无明显变化,酰胺I带蛋白含量和多糖含量受锌影响较小。

图3 缺锌和施锌处理下农大108和郑单958叶片FTIR谱图Fig.3 FTIR spectra of leaves of maize cultivars, Nongda108 and Zhengdan 958, with and without zinc application
3 讨论与结论

将缺锌和正常供锌水平下生物产量的比值定义为玉米锌效率系数,若该系数较低,作物对缺锌相对敏感[24-25]。本试验中供试的两玉米品种比较,缺锌条件下,农大108地上部干物质积累较少,缺锌和施锌处理下地上部生物量比值明显较郑单958小,根冠比较大,农大108比郑单958可能对缺锌更为敏感。
根系形态的差异可能会影响植物对锌吸收利用[26],Dong 等[27]研究发现缺锌条件下小麦锌高效品种细根长度增加,所占比例增多。水稻上的研究也发现在中度缺锌时根系长度、 根面积和根尖数增加,且锌高效品种增加更多[28]。本研究发现缺锌培养20天的玉米品种农大108根系生长受抑,根长、 根面积和根体积下降,而郑单958根系形态变化尚不明显。缺锌时郑单958具有较大根表面积和根体积,细根较多,可能是其对缺锌不敏感的一个重要原因。
FTIR方法测定分子吸收光谱,由分子振动或转动引起偶极矩的净变化产生,从而可以鉴定化合物和分子结构,红外光谱具有“指纹”特征,可对植物所含化学物质提供鉴别[8]。薛生国等[14]和欧全宏等[12]研究发现植物FTIR谱图的特征峰集中在3420、 2920、 1610和1060 cm-1附近,认为主要由多糖、 脂类、 蛋白质的振动吸收谱带组成。本试验发现玉米根、 茎、 叶FTIR谱图特征峰集中在3410、 2920、 1650、 1380、 1055和 1240 cm-1附近,推断主要由碳水化合物、 脂类和蛋白质中基团的振动组成,透射率的高低可近似代表特征物质含量。
本研究发现缺锌处理根系和叶片FTIR图谱中3410和1055 cm-1透过率较高,茎FTIR图谱中此波数附近透过率较低,表明缺锌时碳水化合物在玉米叶片和根系中含量下降,而在茎中可能有所积累。锌是碳酸酐酶和1,5-二磷酸核酮糖羧化酶的组成成分[29-30],缺锌时光合作用下降,碳水化合物代谢受到影响。缺锌菜豆植株中淀粉、 淀粉合成酶活性以及淀粉粒数下降[31],甜菜和玉米中蔗糖合成酶活性降低,蔗糖含量下降[32]。也有报道表明缺锌时菜豆叶片中蔗糖和淀粉含量升高,但根系中碳水化合物的浓度降低,对此的解释是缺锌可能抑制源叶向外运输[33]。植物茎中碳水化合物含量升高可能是由于生长受阻引起的浓度效应。
本研究发现缺锌处理根系和叶片FTIR图谱中1650和1380 cm-1透过率及1240 cm-1处透过率较高,表明缺锌时蛋白质及核酸在玉米叶片和根系中含量下降。李佐同等[34]报道低锌处理降低玉米叶片可溶性蛋白质含量。缺锌植物体内RNase活性升高,导致RNA降解,含量降低,缺锌时核糖体变形、 减少[1,29]。另外锌是RNA聚合酶的必要组分[35],该酶保护核糖RNA免受核糖核酸酶的攻击而降解,缺锌时该酶活性明显下降。另外转录因子锌指蛋白中含有锌,锌指蛋白与特定的靶DNA或靶蛋白结合负责调控基因的表达,影响蛋白质合成,缺锌可能降低锌指蛋白含量。

综上所述,缺锌条件下玉米根系和叶片FTIR谱在波数3410、 2920、 1650、 1380、 1055 cm-1附近处透过率较高,茎FTIR谱在这些波数处透过率较低,表明缺锌导致根系和叶片中碳水化合物、 脂类、 蛋白质及核酸含量下降,而在茎中有所积累。玉米品种农大108植株中各组分变化受缺锌影响较郑单958大。本文结果表明, 利用FTIR技术可揭示缺锌胁迫玉米植株中组分变化。
参考文献:
[1] Marschner H. Mineral nutrition of higher plants (2ndEd.)[M]. Academic Press, 1995.
[2] Alloway B J. Zinc in soils and crop nutrition (2ndEd)[M]. Brussels, Belgium and Paris, France: International Zinc Association and International Fertilizer Industry Association, 2008.
[3] Takkar P N, Walker C D. The distribution and correction of zinc deficiency[A]. Robson A D. Zinc in Soils and Plants [M]. Dordrecht, the Netherlands: Kluwer Academic Publishers, 1993. 151-165.
[4] Alloway B J. Soil factors associated with zinc deficiency in crops and humans[J]. Environmental Geochemistry and Health, 2009, 31(5): 537-548.
[5] Yang X E, Chen W R, Feng Y. Improving human micronutrient nutrition through biofortification in the soil-plant system: China as a case study[J]. Environmental Geochemistry and Health, 2007, 29(5): 413-428.
[6] Zou C, Gao X, Shi Retal. Micronutrient deficiencies in crop production in China[A]. Alloway B J. Micronutrient deficiencies in global crop production[M]. New York: Springer-Verlag Inc. Netherlands, 2008. 127-148.
[7] 刘铮. 中国土壤微量元素[M]. 南京: 江苏科学技术出版社, 1996.
Liu Z. Trace element in soil of China[M]. Nanjing: Jiangsu Science and Technology Press, 1996.
[8] 翁诗甫. 傅立叶变换红外光谱分析[M]. 北京: 化学工业出版社, 2010.
Weng S F. Fourier transform infrared spectrum analysis[M]. Beijing: Chemical Industry Press, 2010.
[9] Griffiths P, De Haseth J A. Fourier transform infrared spectrometry(2nd ed)[M]. NJ, USA: John Wiley & Sons, Inc. Hoboken, 2006.
[10] Mantsch H, Chapman D. Infrared spectroscopy of biomolecules[M]. New York: Wiley-Liss, 1996.
[11] Yee N, Benning L G, Phoenix V Retal. Characterization of metal-cyanobacteria sorption reactions: a combined macroscopic and infrared spectroscopic investigation[J]. Environmental Science & Technology, 2004, 38(3): 775-782.
[12] 欧全宏, 赵兴祥, 周湘萍, 等. 稻瘟病、 玉米锈病和蚕豆锈病叶的傅里叶变换红外光谱研究[J]. 光谱学与光谱分析, 2012, (9): 2389-2392.
Ou Q H, Zhao X X, Zhou X Petal. Research on rice blast, corn and broad bean rust leaves by FTIR spectroscopy[J]. Spectroscopy and Spectral Analysis, 2012, 9: 2389-2392.
[13] Shi Y. Identification of maize southern rust using FTIR spectroscopy[A]. IEEE. Symposium on photonics and optoelectronics (SOPO2012)[C]. Shanghai, 2012. 1-3.
[14] 薛生国,朱锋,叶晟,等. 紫茉莉对铅胁迫生理响应的FTIR研究[J]. 生态学报, 2011, 31(20): 6143-6148.
Xue S G, Zhu F, Ye Setal. Physiological response ofMirabilisjalapaLinn. to lead stress by FTIR spectroscopy[J]. Acta Ecologica Sinica, 2011, 31(20): 6143-6148.
[15] Dziubaa B, Babuchowskia A, Dorota Netal. Identification of lactic acid bacteria using FTIR spectroscopy and cluster analysis[J]. International Dairy Journal, 2007. 17(3): 183-189.
[16] 陆婉珍. 现代近红外光谱分析技术[M]. 北京: 中国石化出版社, 2007.
Lu W Z. Near infrared spectral analysis technology[M]. Beijing: China Petrochemical Press, 2007.
[17] Wong P T, Wong R K, Caputo T Aetal. Infrared spectroscopy of exfoliated human cervical cells: evidence of extensive structural changes during carcinogenesis[J]. Proceedings of the National Academy of Sciences, 1991, 88(24): 10988-10992.
[18] Zeroual W, Choisy C, Doglia S Metal. Monitoring of bacterial growth and structural analysis as probed by FTIR spectroscopy[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1994, 1222(2): 171-178.
[19] Jackson M, Mantsch H H. Biomembrane structure from FTIR spectroscopy[J]. Spectrochimica Acta Reviews, 1993, 15: 53-69.
[20] Williams D H, Fleming I. Spectroscopic methods in organic chemistry (5thEd)[M]. London: McGraw-Hill, 1996.
[21] Salzmann D, Handley R J, Müller-Schärer H. Functional significance of triazine-herbicide resistance in defense ofSeneciovulgarisagainst a rust fungus[J]. Basic and Applied Ecology, 2008, 9(5): 577-587.
[22] 孙素琴, 周群, 陈建波. 中药红外光谱分析与鉴定[M]. 化学工业出版社, 2010.
Sun S Q, Zhou Q, Chen J B. Infrared spectrum analysis and appraisal of Chinese medicine[M]. Chemical Industry Press, 2010.
[23] Nelson W H. Modern Techniques for rapid microbiological analysis[M]. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 1991.
[24] 王景安, 张福锁. 不同锌水平对玉米生长发育和锌吸收的影响[J]. 玉米科学, 1999, 7(3): 73-76.
Wang J A, Zhang F S. The effects of different zinc levels on maize growth and development and zinc uptake[J]. Journal of Maize Science, 1999, 7(3): 73-76.
[25] 赵同科,曹云者,马丽敏,等. 不同玉米基因型缺锌胁迫适应性研究[J]. 华北农学报, 2000, 15(增刊): 64-68.
Zhao T K, Cao Y Z, Ma L Metal. Research on adaptability of different corn genotypes under zinc stress[J]. Acta Agriculturae Boreali-Sinica, 2000, 15(Suppl.): 64-68.
[26] Rengel Z, Graham R D. Wheat genotypes differ in Zn efficiency when grown in chelate-buffered nutrient solution[J]. Plant and Soil, 1995, 176(2): 307-316.
[27] Dong B, Rengel Z, Graham R D. Root morphology of wheat genotypes differing in zinc efficiency[J]. Journal of Plant Nutrition, 1995, 18(12): 2761-2773.
[28] Chen W R, He Z L, Yang X Eetal. Zinc efficiency is correlated with root morphology, ultrastructure, and antioxidative enzymes in rice[J]. Journal of Plant Nutrition, 2009, 32: 287-305.
[29] Brown P H, Cakmak I and Zhang Q. Form and function of zinc in plants [A]. Robson A D. Zinc in Soils and Plants[M]. Dordrecht, the Netherlands: Kluwer Academic Publishers, 1993. 93-106.
[30] Burnell J N. Carbonic anhydrases of higher plants: an overview[A]. Chegwidden W R, Carter N D, Edwards Y H. EXS [M]. Basel, Switzerland: Birkhaeuser Boston, 2000, 90:501-518.
[31] Jyung W H, Ehmann A, Schlender K Ketal. Zinc nutrition and starch metabolism inPhaseolusvulgaris. L[J]. Plant Physiology, 1975, 55(2): 414-420.
[32] Shrotri C K, Tewari M N, Rathore V S. Effect of zinc nutrition on sucrose biosynthesis in maize[J]. Phytochemistry, 1980, 19(1): 139-140.
[33] Marschenr H, Cakmak I. High light intensity enhances chlorosis and nrcrosis in leaves of zinc, phosphorous and magnesium deficient bean (Phaseolusvulgaris) plant[J]. Journal of Plant Physiology, 1989, 134: 308-315.
[34] 李佐同, 杨克军, 王玉凤, 等. 锌对不同基因型玉米幼苗碳氮代谢的影响[J]. 植物生理学通讯, 2010, 7: 664-670.
Li Z T, Yang K J, Wang Y Fetal. The influence of zinc on carbon and nitrogen metabolism of different genotype maize seedling[J]. Plant Physiology Communications, 2010, 7: 664-670.
[35] Falchuk K H, Hardy C, Ulpino Letal. RNA metabolism, manganese, and RNA polymerases of zinc-sufficient and zinc-deficientEuglenagracilis[J]. Proceedings of the National Academy of Sciences, 1978, 75(9): 4175-4179.
[36] 汪洪, 金继运. 铁、 镁、 锌营养胁迫对植物体内活性氧代谢影响机制[J]. 植物营养与肥料学报, 2006, 12(5): 738-744.
Wang H, Jin J Y. Possible effects of iron, magnesium and zinc on the metabolism of reactive oxygen species in plants[J]. Plant Nutrition and Fertilizer Science, 2006, 12(5): 738-744.
[37] Cakmak I. Possible roles of zinc in protecting plant cells from damage by reactive oxygen species[J]. New Phytologist, 2000: 185-205.

